1 . 钠的化合物在生活中司空平常,某化学兴趣小组对几组钠的化合物的样品进行了一系列探究实验。此化学小组同学在课外书中看到:“Na着火时不能用CO2熄灭。”
他们决定探究CO2与Na反应的产物,
Ⅰ.提出猜想:CO2与Na反应可能生成4种物质:C、CO、Na2O和Na2CO3
Ⅱ.查阅资料:
①向PdCl2溶液中通入CO,能产生黑色沉淀。
②CaCl2、NaCl、Na2CO3、NaOH四种溶液分别与无色酚酞溶液作用比较:
Ⅲ.装置设计:(部分夹持仪器已略去)

(1)图中洗气瓶B中盛装一种盐溶液用来除去CO2中的杂质气体,该除杂操作的离子方程式是___________ 。
(2)装置C中盛放的液体试剂的名称是___________ 。
Ⅳ.实验记录
(3)
Ⅴ.实验反思
(4)若步骤③加入的CaCl2溶液量不足,步骤④再取上层清液观察到溶液显红色___________ (选填“可以”或“不可以”)推断出反应产物有Na2O。
(5)若不设置C装置,钠会发生一种副反应干扰实验,该反应的化学方程式是___________ 。
他们决定探究CO2与Na反应的产物,
Ⅰ.提出猜想:CO2与Na反应可能生成4种物质:C、CO、Na2O和Na2CO3
Ⅱ.查阅资料:
①向PdCl2溶液中通入CO,能产生黑色沉淀。
②CaCl2、NaCl、Na2CO3、NaOH四种溶液分别与无色酚酞溶液作用比较:
| 溶质 | CaCl2 | NaCl | Na2CO3 | NaOH |
| 主要实验现象 | 无色 | 无色 | 由无色变为红色 | 由无色变为红色 |

(1)图中洗气瓶B中盛装一种盐溶液用来除去CO2中的杂质气体,该除杂操作的离子方程式是
(2)装置C中盛放的液体试剂的名称是
Ⅳ.实验记录
(3)
| 实验操作 | 主要实验现象 | 实验结论及解释 | |
| ① | 打开a,关闭b,由长颈漏斗注入稀盐酸 | A中产生大量气泡:E中出现浑浊 | 制备CO2成功,可以开始实验 |
| ② | 当E中出现浑浊时,打开b,关闭a,点燃酒精灯 | D中Na剧烈燃烧,产生白烟,银白色固体消失,D内壁附着黑色、白色固体,G中产生黑色沉淀 | 反应产物一定有 |
| ③ | 分离去D中的黑色固体,取D中白色固体的水溶液,再加入足量CaCl2溶液 | 产生白色沉淀 | 反应产物还有 |
| ④ | 取前一步的上层清液,滴加酚酞溶液 | 溶液显红色 | 反应产物还有 |
Ⅴ.实验反思
(4)若步骤③加入的CaCl2溶液量不足,步骤④再取上层清液观察到溶液显红色
(5)若不设置C装置,钠会发生一种副反应干扰实验,该反应的化学方程式是
您最近一年使用:0次
解题方法
2 . 据新浪网报道: 年
年 月
月 日,北京市房山区的瑞莱游泳健身馆发生疑似氯气泄漏,致多人呼吸道不适,出现头晕呕吐症状,
日,北京市房山区的瑞莱游泳健身馆发生疑似氯气泄漏,致多人呼吸道不适,出现头晕呕吐症状, 人送医治疗。氯气是一种重要的化工原料,在工农业生产生活中有着重要的应用。某化学兴趣小组同学利用以下装置制备氯气并对氯气的性质进行探究:
人送医治疗。氯气是一种重要的化工原料,在工农业生产生活中有着重要的应用。某化学兴趣小组同学利用以下装置制备氯气并对氯气的性质进行探究:

(1)仪器 的名称为
的名称为_______ 。
(2)装置 中发生反应的化学方程式为:
中发生反应的化学方程式为:_______ 。
(3)装置 中的实验现象为
中的实验现象为_______ ,装置 中的实验现象为
中的实验现象为_______
(4)整套实验装置存在着明显缺陷,没有尾气处理装置,写出尾气处理的化学方程式_______ 。
(5) 中饱和食盐水的作用是
中饱和食盐水的作用是_______ ,C中应盛浓硫酸作用是_______ 。
(6)E中若装有淀粉碘化钾溶液,能观察到的实验现象是_______ 。
(7) 的密度比空气
的密度比空气_______ ,且_______ (填“能”或“不能”)溶于水,难溶于饱和食盐水,因此可用_______ 法或排饱和食盐水法收集。
 年
年 月
月 日,北京市房山区的瑞莱游泳健身馆发生疑似氯气泄漏,致多人呼吸道不适,出现头晕呕吐症状,
日,北京市房山区的瑞莱游泳健身馆发生疑似氯气泄漏,致多人呼吸道不适,出现头晕呕吐症状, 人送医治疗。氯气是一种重要的化工原料,在工农业生产生活中有着重要的应用。某化学兴趣小组同学利用以下装置制备氯气并对氯气的性质进行探究:
人送医治疗。氯气是一种重要的化工原料,在工农业生产生活中有着重要的应用。某化学兴趣小组同学利用以下装置制备氯气并对氯气的性质进行探究:
(1)仪器
 的名称为
的名称为(2)装置
 中发生反应的化学方程式为:
中发生反应的化学方程式为:(3)装置
 中的实验现象为
中的实验现象为 中的实验现象为
中的实验现象为(4)整套实验装置存在着明显缺陷,没有尾气处理装置,写出尾气处理的化学方程式
(5)
 中饱和食盐水的作用是
中饱和食盐水的作用是(6)E中若装有淀粉碘化钾溶液,能观察到的实验现象是
(7)
 的密度比空气
的密度比空气
您最近一年使用:0次
名校
解题方法
3 . 如图是实验室制备氯气并进行一系列相关实验的装置(部分夹持装置已略去)。
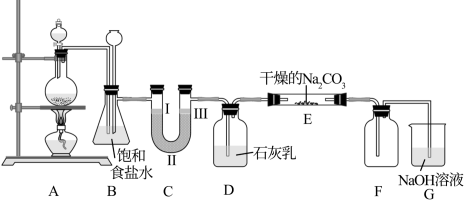
回答下列问题:
(1)装置A中是用MnO2和浓盐酸反应制备Cl2,还生成MnCl2和水,请写出其化学方程式:___________ 。
(2)装置B有安全瓶作用,监测实验进行时C中是否发生堵塞,发生堵塞时B中的现象为___________ 。
(3)装置C的实验目的是验证氯气是否具有漂白性,则C中I、II、III处依次放入____ (填字母)。
(4)装置D用于制取少量漂白粉,漂白粉的有效成分是:___________ (写化学式)。
(5)装置E中潮湿的Cl2与Na2CO3以等物质的量反应,生成NaHCO3、Cl2O气体和另一种盐,试写出该反应的化学方程式:___________ 。
(6)设计实验方案验证实验结束后E中固体中存在 :
:___________ 。
(7)装置G中NaOH溶液的作用是:___________ 。

回答下列问题:
(1)装置A中是用MnO2和浓盐酸反应制备Cl2,还生成MnCl2和水,请写出其化学方程式:
(2)装置B有安全瓶作用,监测实验进行时C中是否发生堵塞,发生堵塞时B中的现象为
(3)装置C的实验目的是验证氯气是否具有漂白性,则C中I、II、III处依次放入
| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 浓硫酸 | 浓硫酸 | 无水氯化钙 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(5)装置E中潮湿的Cl2与Na2CO3以等物质的量反应,生成NaHCO3、Cl2O气体和另一种盐,试写出该反应的化学方程式:
(6)设计实验方案验证实验结束后E中固体中存在
 :
:(7)装置G中NaOH溶液的作用是:
您最近一年使用:0次
4 . 下图是实验室制取、提纯氯气及研究氯气性质的装置图。请回答:
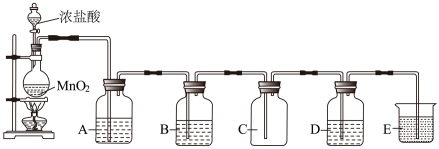
(1)装有浓盐酸的仪器的名称___________ ;A中一般应盛有___________ (填写试剂名称)。
(2)烧瓶中发生反应的化学方程式为___________ 。
(3)若D中盛有紫色石蕊试液,则D中的现象是___________ ,用离子方程式解释这种现象___________ 。
(4)若D中是FeCl2溶液,发生的现象是_______ ,反应的离子方程式为________ 。
(5)若D中盛有KI—淀粉的混合溶液,现象是___________ 。
(6)E中一般应盛有___________ ,其作用是___________ 。
(7)若有17.4gMnO2完全反应,则可生成标准状况下Cl2的体积_______ L。

(1)装有浓盐酸的仪器的名称
(2)烧瓶中发生反应的化学方程式为
(3)若D中盛有紫色石蕊试液,则D中的现象是
(4)若D中是FeCl2溶液,发生的现象是
(5)若D中盛有KI—淀粉的混合溶液,现象是
(6)E中一般应盛有
(7)若有17.4gMnO2完全反应,则可生成标准状况下Cl2的体积
您最近一年使用:0次
5 . 实验室用如下装置制取氯气,并用氯气进行实验。回答下列问题:
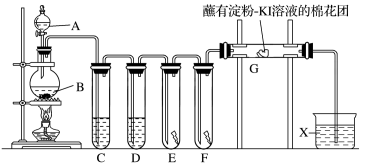
(1)A中盛有浓盐酸,B中盛有MnO2,写出反应的离子方程式:_______ 。
(2)E中为红色干布条,F中为红色湿布条,可观察到的现象是_______ 。对比E和F中现象的差异可得出的结论及解释是_______ 。
(3)试管C和D中试剂各为_______ 。
(4)装置G处发生反应的离子方程式为_______ 。
(5)用离子方程式表示试剂X的作用:_______ 。
(6)家庭中常用消毒液(主要成分为NaClO)与洁厕灵(主要成分为盐酸)清洁卫生。某品牌消毒液包装上说明如下图。
“与洁厕灵同时使用”会产生有毒的氯气,写出反应的离子方程式:_______ 。

(1)A中盛有浓盐酸,B中盛有MnO2,写出反应的离子方程式:
(2)E中为红色干布条,F中为红色湿布条,可观察到的现象是
(3)试管C和D中试剂各为
(4)装置G处发生反应的离子方程式为
(5)用离子方程式表示试剂X的作用:
(6)家庭中常用消毒液(主要成分为NaClO)与洁厕灵(主要成分为盐酸)清洁卫生。某品牌消毒液包装上说明如下图。
| 注意事项: 1.本品对棉织品有漂白脱色作用,对金属制品有腐蚀作用。 2.密封保存,请勿与洁厕灵同时使用。 3.保质期为一年 |
您最近一年使用:0次
2021-09-12更新
|
640次组卷
|
8卷引用:吉林省长春北师大附属学校2021-2022学年高一上学期期中考试化学试题
吉林省长春北师大附属学校2021-2022学年高一上学期期中考试化学试题河北省石家庄市第四中学2020-2021学年高一上学期期中考试化学试题广东省八校2021-2022学年高一上学期期中调研考试 化学试题 (已下线)期中测试卷03-【对点变式题】2021-2022学年高一化学上学期期中期末必考题精准练(人教版2019)广东省深圳市观澜中学2021-2022学年高一上学期期中考试化学试题甘肃省玉门市2021-2022学年高一 上学期“研课标读教材”期中学业质量监测试化学试题(已下线)衔接点16 氯气的性质-2022年初升高化学无忧衔接?山西省稷山中学2021-2022学年高一上学期第二次月考化学试题
6 . 某化学兴趣小组为研究生铁(含碳)与浓硫酸的反应情况及产物性质,设计如下实验。请回答下列问题:
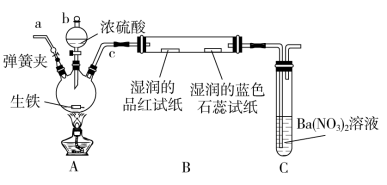
(1)按上图所示装置进行实验(夹持装置及尾气处理装置未画出)。仪器b的名称为__ 装置C中有白色沉淀生成,该沉淀是___ (填化学式)。
(2)装置A中还会产生CO2气体,请写出产生CO2的化学方程式:_____ 。
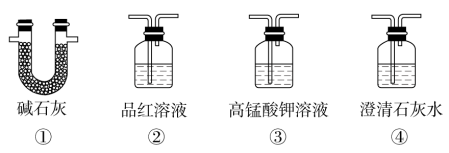
(3)为了验证装置A中产生的气体中含有CO2,应先从下列①~④中选出必要的装置连接A装置中c处管口,从左到右的顺序为__ (填序号);然后再进行的操作是从a处多次鼓入N2,其目的是___ 。
(4)某同学通过验证实验后期装置A中产生的气体中还含有H2,理由是___ (用离子方程式表示)。

(1)按上图所示装置进行实验(夹持装置及尾气处理装置未画出)。仪器b的名称为
(2)装置A中还会产生CO2气体,请写出产生CO2的化学方程式:
(3)为了验证装置A中产生的气体中含有CO2,应先从下列①~④中选出必要的装置连接A装置中c处管口,从左到右的顺序为

(4)某同学通过验证实验后期装置A中产生的气体中还含有H2,理由是
您最近一年使用:0次
2021-07-09更新
|
121次组卷
|
2卷引用:吉林省白城市第一中学2020-2021学年高一下学期期中考试化学试题
2019高三·全国·专题练习
名校
解题方法
7 . 用如图所示装置进行下列实验:将①中浓硫酸溶液滴入②中。预测的现象与结论相符的是
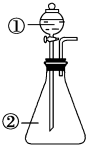

| 选项 | ② | 预测②中现象 | 实验结论 |
| A | 浓盐酸 | 产生大量气体 | 硫酸的酸性比盐酸强 |
| B | 铜片 | 铜片溶解,产生气泡,底部产生灰白色粉末 | 浓硫酸的酸性和强氧化性 |
| C | CuSO4•5H2O | 固体由蓝色变为白色 | 浓硫酸具有吸水性,发生物理变化 |
| D | 蔗糖 | 固体由白色变为黑色海绵状,并有刺激性气体放出 | 浓硫酸具有脱水性、强氧化性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-07-02更新
|
545次组卷
|
14卷引用:吉林省吉化第一高级中学校2021-2022学年高一下学期4月期中考试化学试题
吉林省吉化第一高级中学校2021-2022学年高一下学期4月期中考试化学试题合肥市第九中学2020-2021学年高一下学期期中考试化学试题湖北省襄阳市襄州区第二高级中学2021-2022学年高一下学期期中考试化学试题新疆精河县高级中学2021-2022学年高一下学期期中考试化学试题(已下线)2019年8月19日《每日一题》2020年高考一轮复习—— 浓硫酸的性质(已下线)第15讲 硫及其化合物(精练)-2021年高考化学一轮复习讲练测四川省雅安中学2020-2021学年高一下学期4月月考化学试题辽宁省大连市第一中学2020-2021学年高一下学期4月月考化学试题河北省衡水市第十四中学2020-2021学年高一下学期摸底考试化学试题河南省叶县高级中学2021-2022学年高一下学期5月质量检测化学试题广东省江门市第一中学2021-2022学年高一下学期第一次月考化学试题(已下线)题型51 浓硫酸的性质广东省佛山市第四中学2022-2023学年高一下学期3月月考化学试卷山西省实验中学2022-2023学年高一下学期3月月考化学试题
解题方法
8 . 某学习小组在实验室研究SO2与Ba(NO3)2溶液的反应。
I.[二氧化硫制备]
(1)实验室用亚硫酸钠固体与浓硫酸反应制取二氧化硫,欲收集瓶干燥的二氧化硫,选择图中的装置,其最佳连接顺序为:_______ (按气流方向,用小写字母表示)。

II.[实验探究]向盛有2ml0.1mol/LBa(NO3)2溶液的试管中,缓慢通入SO2气体,试管内有白色沉淀产生。
(2)配制0.1mol/LBa(NO3)2溶液时所用蒸馏水必须先除去溶液中溶解的氧气,最简单的方法是______ 。
(3)将SO2分别通入无氧、有氧且浓度均为0.1mol·L-1的BaCl2溶液和Ba(NO3)2溶液中,探究NO 和O2哪种微粒起到了主要氧化作用,实验记录如下:
和O2哪种微粒起到了主要氧化作用,实验记录如下:
曲线a所示溶液pH降低的原因_______ (结合方程式回答),曲线c所示溶液中所发生的离子反应方程式为_______ ,曲线d_______ (填“能”或“不能”)说明NO 是氧化SO2的主要微粒,其理由是
是氧化SO2的主要微粒,其理由是_______ 。
I.[二氧化硫制备]
(1)实验室用亚硫酸钠固体与浓硫酸反应制取二氧化硫,欲收集瓶干燥的二氧化硫,选择图中的装置,其最佳连接顺序为:

II.[实验探究]向盛有2ml0.1mol/LBa(NO3)2溶液的试管中,缓慢通入SO2气体,试管内有白色沉淀产生。
(2)配制0.1mol/LBa(NO3)2溶液时所用蒸馏水必须先除去溶液中溶解的氧气,最简单的方法是
(3)将SO2分别通入无氧、有氧且浓度均为0.1mol·L-1的BaCl2溶液和Ba(NO3)2溶液中,探究NO
 和O2哪种微粒起到了主要氧化作用,实验记录如下:
和O2哪种微粒起到了主要氧化作用,实验记录如下:| 实验记录 | |
| pH变化 |  |
| 溶液中是否产生沉淀 | BaCl2溶液(无氧)中无白色沉淀、BaCl2溶液(有氧)中有白色沉淀Ba(NO3)2溶液(无氧)中有白色沉淀、Ba(NO3)2溶液(有氧)中有白色沉淀 |
 是氧化SO2的主要微粒,其理由是
是氧化SO2的主要微粒,其理由是
您最近一年使用:0次
解题方法
9 . 某校课外活动小组为了探究铜与稀硝酸反应产生的是NO气体,设计了如下实验。实验装置如图所示(已知NO、NO2能与NaOH溶液反应):
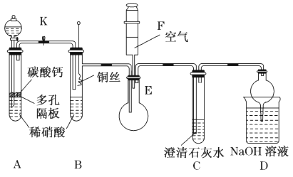
(1)设计装置A的目的是___________ ,为达此目的应进行的操作是___________
(2)A中反应的化学方程式是___________ 。
(3)在(1)中的操作后将装置B中铜丝插入稀硝酸,并微热之,观察到装置B中的现是___________ 。
(4)B中反应的离子方程式是___________ 。
(5)D装置的作用是___________ 。

(1)设计装置A的目的是
(2)A中反应的化学方程式是
(3)在(1)中的操作后将装置B中铜丝插入稀硝酸,并微热之,观察到装置B中的现是
(4)B中反应的离子方程式是
(5)D装置的作用是
您最近一年使用:0次
名校
解题方法
10 . I.某课外活动小组为了检验钠与水反应的产物,设计如图装置(夹持装置省略)。首先在U形管内加入少量煤油和几粒钠块,再从U形管高端加入水(含有酚酞),赶出空气,过一会儿点燃酒精灯加热铜丝。
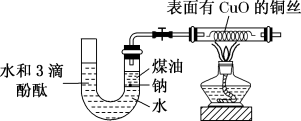
根据反应中观察到的现象,回答下列问题:
(1)反应过程中金属钠除了逐渐变小外,还有什么现象___________ 。请写出该反应的化学方程式:___________ 。
(2)铜丝的变化现象为___________ ,反应的化学方程式是___________ 。
Ⅱ.现用金属钠和空气制备纯度较高的Na2O2,可利用的装置如下图。

回答下列问题。
(1)上述装置④中盛放的试剂是___________ ,为完成实验应将装置④接在___________ (填字母)。
A.①之前B.①和②之间C.②和③之间D.③之后
(2)装置②中Na生成Na2O2的化学方程式___________ 。
(3)若ag钠与bg水完全反应,则该溶液溶质的质量分数是___________ 。

根据反应中观察到的现象,回答下列问题:
(1)反应过程中金属钠除了逐渐变小外,还有什么现象
(2)铜丝的变化现象为
Ⅱ.现用金属钠和空气制备纯度较高的Na2O2,可利用的装置如下图。

回答下列问题。
(1)上述装置④中盛放的试剂是
A.①之前B.①和②之间C.②和③之间D.③之后
(2)装置②中Na生成Na2O2的化学方程式
(3)若ag钠与bg水完全反应,则该溶液溶质的质量分数是
您最近一年使用:0次
2020-12-28更新
|
216次组卷
|
3卷引用:吉林省汪清县汪清第四中学2020-2021学年高一上学期期中考试化学试题
吉林省汪清县汪清第四中学2020-2021学年高一上学期期中考试化学试题(已下线)第08练 钠及其化合物-2022年【寒假分层作业】高一化学(苏教版2019必修第一册)湖北省武汉市第一中学2023-2024学年高一上学期10月月考化学试题



