名校
解题方法
1 . 某学习小组通过下列装置探究 与
与 能否反应产生
能否反应产生 。
。
已知:①溴水为橙色
②三氯化铁常温下为固体,熔点为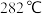 ,沸点为
,沸点为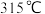 ,在
,在 以上易升华;易溶于水。
以上易升华;易溶于水。
(1)现象ⅰ中的白雾成分是___________ (化学式)。
(2)分析现象ⅱ,该小组探究黄色气体的成分,实验如下:
a.加热 ,产生白雾和黄色气体。
,产生白雾和黄色气体。
b.用 溶液检验现象ⅱ和a中的黄色气体,溶液均变红。
溶液检验现象ⅱ和a中的黄色气体,溶液均变红。
通过该实验说明现象ⅱ中黄色气体含有___________ (化学式)。
(3)除了氯气可使B中溶液变蓝外,推测还可能的原因是:
①实验b检出的气体使之变蓝,反应的离子方程式是___________ ,实验证实此推测成立。
②溶液变蓝的另外一种原因是:在酸性条件下,装置中的空气使之变蓝。通过实验进一步验证与空气无关。
(4)为进一步确认黄色气体是否含有 ,小组提出两种方案,并证实了
,小组提出两种方案,并证实了 的存在。
的存在。
方案1:在A、B间增加盛有某种试剂的洗气瓶C。
方案2:将B中 淀粉溶液替换为
淀粉溶液替换为 溶液,并检验反应后是否存在
溶液,并检验反应后是否存在 。现象如下:
。现象如下:
①方案1的C中盛放的试剂是___________ 。
②方案2中检验 的原因是
的原因是___________ 。
③综合方案1、2的现象,说明选择 溶液是由氧化剂氧化性的强弱决定,其氧化剂的氧化性由强到弱的顺序为
溶液是由氧化剂氧化性的强弱决定,其氧化剂的氧化性由强到弱的顺序为___________ 。
 与
与 能否反应产生
能否反应产生 。
。已知:①溴水为橙色
②三氯化铁常温下为固体,熔点为
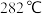 ,沸点为
,沸点为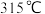 ,在
,在 以上易升华;易溶于水。
以上易升华;易溶于水。| 操作 | 现象 | 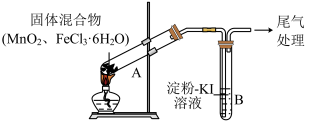 |
| 点燃酒精灯,加热 | ⅰ.A中部分固体溶解,上方出现白雾 ⅱ.稍后,产生黄色气体,管壁附着黄色液滴 ⅲ.B中溶液变蓝 |
(1)现象ⅰ中的白雾成分是
(2)分析现象ⅱ,该小组探究黄色气体的成分,实验如下:
a.加热
 ,产生白雾和黄色气体。
,产生白雾和黄色气体。b.用
 溶液检验现象ⅱ和a中的黄色气体,溶液均变红。
溶液检验现象ⅱ和a中的黄色气体,溶液均变红。通过该实验说明现象ⅱ中黄色气体含有
(3)除了氯气可使B中溶液变蓝外,推测还可能的原因是:
①实验b检出的气体使之变蓝,反应的离子方程式是
②溶液变蓝的另外一种原因是:在酸性条件下,装置中的空气使之变蓝。通过实验进一步验证与空气无关。
(4)为进一步确认黄色气体是否含有
 ,小组提出两种方案,并证实了
,小组提出两种方案,并证实了 的存在。
的存在。方案1:在A、B间增加盛有某种试剂的洗气瓶C。
方案2:将B中
 淀粉溶液替换为
淀粉溶液替换为 溶液,并检验反应后是否存在
溶液,并检验反应后是否存在 。现象如下:
。现象如下:| 方案1 | B中溶液变为蓝色 |
| 方案2 | B中溶液呈橙色;未检出 |
②方案2中检验
 的原因是
的原因是③综合方案1、2的现象,说明选择
 溶液是由氧化剂氧化性的强弱决定,其氧化剂的氧化性由强到弱的顺序为
溶液是由氧化剂氧化性的强弱决定,其氧化剂的氧化性由强到弱的顺序为
您最近一年使用:0次
2024-02-27更新
|
114次组卷
|
3卷引用:吉林省长春市东北师大附中2023-2024学年高一上学期期末考试化学试题
名校
2 . 铁是生产、生活及生命中的重要元素。回答下列问题:
(1)铁在元素周期表中的位置为______ 。
(2)碳酸亚铁可用于治疗缺铁性贫血。某研究性学习小组同学欲通过硫酸亚铁与碳酸氢钠反应在实验室中制备碳酸亚铁(装置如下图所示)。
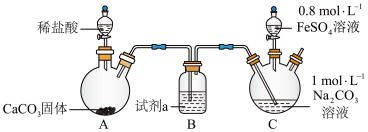
向装置C的碳酸钠溶液中通入一段时间CO2至pH约为7,再滴加一定量FeSO4溶液,产生白色沉淀,经过滤、洗涤、干燥,得到FeCO3固体。
①图1中装有稀盐酸的仪器名称为______ 。
②向碳酸钠溶液中通入CO2的目的有______ 、______ 。
③试剂a是______ ,装置C中制取FeCO3的离子方程式为______ 。
(3)化合物M是某种具有磁学性质的新型电子材料的主要成分,由两种元素组成。为了研究其组成,设计如下实验:
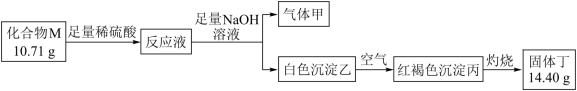
气体甲可使湿润红色石蕊试纸变蓝。请回答:M的化学式______ 。
(1)铁在元素周期表中的位置为
(2)碳酸亚铁可用于治疗缺铁性贫血。某研究性学习小组同学欲通过硫酸亚铁与碳酸氢钠反应在实验室中制备碳酸亚铁(装置如下图所示)。

向装置C的碳酸钠溶液中通入一段时间CO2至pH约为7,再滴加一定量FeSO4溶液,产生白色沉淀,经过滤、洗涤、干燥,得到FeCO3固体。
①图1中装有稀盐酸的仪器名称为
②向碳酸钠溶液中通入CO2的目的有
③试剂a是
(3)化合物M是某种具有磁学性质的新型电子材料的主要成分,由两种元素组成。为了研究其组成,设计如下实验:

气体甲可使湿润红色石蕊试纸变蓝。请回答:M的化学式
您最近一年使用:0次
2023-12-14更新
|
478次组卷
|
4卷引用:吉林省通化市梅河口市第五中学2023-2024学年高一上学期1月期末化学试题
3 . 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应,应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”,请回答该实验中的问题。_______ ,该反应的氧化剂是_______ 。
(2)圆底烧瓶中盛装的水,该装置受热后的主要作用是_______ ;烧瓶底部放置了几片碎瓷片,其作用是_______ 。
(3)酒精灯和酒精喷灯点燃的顺序是先点燃_______ 。
(4)试管中收集气体是_______ ,如果要在A处玻璃管处点燃该气体,则必须对该气体进行_______ 。
(5)若该反应中有16.8gFe参加反应,则生成H2的质量为_______ g。
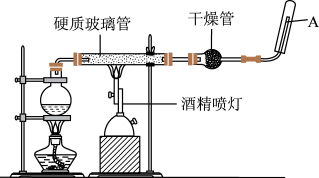
(2)圆底烧瓶中盛装的水,该装置受热后的主要作用是
(3)酒精灯和酒精喷灯点燃的顺序是先点燃
(4)试管中收集气体是
(5)若该反应中有16.8gFe参加反应,则生成H2的质量为
您最近一年使用:0次
2023-03-02更新
|
132次组卷
|
2卷引用:吉林省洮南市第一中学2022-2023学年高一上学期期末考试化学试题
名校
解题方法
4 . 某兴趣小组为了探究SO2气体还原Fe3+的反应,他们使用的药品和装置如下图所示,下列说法不合理的是
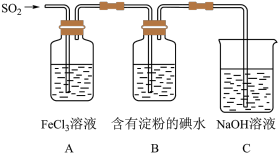
| A.能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色 |
| B.装置C的作用是吸收SO2尾气,防止污染空气 |
| C.为了验证A中发生了氧化还原反应,加入酸性KMnO4溶液,紫色褪去 |
| D.为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀 |
您最近一年使用:0次
2023-02-21更新
|
923次组卷
|
55卷引用:2015-2016学年吉林省松原市油田高中高二下期末化学试卷
2015-2016学年吉林省松原市油田高中高二下期末化学试卷2015-2016学年黑龙江省大庆铁人中学高一上期末化学试卷【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高一上学期期末考试化学试题安徽省滁州市定远县重点中学2018-2019学年高一上学期期末考试化学试题云南省丽江市宁蒗县第一中学2019—2020学年高一上学期期末考试化学试题云南省曲靖市罗平县第三中学2019-2020学年高一上学期期末考试化学试题云南省曲靖市沾益县炎方一中2019-2020学年高一上学期期末考试化学试题(已下线)2014年高考化学鲁科版3.3硫的转化练习卷2015-2016学年河北石家庄一中高一下学情反馈一化学卷2017届广东省中山一中高三上学期第一次统测化学试卷2017届黑龙江省牡丹江高级中学高三10月月考化学卷2017届河北省衡水中学高三上期中化学卷2017届山东省莱芜一中高三上学期10月月考化学试卷2017届河南省南阳一中高三上第三次周考化学卷福建省泰宁第一中学2018届高三上学期第一阶段考试化学试题宁夏石嘴山市第三中学2018届高三上学期期中考试化学试题(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第3讲 硫及其化合物【押题专练】(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第3讲 硫及其化合物【教学案】【全国百强校】黑龙江省牡丹江市第一高级中学2019届高三上学期期中考试化学试题山东省东营市第二中学2019届高三上学期模块考试(期中)化学试题贵州省剑河县第二中学2018-2019学年高一上学期12月份考试化学试题甘肃省甘谷第一中学2020届高三上学期第一次检测化学试题云南省西畴县二中2019-2020学年高二上学期开学考试化学试题苏教版高中化学必修1专题4《硫 氮可持续发展》测试卷河南省商丘市第一高级中学2020届高三上学期期中考试化学试题河南省开封市第二十五中2019-2020高一下学期初分科考试化学试卷(已下线)专题4.3 硫及其化合物(练)——2020年高考化学一轮复习讲练测河北省衡水市桃城区第十四中学2019-2020学年高一下学期第五次综合测试化学试题(已下线)第四单元 非金属及其化合物测试题-2021年高考化学一轮复习名师精讲练(已下线)第15讲 硫及其化合物(精练)-2021年高考化学一轮复习讲练测福建省福州市闽江口联盟校2021届高三上学期期中联考化学试题(已下线)练习9 硫和二氧化硫-2020-2021学年【补习教材·寒假作业】高一化学(人教版2019)浙江省温州市瑞安市上海新纪元高级中学2021-2022学年高一9月份月考(5-6班)化学试题(已下线)4.2.1 含硫物质之间的转化(备作业)-【上好课】2021-2022学年高一化学同步备课系列(苏教版2019必修第一册)河南省林州市第一中学2021-2022学年高一下学期开学检测化学试题课后-5.1.3 不同价态含硫物质的转化-人教2019必修第二册广东省佛山市第一中学2021-2022学年高一下学期第一次段考(3月)化学试题湖南省常德市安乡县第一中学2021-2022 学年高二下学期期中考试化学试题湖南省湘潭市湘潭县第一中学2021-2022学年高三下学期期中考试化学试题上海交通大学附属中学2022-2023学年高二上学期开学摸底考试化学试题湖北省公安县第三中学2021-2022学年高三上学期8月质量检测化学试题安徽省宿州市第二中学2022-2023学年高一上学期第一次月考化学试题安徽省阜阳市第一中学2022-2023学年高一下学期第一次月考化学试题安徽省安庆市第一中学2022-2023学年高一下学期第一次月考化学试题安徽省亳州市第一中学2022-2023学年高一下学期第一次月考化学试题河南省郑州外国语学校2022-2023学年高一下学期第一次月考化学试题安徽省阜阳市太和中学2022-2023学年高一下学期第一次质量检测化学试题四川省广安市育才学校2022-2023学年高一下学期3月月考化学试题广东省广州市培英中学2022-2023学年高一下学期期中考试化学试题湖南省衡阳县第四中学2022-2023学年高一下学期第一次(3月)月考化学试题湖南省株洲市炎陵县2022-2023学年高一下学期3月月考化学试题安徽省淮北市树人高级中学2023-2024学年高一下学期开学考试化学试题北京师范大学第二附属中学2023-2024学年高一下学期3月化学测试题安徽省芜湖市第一中学2022-2023学年高一下学期3月份教学质量诊断测试化学试卷山西省大同市第一中学校2023-2024学年高一下学期4月期中考试化学试题
名校
5 . 某课外活动小组设计实验验证二氧化碳跟过氧化钠反应时需要与水接触。下列说法中正确的是
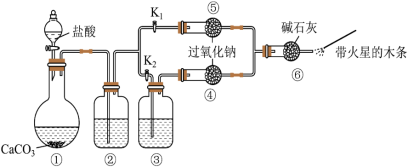

| A.装置①中盐酸不能换成硫酸 |
B.装置②中的试剂是饱和 溶液 溶液 |
C.打开弹簧夹 ,关闭 ,关闭 ,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处,木条复燃 ,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处,木条复燃 |
| D.上述实验不足以证明有水存在时过氧化钠跟二氧化碳发生了化学反应 |
您最近一年使用:0次
2022-12-07更新
|
191次组卷
|
2卷引用:吉林省延边州2022-2023学年高一上学期期末学业质量检测化学试题
解题方法
6 . 某同学为了验证硫铁矿(主要成分为FeS2。含有少量的碳)焙烧产物(产生的气体是SO2,CO2),设计如下装置进行实验:
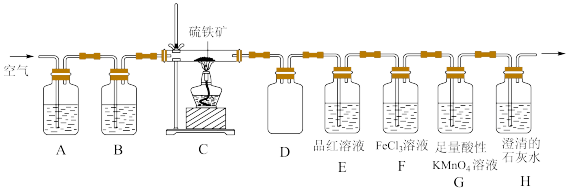
回答下列问题:
(1)装置A、B中的试剂分别是_______ 、_______ 。
(2)装置D的作用是_______ 。
(3)验证焙烧后气体产物的实验现象分别为_______ 、_______ ;若F中颜色发生改变,写出产生颜色变化反应的离子方程式:_______ 。取F中反应后的溶液于洁净的试管中。滴加少量KSCN溶液,溶液不变红,说明溶液中_______ (填“含有”或“不含有”)Fe3+;再继续滴加少量氯水,溶液也不变红。产生这种现象的原因可能是_______ 。
(4)G中盛放足量酸性KMnO4溶液的目的是_______ (用离子方程式表示)。
(5)反应完成后经检验,C中剩余固体物质只有Fe2O3,写出FeS2焙烧反应的化学方程式:_______ 。

回答下列问题:
(1)装置A、B中的试剂分别是
(2)装置D的作用是
(3)验证焙烧后气体产物的实验现象分别为
(4)G中盛放足量酸性KMnO4溶液的目的是
(5)反应完成后经检验,C中剩余固体物质只有Fe2O3,写出FeS2焙烧反应的化学方程式:
您最近一年使用:0次
7 . 用如图所示装置进行Fe与水蒸气反应的实验,下列有关说法正确的是

| A.实验时,先点燃酒精喷灯再点燃酒精灯 |
| B.反应中H2O作氧化剂,发生反应的化学方程式为2Fe+3H2O=Fe2O3+3H2 |
| C.干燥管中加入的固体干燥剂可以是无水氯化钙 |
| D.收集反应产生的气体选用装置② |
您最近一年使用:0次
2022-07-18更新
|
1130次组卷
|
13卷引用:吉林省磐石一中、伊通一中、梅河口五中、四平一中等2020-2021学年高一上学期期末考试化学试题
吉林省磐石一中、伊通一中、梅河口五中、四平一中等2020-2021学年高一上学期期末考试化学试题湖北省十堰市2020-2021学年高一上学期期末考试化学试题安徽省皖西南联盟2020-2021学年高一上学期期末考试化学试题江西省抚州市2020-2021学年高一上学期学生学业发展水平测试(期末考试) 化学(B卷) 试题黑龙江省哈尔滨师范大学附属中学2021-2022学年高一下学期期末考试化学试题吉林省吉林市第一中学2023-2024学年高一上学期11月期中化学试题(已下线)新人教必修1第3章第一节第1课时铁的单质(课后)(已下线)《新教材变化解读及考法剖析 》(人教版2019必修第一册)第三章河北省衡水市第十四中学2020-2021学年高一下学期摸底考试化学试题(已下线)第三章 铁 金属材料(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第一册)福建省龙岩第一中学2022-2023学年高一上学期第二次月考化学试题(已下线)考点巩固卷03 金属及其化合物(4大考点48题)-2024年高考化学一轮复习考点通关卷(新高考通用)(已下线)课时1 铁的单质
8 . 某化学兴趣小组探究SO2与Ca( NO3)2溶液的反应。
I.实验一:用如下装置制备SO2,然后将SO2通入Ca(NO3)2溶液中,有白色沉淀M产生。

(1)固体a是_______ (写名称) 。
(2)装置D的作用是_______ 。
(3)配制1mol·L-1Ca(NO3)2溶液时所用蒸馏水必须除去溶解的氧气,除氧方法是_______ 。
II.根据所学知识推测:白色沉淀M可能为CaSO3或CaSO4也可能是二者混合物。(查阅资料得知:CaSO4微溶于水;CaSO3难溶于水。)
实验二:探究白色沉淀M的成分。反应后将装置C中物质转移到烧杯中静置,利用倾析法倾倒出上层清液,抽滤,洗涤得到沉淀M。取沉淀M少许于试管中,加入过量的稀HCI,充分反应,发现沉淀部分溶解。由此可知白色沉淀M含有CaSO3。
(4)适合利用倾析法将下列物质与水分离的是_______
(5)取加入过量稀HCl静置后的上层溶液于试管中,加入一种试剂,可进一步证实沉淀M中含有CaSO3,则所加试剂及现象是_______ 。
实验三:探究SO 的产生途径,将SO2分别缓慢通入物质的量浓度相等的无氧CaCl2 溶液、有氧CaCl2溶液、无氧Ca( NO3)2溶液中,一段时间后,测溶液的pH ,结果表明:①无氧CaCl2溶液中无沉淀,其它两溶液中均有沉淀;②三种溶液均呈酸性,其中无氧CaCl2溶液酸性最弱,有氧CaCl2溶液酸性最强。
的产生途径,将SO2分别缓慢通入物质的量浓度相等的无氧CaCl2 溶液、有氧CaCl2溶液、无氧Ca( NO3)2溶液中,一段时间后,测溶液的pH ,结果表明:①无氧CaCl2溶液中无沉淀,其它两溶液中均有沉淀;②三种溶液均呈酸性,其中无氧CaCl2溶液酸性最弱,有氧CaCl2溶液酸性最强。
(6)有氧CaCl2溶液中通入SO2发生反应的离子方程式为_______ 。
(7)从上述实验现象可得出对SO2氧化起主要作用的是_______ (填O2或NO ),其理由是
),其理由是_______ 。
I.实验一:用如下装置制备SO2,然后将SO2通入Ca(NO3)2溶液中,有白色沉淀M产生。

(1)固体a是
(2)装置D的作用是
(3)配制1mol·L-1Ca(NO3)2溶液时所用蒸馏水必须除去溶解的氧气,除氧方法是
II.根据所学知识推测:白色沉淀M可能为CaSO3或CaSO4也可能是二者混合物。(查阅资料得知:CaSO4微溶于水;CaSO3难溶于水。)
实验二:探究白色沉淀M的成分。反应后将装置C中物质转移到烧杯中静置,利用倾析法倾倒出上层清液,抽滤,洗涤得到沉淀M。取沉淀M少许于试管中,加入过量的稀HCI,充分反应,发现沉淀部分溶解。由此可知白色沉淀M含有CaSO3。
(4)适合利用倾析法将下列物质与水分离的是_______
| A.易沉淀固体 | B.胶状物质 | C.大颗粒沉淀 | D.絮状物质 |
实验三:探究SO
 的产生途径,将SO2分别缓慢通入物质的量浓度相等的无氧CaCl2 溶液、有氧CaCl2溶液、无氧Ca( NO3)2溶液中,一段时间后,测溶液的pH ,结果表明:①无氧CaCl2溶液中无沉淀,其它两溶液中均有沉淀;②三种溶液均呈酸性,其中无氧CaCl2溶液酸性最弱,有氧CaCl2溶液酸性最强。
的产生途径,将SO2分别缓慢通入物质的量浓度相等的无氧CaCl2 溶液、有氧CaCl2溶液、无氧Ca( NO3)2溶液中,一段时间后,测溶液的pH ,结果表明:①无氧CaCl2溶液中无沉淀,其它两溶液中均有沉淀;②三种溶液均呈酸性,其中无氧CaCl2溶液酸性最弱,有氧CaCl2溶液酸性最强。(6)有氧CaCl2溶液中通入SO2发生反应的离子方程式为
(7)从上述实验现象可得出对SO2氧化起主要作用的是
 ),其理由是
),其理由是
您最近一年使用:0次
2022-02-17更新
|
613次组卷
|
2卷引用:吉林省长春市博硕学校(原北师大长春附属学校)2021-2022学年高二下学期期末考试化学试题
名校
9 . 用如图所示实验装置进行相关实验探究,下列说法不合理的是

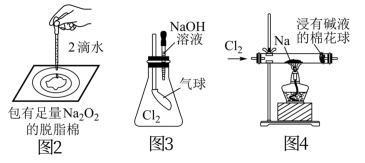


| A.图1若二氧化锰过量,则浓盐酸可全部反应完 |
| B.图2证明Na2O2与水反应放热 |
| C.图3证明Cl2能与烧碱溶液反应 |
| D.图4探究钠与Cl2反应 |
您最近一年使用:0次
2022-01-05更新
|
289次组卷
|
2卷引用:吉林省吉林松花江中学2022-2023学年高一上学期1月期末考试化学试题
解题方法
10 . I.在碘化钾和硫酸的混合溶液中加入过氧化氢水溶液,迅速发生反应放出大量气体,反应过程可表示如下:
①H2O2+2KI+H2SO4=I2+K2SO4+2H2O;
②H2O2+I2=2HIO;
③H2O2+2HIO=I2+O2↑+2H2O
(1)H2O2在反应③中的作用是______ (填正确选项的标号)
A.氧化剂 B.还原剂 C.既是氧化剂又是还原剂 D.既不是氧化剂也不是还原剂
(2)有人认为上述反应说明了碘单质是过氧化氢分解的催化剂,你认为______ (填“对”或“不对”),其理由是______ 。
(3)上述反应说明H2O2、I2、HIO氧化性从强到弱的顺序是______ >______ >______ 。
II.硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验室通过如下实验由废铁屑制备FeSO4·7H2O晶体:
①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2~3遍;
②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80℃之间至铁屑耗尽;
③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。请回答下列问题:
(1)Fe(OH)3在碱性介质中与NaClO反应生成Na2FeO4和NaCl,写出Fe(OH)3与NaClO在碱性介质中反应的离子方程式是______ 。
(2)硫酸亚铁制备中实验步骤①的目的是______ 。
(3)实验步骤②明显不合理,理由是______ 。
(4)实验步骤④中用少量冰水洗涤晶体,其目的是______ 。
①H2O2+2KI+H2SO4=I2+K2SO4+2H2O;
②H2O2+I2=2HIO;
③H2O2+2HIO=I2+O2↑+2H2O
(1)H2O2在反应③中的作用是
A.氧化剂 B.还原剂 C.既是氧化剂又是还原剂 D.既不是氧化剂也不是还原剂
(2)有人认为上述反应说明了碘单质是过氧化氢分解的催化剂,你认为
(3)上述反应说明H2O2、I2、HIO氧化性从强到弱的顺序是
II.硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验室通过如下实验由废铁屑制备FeSO4·7H2O晶体:
①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2~3遍;
②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80℃之间至铁屑耗尽;
③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。请回答下列问题:
(1)Fe(OH)3在碱性介质中与NaClO反应生成Na2FeO4和NaCl,写出Fe(OH)3与NaClO在碱性介质中反应的离子方程式是
(2)硫酸亚铁制备中实验步骤①的目的是
(3)实验步骤②明显不合理,理由是
(4)实验步骤④中用少量冰水洗涤晶体,其目的是
您最近一年使用:0次



