1 . 实验室用如图装置制取氯气,并用氯气进行实验。回答下列问题:
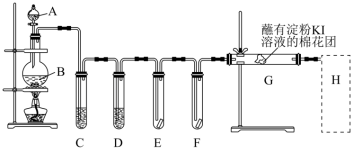
(1)A中盛有浓盐酸,B中盛有MnO2。D中盛放浓H2SO4的目的是_______ 。
(2)E中为红色干布条,F中为红色湿布条,可观察到的现象是_______ ,对比E和F中现象的差异可得出的结论是_______ 。
(3)G处的现象是________ 。
(4)用化学方程式表示H处尾气吸收装置中的反应原理:_______ 。
(5)家庭中常用消毒液(主要成分为NaClO)与洁厕灵(主要成分为盐酸)清洁卫生。某品牌消毒液包装上说明如图。
消毒液与洁厕灵不能同时使用,原因是(用离子方程式表示)________ 。

(1)A中盛有浓盐酸,B中盛有MnO2。D中盛放浓H2SO4的目的是
(2)E中为红色干布条,F中为红色湿布条,可观察到的现象是
(3)G处的现象是
(4)用化学方程式表示H处尾气吸收装置中的反应原理:
(5)家庭中常用消毒液(主要成分为NaClO)与洁厕灵(主要成分为盐酸)清洁卫生。某品牌消毒液包装上说明如图。
| 注意事项: 1.本品对棉织品有漂白脱色作用,对金属制品有腐蚀作用。 2.密封保存,请勿与洁厕灵同时使用。 3.保质期为一年。 |
您最近一年使用:0次
名校
2 . 为探究物质的氧化性,某实验小组设计如图实验,在实验过程中,观察到氯化亚铁溶液变黄,四氯化碳溶液变为紫红色。下列说法错误的是(已知:碘单质易溶于四氯化碳,可得到紫红色溶液)


A.烧瓶中的反应为: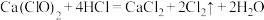 |
B.浸有 溶液的棉花起吸收尾气的作用 溶液的棉花起吸收尾气的作用 |
C. 可用淀粉溶液替换 可用淀粉溶液替换 |
D.试管下层出现紫红色,可证明氧化性: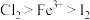 |
您最近一年使用:0次
2023-11-15更新
|
980次组卷
|
7卷引用:辽宁省沈阳市重点高中五校协作体2023-2024学年高一上学期1月期末化学试题
3 . 氮是我们熟悉的典型非金属元素,研究它及其化合物的性质对于生产、生活、科研具有重要意义。请回答以下问题:
I.
(1)下图为制取氨气的装置和选用的试剂,其中错误的是___________(填序号)。

II.除去工业尾气中的氮氧化合物( ),常用氨催化吸收法,原理是
),常用氨催化吸收法,原理是 与
与 反应生成无毒物质。某同学在实验室里采用以下装置和步骤模拟工业上
反应生成无毒物质。某同学在实验室里采用以下装置和步骤模拟工业上 的处理过程。
的处理过程。

模拟尾气处理选用上述部分装置、按下列顺序连接成模拟尾气处理装置,回答有关问题:
 D
D ( )
( ) ( )
( ) ( )
( )
(2)在上述括号中填入选用的装置编号___________ 。
(3)装置A中反应的离子方程式为___________ 。
(4)装置D中的液体可换成___________(填序号)。
(5)装置E中 参加反应的化学方程式为
参加反应的化学方程式为___________ 。
(6)从环保角度分析,该同学所设计的实验存在的明显缺陷是___________ 。
I.
(1)下图为制取氨气的装置和选用的试剂,其中错误的是___________(填序号)。

| A.①② | B.②③ | C.③④ | D.①③ |
II.除去工业尾气中的氮氧化合物(
 ),常用氨催化吸收法,原理是
),常用氨催化吸收法,原理是 与
与 反应生成无毒物质。某同学在实验室里采用以下装置和步骤模拟工业上
反应生成无毒物质。某同学在实验室里采用以下装置和步骤模拟工业上 的处理过程。
的处理过程。
模拟尾气处理选用上述部分装置、按下列顺序连接成模拟尾气处理装置,回答有关问题:
 D
D ( )
( ) ( )
( ) ( )
( )(2)在上述括号中填入选用的装置编号
(3)装置A中反应的离子方程式为
(4)装置D中的液体可换成___________(填序号)。
A. | B. | C.饱和食盐水 | D.浓硫酸 |
 参加反应的化学方程式为
参加反应的化学方程式为(6)从环保角度分析,该同学所设计的实验存在的明显缺陷是
您最近一年使用:0次
2023-07-13更新
|
79次组卷
|
2卷引用:辽宁省丹东市2022-2023学年高一下学期期末质量监测化学试题
4 . 某化学学习小组探究浓度对硝酸氧化能力的影响。
Ⅰ.资料显示:浓硝酸能将NO氧化成 ,而稀硝酸不能氧化NO;氢氧化钠能吸收
,而稀硝酸不能氧化NO;氢氧化钠能吸收 ,但不能吸收NO。该学习小组按如图装置进行验证实验(夹持仪器已略去)。
,但不能吸收NO。该学习小组按如图装置进行验证实验(夹持仪器已略去)。
(1)装置a的名称___________ 。
(2)写出装置①中反应的离子反应方程式___________ 。
(3)写出装置②中反应的化学反应方程式___________ 。
(4)①~⑥装置中,没有发生氧化还原反应的是___________ 。(填装置序号)
(5)下列说法正确的是___________。
Ⅱ.测得铁与不同浓度硝酸反应时各还原产物的物质的量相对含量与硝酸溶液浓度的关系如图所示:___________ 。
A.硝酸的浓度越大,其还原产物中高价态的N元素成分越多
B.硝酸与铁反应往往同时生成多种还原产物
C.铁能与大于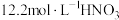 溶液反应说明不存在“钝化”现象
溶液反应说明不存在“钝化”现象
(7)已知:在上述反应条件下,反应后铁以 形式存在于溶液中。当硝酸浓度为
形式存在于溶液中。当硝酸浓度为 时,计算氧化剂与还原剂的物质的量之比为:
时,计算氧化剂与还原剂的物质的量之比为:___________ 。
Ⅰ.资料显示:浓硝酸能将NO氧化成
 ,而稀硝酸不能氧化NO;氢氧化钠能吸收
,而稀硝酸不能氧化NO;氢氧化钠能吸收 ,但不能吸收NO。该学习小组按如图装置进行验证实验(夹持仪器已略去)。
,但不能吸收NO。该学习小组按如图装置进行验证实验(夹持仪器已略去)。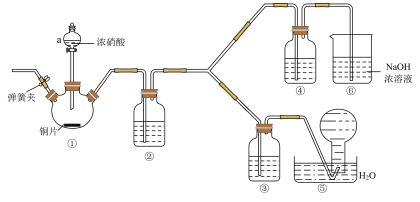
(1)装置a的名称
(2)写出装置①中反应的离子反应方程式
(3)写出装置②中反应的化学反应方程式
(4)①~⑥装置中,没有发生氧化还原反应的是
(5)下列说法正确的是___________。
| A.能证明氧化性的相对强弱的实验现象为③中溶液上方出现红棕色气体 |
| B.②中的试剂为水 |
| C.滴加浓硝酸前要先打开弹簧夹通一段时间氮气 |
| D.⑥的作用是吸收尾气NO |
Ⅱ.测得铁与不同浓度硝酸反应时各还原产物的物质的量相对含量与硝酸溶液浓度的关系如图所示:

A.硝酸的浓度越大,其还原产物中高价态的N元素成分越多
B.硝酸与铁反应往往同时生成多种还原产物
C.铁能与大于
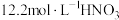 溶液反应说明不存在“钝化”现象
溶液反应说明不存在“钝化”现象(7)已知:在上述反应条件下,反应后铁以
 形式存在于溶液中。当硝酸浓度为
形式存在于溶液中。当硝酸浓度为 时,计算氧化剂与还原剂的物质的量之比为:
时,计算氧化剂与还原剂的物质的量之比为:
您最近一年使用:0次
2023-07-13更新
|
278次组卷
|
5卷引用:辽宁省五校(大连二十四中、东北育才等)2022-2023学年高一下学期期末考试化学试题
5 . 某研究小组用如图装置制取 并对其性质进行相关实验(夹持装置已略去)。
并对其性质进行相关实验(夹持装置已略去)。

回答下列问题:
(1)装置A中发生反应的化学方程式为___________ 。
(2)D中观察到的现象是___________ ;B、C、D三支试管中的现象分别体现了 的漂白性、
的漂白性、___________ 性和___________ 性。
(3)写出C中反应的离子方程式:___________ 。
(4)仪器X的名称是___________ 。
(5)实验结束发现装置A中Y型试管产生白色固体,倾斜使左侧的物质全部转移到右侧水中,这时看到溶液的颜色为___________ 色。
 并对其性质进行相关实验(夹持装置已略去)。
并对其性质进行相关实验(夹持装置已略去)。
回答下列问题:
(1)装置A中发生反应的化学方程式为
(2)D中观察到的现象是
 的漂白性、
的漂白性、(3)写出C中反应的离子方程式:
(4)仪器X的名称是
(5)实验结束发现装置A中Y型试管产生白色固体,倾斜使左侧的物质全部转移到右侧水中,这时看到溶液的颜色为
您最近一年使用:0次
解题方法
6 . 某实验小组通过下列实验探究过氧化钠与水的反应:
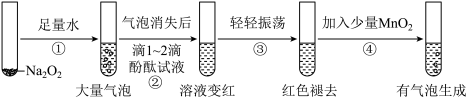
通过实验得出的结论正确的是

通过实验得出的结论正确的是
| A.Na2O2与水不可能发生复分解反应 |
| B.过程①产生大量气泡可能是反应过程中温度升高, H2O2受热分解 |
| C.过程③红色褪去说明Na2O2过量且Na2O2具有漂白性 |
| D.过程④发生反应的化学方程式为H2O2 +MnO2=Mn(OH)2↓+O2↑ |
您最近一年使用:0次
2023-07-06更新
|
312次组卷
|
2卷引用:辽宁省铁岭市六校2022-2023学年高二下学期期末考试化学试题
解题方法
7 . 某化学实验小组设计并利用下图所示实验装置验证 和氯水的漂白性(选用铜片和浓硫酸反应制取
和氯水的漂白性(选用铜片和浓硫酸反应制取 ;选用
;选用 和浓盐酸制
和浓盐酸制 ):
):
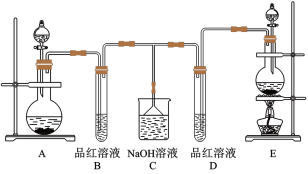
回答下列问题:
(1)实验中制取 时,应选用的发生装置是
时,应选用的发生装置是_______ (填“A”或“E”)装置,发生反应的化学方程式为_______ 。
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管加热,两个试管中的现象分别为B:_______ ,D:_______ 。
(3)实验小组的同学还利用下图所示装置探究 和
和 按不同比例混合后的漂白性:
按不同比例混合后的漂白性:
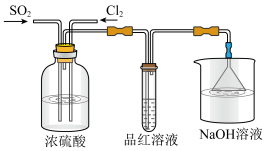
①在气体进入品红溶液之前,先将 和
和 通过盛有浓硫酸的目的是;a.控制气体通入速率;b.
通过盛有浓硫酸的目的是;a.控制气体通入速率;b._______ 。
②实验过程中发现通气一段时间后,品红溶液几乎不褪色,此时通入的 与
与 的体积之比为
的体积之比为_______ ,品红溶液中发生反应的离子方程式为_______ 。
 和氯水的漂白性(选用铜片和浓硫酸反应制取
和氯水的漂白性(选用铜片和浓硫酸反应制取 ;选用
;选用 和浓盐酸制
和浓盐酸制 ):
):
回答下列问题:
(1)实验中制取
 时,应选用的发生装置是
时,应选用的发生装置是(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管加热,两个试管中的现象分别为B:
(3)实验小组的同学还利用下图所示装置探究
 和
和 按不同比例混合后的漂白性:
按不同比例混合后的漂白性:
①在气体进入品红溶液之前,先将
 和
和 通过盛有浓硫酸的目的是;a.控制气体通入速率;b.
通过盛有浓硫酸的目的是;a.控制气体通入速率;b.②实验过程中发现通气一段时间后,品红溶液几乎不褪色,此时通入的
 与
与 的体积之比为
的体积之比为
您最近一年使用:0次
2023-06-17更新
|
113次组卷
|
2卷引用:辽宁省鞍山市台安县高级中学2022-2023学年高一下学期期末考试化学试题
8 . 某学习小组设计实验探究NO与铜粉的反应,并收集反应生成的气体,装置如图,实验开始前应先向装置中通入一段时间的氮气。已知: (棕色)
(棕色)
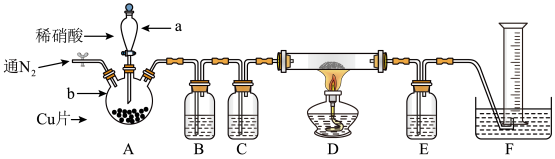
(1)组装仪器后,应先进行的操作是___________ 。
(2)仪器a的名称是___________ ,C中的药品是___________ ,E的作用是___________ 。
(3)D中固体逐渐变黑,并生成一种无毒气体,反应的方程式为___________ 。
(4)通入 的作用是
的作用是___________ 。
(5)反应前,装置D(硬质玻璃管和铜粉)的质量为 ,反应后质量为
,反应后质量为 ,则该反应生成的气体在标准状况下体积约为
,则该反应生成的气体在标准状况下体积约为___________ L(用 、
、 表示)
表示)
 (棕色)
(棕色)
(1)组装仪器后,应先进行的操作是
(2)仪器a的名称是
(3)D中固体逐渐变黑,并生成一种无毒气体,反应的方程式为
(4)通入
 的作用是
的作用是(5)反应前,装置D(硬质玻璃管和铜粉)的质量为
 ,反应后质量为
,反应后质量为 ,则该反应生成的气体在标准状况下体积约为
,则该反应生成的气体在标准状况下体积约为 、
、 表示)
表示)
您最近一年使用:0次
2023-04-26更新
|
247次组卷
|
4卷引用:辽宁省抚顺市第一中学2022-2023学年高一上学期期末考试化学试题
辽宁省抚顺市第一中学2022-2023学年高一上学期期末考试化学试题(已下线)第16讲 氮的固定和氮的氧化物-【暑假自学课】2023年新高一化学暑假精品课(鲁科版2019必修第一册)四川省资阳市乐至中学2023-2024学年高二上学期开学考试化学试题四川省自贡市第一中学校2023-2024学年高二上学期开学考试化学试题
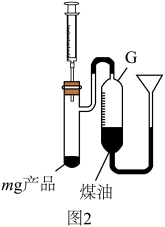
9 . 氨基钠 (NaNH2)常用作有机合成的还原剂、脱水剂。某学习小组用如图1装置,以 和Na为原料加热至350~360℃制备氨基钠,并检验其生成的产物,最后测定产品的纯度。
和Na为原料加热至350~360℃制备氨基钠,并检验其生成的产物,最后测定产品的纯度。
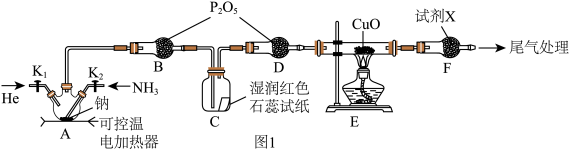
已知: 极易水解且易被空气氧化。回答下列问题:
极易水解且易被空气氧化。回答下列问题:
(1)图1中盛装钠的仪器名称为_______ 。
(2)实验时,应先关闭 ,打开
,打开 ,通一段时间He,排净装置内的空气,其目的是:①防止加热E时发生爆炸;②
,通一段时间He,排净装置内的空气,其目的是:①防止加热E时发生爆炸;②_______ 。
(3)装置A中发生反应的化学方程式为_______ 。
(4)B中 的作用是
的作用是_______ ,F中试剂X为_______ 。
(5)为证明A中反应的气体产物,需要观察到的实验现象:①E中黑色粉末变红;②_______ 。
(6)若A中Na完全反应后,取m g产品,按图2装置进行实验(产品所含杂质与水反应不生成气体)。用注射器向试管中缓慢加入 至恰好完全反应立即停止,G中液面从
至恰好完全反应立即停止,G中液面从 变为
变为 (已知
(已知 ,数据已折合为标准状况),若忽略固体体积,则产品纯度为
,数据已折合为标准状况),若忽略固体体积,则产品纯度为_______ ;若读取 时,G中液面低于漏斗侧液面,则所测得的纯度比实际产品纯度
时,G中液面低于漏斗侧液面,则所测得的纯度比实际产品纯度_______ (填“偏高”“偏低”“无影响”)。
 和Na为原料加热至350~360℃制备氨基钠,并检验其生成的产物,最后测定产品的纯度。
和Na为原料加热至350~360℃制备氨基钠,并检验其生成的产物,最后测定产品的纯度。
已知:
 极易水解且易被空气氧化。回答下列问题:
极易水解且易被空气氧化。回答下列问题:(1)图1中盛装钠的仪器名称为
(2)实验时,应先关闭
 ,打开
,打开 ,通一段时间He,排净装置内的空气,其目的是:①防止加热E时发生爆炸;②
,通一段时间He,排净装置内的空气,其目的是:①防止加热E时发生爆炸;②(3)装置A中发生反应的化学方程式为
(4)B中
 的作用是
的作用是(5)为证明A中反应的气体产物,需要观察到的实验现象:①E中黑色粉末变红;②
(6)若A中Na完全反应后,取m g产品,按图2装置进行实验(产品所含杂质与水反应不生成气体)。用注射器向试管中缓慢加入
 至恰好完全反应立即停止,G中液面从
至恰好完全反应立即停止,G中液面从 变为
变为 (已知
(已知 ,数据已折合为标准状况),若忽略固体体积,则产品纯度为
,数据已折合为标准状况),若忽略固体体积,则产品纯度为 时,G中液面低于漏斗侧液面,则所测得的纯度比实际产品纯度
时,G中液面低于漏斗侧液面,则所测得的纯度比实际产品纯度
您最近一年使用:0次
名校
解题方法
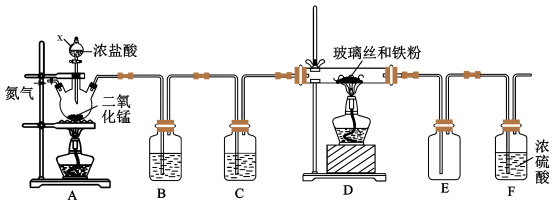
10 . 某化学学习小组在实验室制备无水三氯化铁,其实验装置如图。三氯化铁是棕黄色、易潮解、100℃能升华的物质。
回答下列问题:
(1)装置A中三颈烧瓶里反应的离子方程式是_____ 。
(2)为得到纯净、干燥的Cl2,B、C中的试剂分别为_____ 、_____ 。
(3)实验开始前先通氮气的目的是_____ 。
(4)为使氯气与铁充分反应,应注意的操作是_____ 。
(5)请你评价该装置的主要缺点是_____ 。
(6)设计实验证明D中反应产物中一定含有Fe3+:_____ (要求有试剂、现象和操作)。
(7)若将D中反应产物溶于水后,固体全部溶解,形成的溶液中阳离子只有Fe2+,则发生反应的离子方程式为_____ ;上述制备实验中,参加反应的铁粉与未参加反应的铁粉的物质的量之比为_____ 。

回答下列问题:
(1)装置A中三颈烧瓶里反应的离子方程式是
(2)为得到纯净、干燥的Cl2,B、C中的试剂分别为
(3)实验开始前先通氮气的目的是
(4)为使氯气与铁充分反应,应注意的操作是
(5)请你评价该装置的主要缺点是
(6)设计实验证明D中反应产物中一定含有Fe3+:
(7)若将D中反应产物溶于水后,固体全部溶解,形成的溶液中阳离子只有Fe2+,则发生反应的离子方程式为
您最近一年使用:0次
2023-02-14更新
|
290次组卷
|
2卷引用:辽宁省锦州市渤海大学附属高级中学2022-2023学年高一上学期期末考试化学试题



