名校
解题方法
1 . 为验证氧化性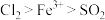 ,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已省略,气密性已检验;70%硫酸溶液与
,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已省略,气密性已检验;70%硫酸溶液与 反应生成
反应生成 )。
)。
实验过程:
Ⅰ.打开止水夹 ,通入一段时间
,通入一段时间 ,再将T型导管插入B中,继续通入
,再将T型导管插入B中,继续通入 ,然后关闭
,然后关闭 、
、 、
、 。
。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,待不再产生气体时,关闭 。
。
Ⅳ.打开活塞b,使约 的溶液流入D试管中,检验其中的离子。
的溶液流入D试管中,检验其中的离子。
Ⅴ.打开 和活塞c,加入适量70%的硫酸溶液,一段时间后关闭
和活塞c,加入适量70%的硫酸溶液,一段时间后关闭 。
。
Ⅵ.更换试管D打开活塞b,使约 的溶液流入D试管中,检验其中的离子。
的溶液流入D试管中,检验其中的离子。
(1)A装置的名称___________ ,B分液漏斗上口棉花上浸有___________ 溶液(化学式)。
(2)A中发生反应的离子方程式___________ 。
(3)过程Ⅰ的目的是___________ 。
(4)若过程Ⅲ B中的黄色溶液中含有 和
和 ,向其中通入
,向其中通入 气体,会观察到有淡黄色沉淀(S)生成,写出该反应的化学方程式:
气体,会观察到有淡黄色沉淀(S)生成,写出该反应的化学方程式:___________ 。
(5)若将制取的 通入硫酸酸化的高锰酸钾溶液可使溶液褪色,其反应的离子方程式为
通入硫酸酸化的高锰酸钾溶液可使溶液褪色,其反应的离子方程式为___________ 。
(6)步骤Ⅴ中B中发生反应的离子方程式为___________ 。
(7)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果一定能够证明氧化性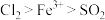 的是
的是___________ (填“甲”“乙”或“丙”)。
(8)将B中的 溶液换成
溶液换成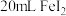 溶液并向其中通入
溶液并向其中通入 (标准状况下),若溶液中有
(标准状况下),若溶液中有 的
的 被氧化成
被氧化成 ,则原
,则原 溶液中
溶液中 的物质的量浓度为
的物质的量浓度为___________ 。
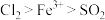 ,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已省略,气密性已检验;70%硫酸溶液与
,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已省略,气密性已检验;70%硫酸溶液与 反应生成
反应生成 )。
)。
实验过程:
Ⅰ.打开止水夹
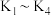 ,通入一段时间
,通入一段时间 ,再将T型导管插入B中,继续通入
,再将T型导管插入B中,继续通入 ,然后关闭
,然后关闭 、
、 、
、 。
。Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,待不再产生气体时,关闭
 。
。Ⅳ.打开活塞b,使约
 的溶液流入D试管中,检验其中的离子。
的溶液流入D试管中,检验其中的离子。Ⅴ.打开
 和活塞c,加入适量70%的硫酸溶液,一段时间后关闭
和活塞c,加入适量70%的硫酸溶液,一段时间后关闭 。
。Ⅵ.更换试管D打开活塞b,使约
 的溶液流入D试管中,检验其中的离子。
的溶液流入D试管中,检验其中的离子。(1)A装置的名称
(2)A中发生反应的离子方程式
(3)过程Ⅰ的目的是
(4)若过程Ⅲ B中的黄色溶液中含有
 和
和 ,向其中通入
,向其中通入 气体,会观察到有淡黄色沉淀(S)生成,写出该反应的化学方程式:
气体,会观察到有淡黄色沉淀(S)生成,写出该反应的化学方程式:(5)若将制取的
 通入硫酸酸化的高锰酸钾溶液可使溶液褪色,其反应的离子方程式为
通入硫酸酸化的高锰酸钾溶液可使溶液褪色,其反应的离子方程式为(6)步骤Ⅴ中B中发生反应的离子方程式为
(7)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果一定能够证明氧化性
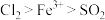 的是
的是| 过程Ⅳ,B溶液中含有的离子 | 过程Ⅵ,B溶液中含有的离子 | |
| 甲 | 有 无 无 | 有 |
| 乙 | 既有 又有 又有 | 有 |
| 丙 | 有 无 无 | 有 |
(8)将B中的
 溶液换成
溶液换成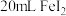 溶液并向其中通入
溶液并向其中通入 (标准状况下),若溶液中有
(标准状况下),若溶液中有 的
的 被氧化成
被氧化成 ,则原
,则原 溶液中
溶液中 的物质的量浓度为
的物质的量浓度为
您最近一年使用:0次
解题方法
2 . 如图所示,a、b、c分别是中学化学常见的固体、气体和液体,气球套在试管口且保证密封性能良好。下列说法不正确的是
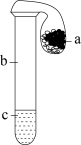

| A.若b为氯气,c为饱和食盐水,将a倒入试管中,气球会变瘪,则a可能是熟石灰 |
| B.若b为空气,a为二氧化锰,将a倒入试管中,气球会变鼓,则c可能是过氧化氢溶液 |
| C.若b为空气,c为水,将a倒入试管中,气球会变鼓,则a可能是硝酸铵 |
| D.若b为氧气,c为氢氧化钠溶液,将a倒入试管中,气球会变瘪,a可能是硫酸亚铁晶体 |
您最近一年使用:0次
名校
解题方法
3 . 某兴趣小组同学们对SO2的性质进行探究。
实验一:探究SO2的漂白原理,装置如图所示,部分装置省略。实验发现,装置B中溶液变红色,不褪色;装置C中溶液为红色,装置D中溶液褪色。向烧瓶中加入200mL18.4mol/L浓硫酸,充分反应直至装置A中反应停止。
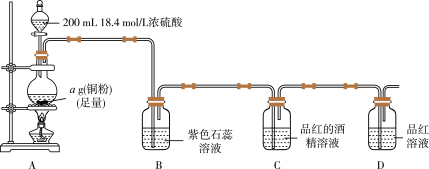
回答下列问题:
(1)装置A中发生反应的化学方程式为_______ 。
(2)根据装置C、D中出现的现象,对漂白品红的粒子提出如下猜想:
猜想1:H2SO3;
猜想2:HSO ;
;
猜想3:_______ 。
针对猜想2设计简单实验探究漂白原理:_______ 。
(3)实验完毕后,甲同学设计如下实验测定剩余硫酸浓度(不考虑体积变化,假设锌与稀硫酸反应只产生氢气):

①实验部分操作:(a)调平量气管和烧杯的液面;(b)冷却至室温;(c)读数正确的先后操作顺序是_______ (填字母)。
②已知开始时量气管读数为V1mL,最终读数为V2mL(均折合成标准状况,且V2>V1)。则铜与浓硫酸发生反应的最低硫酸浓度为_______ mol/L。
实验二:结合实验一的装置,乙同学添加一些装置(如图),利用SO2和Cl2在活性炭催化作用下制取亚硫酰氯SOCl2。亚硫酰氯是重要的化工试剂,沸点较低,易水解。
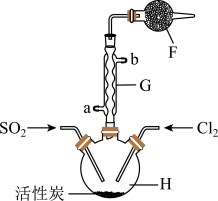
(4)①G仪器的进水口是_______ (填“a”或“b”),其作用是_______ 。
②F仪器的作用是_______ 。
(5)已知SOCl2具有还原性,其氧化产物为SO 。丙同学为了验证SOCl2和FeCl3·6H2O能发生氧化还原反应,做以下实验:取少量SOCl2和FeCl3·6H2O反应后的混合物于试管中,加水充分溶解后……接下来的实验操作和现象都正确的是_______(填字母序号)。
。丙同学为了验证SOCl2和FeCl3·6H2O能发生氧化还原反应,做以下实验:取少量SOCl2和FeCl3·6H2O反应后的混合物于试管中,加水充分溶解后……接下来的实验操作和现象都正确的是_______(填字母序号)。
实验一:探究SO2的漂白原理,装置如图所示,部分装置省略。实验发现,装置B中溶液变红色,不褪色;装置C中溶液为红色,装置D中溶液褪色。向烧瓶中加入200mL18.4mol/L浓硫酸,充分反应直至装置A中反应停止。

回答下列问题:
(1)装置A中发生反应的化学方程式为
(2)根据装置C、D中出现的现象,对漂白品红的粒子提出如下猜想:
猜想1:H2SO3;
猜想2:HSO
 ;
;猜想3:
针对猜想2设计简单实验探究漂白原理:
(3)实验完毕后,甲同学设计如下实验测定剩余硫酸浓度(不考虑体积变化,假设锌与稀硫酸反应只产生氢气):

①实验部分操作:(a)调平量气管和烧杯的液面;(b)冷却至室温;(c)读数正确的先后操作顺序是
②已知开始时量气管读数为V1mL,最终读数为V2mL(均折合成标准状况,且V2>V1)。则铜与浓硫酸发生反应的最低硫酸浓度为
实验二:结合实验一的装置,乙同学添加一些装置(如图),利用SO2和Cl2在活性炭催化作用下制取亚硫酰氯SOCl2。亚硫酰氯是重要的化工试剂,沸点较低,易水解。

(4)①G仪器的进水口是
②F仪器的作用是
(5)已知SOCl2具有还原性,其氧化产物为SO
 。丙同学为了验证SOCl2和FeCl3·6H2O能发生氧化还原反应,做以下实验:取少量SOCl2和FeCl3·6H2O反应后的混合物于试管中,加水充分溶解后……接下来的实验操作和现象都正确的是_______(填字母序号)。
。丙同学为了验证SOCl2和FeCl3·6H2O能发生氧化还原反应,做以下实验:取少量SOCl2和FeCl3·6H2O反应后的混合物于试管中,加水充分溶解后……接下来的实验操作和现象都正确的是_______(填字母序号)。| A.滴加几滴KSCN溶液,溶液变为红色 |
| B.滴加几滴BaCl2溶液,有白色沉淀生成 |
| C.加入少量稀硝酸,再滴加几滴BaCl2溶液,有白色沉淀生成 |
| D.滴加几滴酸性KMnO4溶液,紫红色消失 |
您最近一年使用:0次
名校
解题方法
4 . 将浓盐酸加到 中进行如图(a~c均为浸有相应试液的棉花)所示的探究实验,反应一段时间后,下列分析正确的是
中进行如图(a~c均为浸有相应试液的棉花)所示的探究实验,反应一段时间后,下列分析正确的是
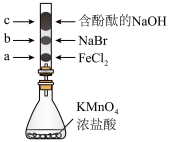
 中进行如图(a~c均为浸有相应试液的棉花)所示的探究实验,反应一段时间后,下列分析正确的是
中进行如图(a~c均为浸有相应试液的棉花)所示的探究实验,反应一段时间后,下列分析正确的是
A.a处变黄色,说明 具有还原性 具有还原性 |
B.b处变橙色,说明非金属性 |
C.c处红色逐渐变浅,说明 具有漂白性 具有漂白性 |
D.浓盐酸与 反应,只体现HCl的酸性 反应,只体现HCl的酸性 |
您最近一年使用:0次
2022-12-22更新
|
1149次组卷
|
8卷引用:天津外国语大学附属外国语学校2022-2023学年高二上学期期末考化学试题
天津外国语大学附属外国语学校2022-2023学年高二上学期期末考化学试题广东省广州市2023届高三年级调研测试化学试题广东省广州市2022-2023学年高三上学期12月调研考试化学试题(已下线)专题11 化学实验基础(测)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)专题08 元素及其化合物(测)-2023年高考化学二轮复习讲练测(新高考专用)上海市卢湾高级中学2022-2023学年高三下学期3月月考化学试题(已下线)广东省广州市天河区2023届高三二模化学试题变式题(选择题1-5)广东省普宁市勤建学校2022-2023学年高二下学期学科竞赛化学试题
名校
解题方法
5 . 实验小组利用传感器探究Na2CO3和NaHCO3的性质。
【查阅资料】pH越小,c(OH-)越小,溶液碱性越弱
【实验过程】
【分析与解释】
(1)实验I中,溶解时吸收热量的物质是_______ 。
(2)实验II中,Na2CO3溶液和澄清石灰水反应的离子方程式为_______ ,OH-未参与该反应的实验证据是_______ 。
(3)实验II中,滴加NaHCO3溶液的pH变化与滴加Na2CO3溶液的有明显差异,造成这种差异是由于滴加NaHCO3溶液的烧杯中有_______ (填写离子符号)参与反应。
【查阅资料】pH越小,c(OH-)越小,溶液碱性越弱
【实验过程】
| 编号 | 实验操作 | 实验数据 |
| 实验I | 测量下述实验过程的温度变化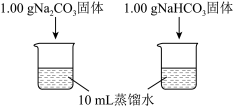 | 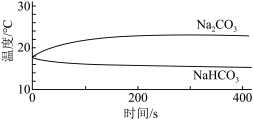 |
| 实验II | 测量下述实验过程的pH变化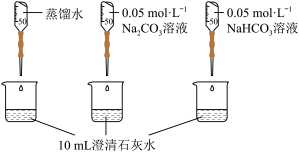 |  |
(1)实验I中,溶解时吸收热量的物质是
(2)实验II中,Na2CO3溶液和澄清石灰水反应的离子方程式为
(3)实验II中,滴加NaHCO3溶液的pH变化与滴加Na2CO3溶液的有明显差异,造成这种差异是由于滴加NaHCO3溶液的烧杯中有
您最近一年使用:0次
2022-11-30更新
|
293次组卷
|
13卷引用:天津市红桥区2020-2021学年高一下学期期末考试化学试题
天津市红桥区2020-2021学年高一下学期期末考试化学试题北京市第八中学2022-2023学年高一下学期期末考试化学试题北京市2020年普通高中学业水平合格性模拟考试化学试题2020年北京市第一次普通高中学业水平合格性考试化学试题高一必修第一册(苏教2019)专题3 第二单元 金属钠及钠的化合物4北京市回民学校2020-2021学年高一上学期期中考试化学试题北京市第三十一中学2020—2021学年度高一下学期期中考试化学试题北京第七中学2020-2021学年高一下学期期中考试化学试题(已下线)北京市第四中学2022-2023学年高一上学期期中考试化学试题北京市第四十三中学2022-2023学年高一上学期期中考试化学试题(已下线)专题八 钠及其化合物北京市第十一中学2023-2024学年高一上学期期中考试化学试题北京市月坛中学2023-2024学年高一上学期期中考试化学试题
名校
解题方法
6 .  和
和 在生产、生活和科学研究中有着广泛的应用,也是大气主要污染物。硫酸盐(含
在生产、生活和科学研究中有着广泛的应用,也是大气主要污染物。硫酸盐(含 、
、 )气溶胶是
)气溶胶是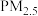 的成分之一,
的成分之一, 在
在 催化作用下与空气中的
催化作用下与空气中的 在接触室中发生可逆反应,反应的热化学方程式表示为:
在接触室中发生可逆反应,反应的热化学方程式表示为: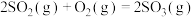
 。向
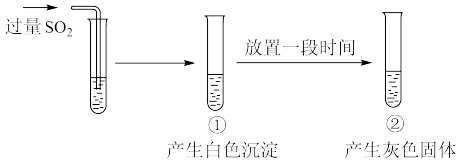
。向 溶液中通入过量
溶液中通入过量 ,过程和现象如下图。经检验,白色沉淀为
,过程和现象如下图。经检验,白色沉淀为 ;灰色固体中含有Ag。下列说法
;灰色固体中含有Ag。下列说法不正确 的是
 和
和 在生产、生活和科学研究中有着广泛的应用,也是大气主要污染物。硫酸盐(含
在生产、生活和科学研究中有着广泛的应用,也是大气主要污染物。硫酸盐(含 、
、 )气溶胶是
)气溶胶是 的成分之一,
的成分之一, 在
在 催化作用下与空气中的
催化作用下与空气中的 在接触室中发生可逆反应,反应的热化学方程式表示为:
在接触室中发生可逆反应,反应的热化学方程式表示为: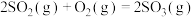
 。向
。向 溶液中通入过量
溶液中通入过量 ,过程和现象如下图。经检验,白色沉淀为
,过程和现象如下图。经检验,白色沉淀为 ;灰色固体中含有Ag。下列说法
;灰色固体中含有Ag。下列说法
A.①中生成白色沉淀的离子方程式为: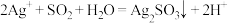 |
B.①中未生成 ,证明溶度积: ,证明溶度积: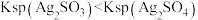 |
C.②中的现象体现了 的氧化性 的氧化性 |
D.该实验条件下, 与 与 反应生成 反应生成 的速率大于生成Ag的速率 的速率大于生成Ag的速率 |
您最近一年使用:0次
2022-11-24更新
|
275次组卷
|
2卷引用:天津外国语大学附属外国语学校2022-2023学年高二上学期期末考化学试题
名校
解题方法
7 . 高中常用“价类二维”思路研究物质的性质,右下图是铁及其化合物的二维图的部分信息。

(1)X的化学式为______ 。
图中物质只具有还原性的是______ 。(写化学式)
(2)将 溶液转化为
溶液转化为 的试剂可选
的试剂可选______ 。
a.稀硫酸 b. 溶液 c.酸性
溶液 c.酸性 d.溴水
d.溴水
(3)某中学实验小组设计如下实验探究亚铁盐的性质。
①实验Ⅰ中由白色沉淀生成红褐色沉淀的化学方程式__________________ 。
②对实验Ⅱ所得白色沉淀展开研究:
查阅资料:在溶液中不存在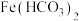
i.取Ⅱ中少量白色沉淀,充分洗涤,向其中加入稀硫酸,沉淀完全溶解,产生无色气泡;
ii.向i所得溶液中滴入KSCN试剂,溶液几乎不变红;
iii.向ii溶液中再滴入少量氯水,溶液立即变为红色。
根据以上现象,实验Ⅱ中生成的白色沉淀的化学式为__________________ 。
(4) 可用作补铁剂,使用时医生建议与维生素C同服,同学甲猜测维生素C可将
可用作补铁剂,使用时医生建议与维生素C同服,同学甲猜测维生素C可将 转化为
转化为 以利于人体吸收。为了验证这一猜想,设计如下实验:
以利于人体吸收。为了验证这一猜想,设计如下实验:
由上述实验能否得出维生素C可将 转化为
转化为 为的结论?
为的结论?_______ (填“能”或“否”),请说明理由:_____________________ 。

(1)X的化学式为
图中物质只具有还原性的是
(2)将
 溶液转化为
溶液转化为 的试剂可选
的试剂可选a.稀硫酸 b.
 溶液 c.酸性
溶液 c.酸性 d.溴水
d.溴水(3)某中学实验小组设计如下实验探究亚铁盐的性质。
实验方案 | 现象 | |
Ⅰ | 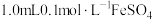 溶液中滴加1.0mL0.5 mol∙L−1 NaOH溶液 溶液中滴加1.0mL0.5 mol∙L−1 NaOH溶液 | 生成白色沉淀,后沉淀基本变为红褐色 |
Ⅱ | 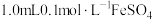 溶液中滴加1.0mL0.5 mol∙L−1 溶液中滴加1.0mL0.5 mol∙L−1 溶液 溶液 | 生成白色沉淀,后沉淀颜色几乎不变 |
②对实验Ⅱ所得白色沉淀展开研究:
查阅资料:在溶液中不存在
i.取Ⅱ中少量白色沉淀,充分洗涤,向其中加入稀硫酸,沉淀完全溶解,产生无色气泡;
ii.向i所得溶液中滴入KSCN试剂,溶液几乎不变红;
iii.向ii溶液中再滴入少量氯水,溶液立即变为红色。
根据以上现象,实验Ⅱ中生成的白色沉淀的化学式为
(4)
 可用作补铁剂,使用时医生建议与维生素C同服,同学甲猜测维生素C可将
可用作补铁剂,使用时医生建议与维生素C同服,同学甲猜测维生素C可将 转化为
转化为 以利于人体吸收。为了验证这一猜想,设计如下实验:
以利于人体吸收。为了验证这一猜想,设计如下实验:实验方案 | 实验现象 |
取适量 溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液。 溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液。 | 溶液紫红色褪去 |
 转化为
转化为 为的结论?
为的结论?
您最近一年使用:0次
2022-09-06更新
|
599次组卷
|
4卷引用:天津市河西区2021-2022学年高一上学期期末质量调查化学试题
天津市河西区2021-2022学年高一上学期期末质量调查化学试题天津市河西区微山路中学2022-2023学年高一上学期期末考试化学试题(已下线)专题07 铁及其化合物 金属材料-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(天津专用)上海市敬业中学2022-2023学年高二上学期10月月考(等级考)化学试题
8 . 工业上氯气用途非常广泛,回答下列问题:
(1)实验室制取氯气的化学方程式为__________________ 。
(2)下表是某同学研究氯水性质实验片断的活动记录。
(3)防止氯气污染空气,实验室常用NaOH溶液来吸收尾气,写出离子方程式__________________ 。
(4)验证氯元素的非金属性比硫元素的非金属性强。某同学设计实验如右图所示:

①装置A中盛放的试剂是______ 装置A中发生反应的离子方程式为__________________ 。
a. 溶液 b.
溶液 b. 溶液 c.
溶液 c. 溶液
溶液
②下列不能用于说明氯元素比硫元素非金属性强的依据是______ 。(填序号)
a.HCl酸性强于
b.HCl稳定性强于
c. 可以氧化S生成
可以氧化S生成
(5)若装置A中加入淀粉碘化钾溶液,通入少量氯气后,观察到装置A中溶液______ ,即可证明非金属性:Cl>I。从原子结构角度解释原因:同主族元素从上到下_______ 。
(6)右下图是用强光照射密闭广口瓶中新制氯水时,用数字化传感器采集的图象,下列纵坐标代表的物理量与图象相符的是______ 。

a.溶液颜色的变化 b.瓶中氧气的体积分数
c.溶液的导电能力 d.溶液的漂白能力
(1)实验室制取氯气的化学方程式为
(2)下表是某同学研究氯水性质实验片断的活动记录。
实验内容 | 实验现象 | 解释原因(文字或反应) |
| 观察氯水颜色 | ① | 氯水中含有氯气分子 |
向氯水中滴入 溶液 溶液 | 有无色气体生成 | ② |
| 用玻璃棒蘸取氯水,点在品红试纸上 | 红色褪去 | ③ |
(4)验证氯元素的非金属性比硫元素的非金属性强。某同学设计实验如右图所示:

①装置A中盛放的试剂是
a.
 溶液 b.
溶液 b. 溶液 c.
溶液 c. 溶液
溶液②下列不能用于说明氯元素比硫元素非金属性强的依据是
a.HCl酸性强于

b.HCl稳定性强于

c.
 可以氧化S生成
可以氧化S生成
(5)若装置A中加入淀粉碘化钾溶液,通入少量氯气后,观察到装置A中溶液
(6)右下图是用强光照射密闭广口瓶中新制氯水时,用数字化传感器采集的图象,下列纵坐标代表的物理量与图象相符的是

a.溶液颜色的变化 b.瓶中氧气的体积分数
c.溶液的导电能力 d.溶液的漂白能力
您最近一年使用:0次
2022-09-06更新
|
444次组卷
|
3卷引用:天津市河西区2021-2022学年高一上学期期末质量调查化学试题
天津市河西区2021-2022学年高一上学期期末质量调查化学试题天津市河西区微山路中学2022-2023学年高一上学期期末考试化学试题(已下线)专题09 元素周期律-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(天津专用)
名校
解题方法
9 .  溶液中存在平衡:
溶液中存在平衡: (橙色)
(橙色) (黄色)
(黄色) 。用
。用 溶液进行下列实验:
溶液进行下列实验:

结合实验,下列说法不正确的是
 溶液中存在平衡:
溶液中存在平衡: (橙色)
(橙色) (黄色)
(黄色) 。用
。用 溶液进行下列实验:
溶液进行下列实验:
结合实验,下列说法不正确的是
A.②中 被 被 还原,可用于检测汽车司机是否酒驾 还原,可用于检测汽车司机是否酒驾 |
| B.①中溶液橙色加深,③中溶液变黄 |
C.若向④中加入70% 溶液至过量,溶液变为橙色 溶液至过量,溶液变为橙色 |
D.对比②和④可知 酸性溶液氧化性强 酸性溶液氧化性强 |
您最近一年使用:0次
2022-07-20更新
|
271次组卷
|
2卷引用:天津市第一中学2021-2022学年高一下学期期末质量调查化学试题
10 . 若将铜丝插入热浓硫酸中进行如图(a~d均为浸有相应试液的棉花)所示的探究实验,下列叙述正确的是
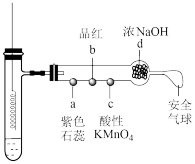

A.Cu与浓硫酸反应,只体现 的酸性 的酸性 |
B.a处变红,说明 是酸性氧化物 是酸性氧化物 |
C.b或c处褪色,均说明 具有漂白性 具有漂白性 |
| D.冷却后,将水慢慢加入试管中,观察到溶液呈蓝色 |
您最近一年使用:0次
2022-07-20更新
|
241次组卷
|
2卷引用:天津市第一中学2021-2022学年高一下学期期末质量调查化学试题



