1 . 氯化铁常用于金属蚀刻、污水处理。实验室用下图所示装置进行氯气性质的探究并制备无水 。查阅相关资料可知:无水
。查阅相关资料可知:无水 在空气中易潮解,100℃左右易升华。
在空气中易潮解,100℃左右易升华。

(1)写出装置A中发生反应的离子方程式:___________ 。
(2)装置B中试剂为___________ ,长颈漏斗的作用是___________ 。
(3)装置C的作用是验证氯气是否具有漂白性,为此,装置C中I、II、III处依次放入的物质是___________ (填“甲”“乙”“丙”或“丁”)。
(4)该实验装置存在的缺陷是___________ 。
(5)实验小组将制备的氯气通入水中,验证氯水中 光照分解的产物。将新制的氯水加入三颈烧瓶内,将
光照分解的产物。将新制的氯水加入三颈烧瓶内,将 传感器、氯离子传感器、氧气传感器分别插入三颈烧瓶中(如图1),用强光照射氯水,进行实验并采集数据,获得相关变化曲线。若能证明
传感器、氯离子传感器、氧气传感器分别插入三颈烧瓶中(如图1),用强光照射氯水,进行实验并采集数据,获得相关变化曲线。若能证明 在光照下发生了分解反应,则图2中纵坐标不能表示的物理量是
在光照下发生了分解反应,则图2中纵坐标不能表示的物理量是___________ (填标号)。

A.氧气的体积分数 B.氯离子的浓度 C.氯水的
(6)实验室中常用 和
和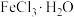 晶体共热制备无水氯化铁(另外两种产物为常见气体),其化学方程式为
晶体共热制备无水氯化铁(另外两种产物为常见气体),其化学方程式为___________ 。
 。查阅相关资料可知:无水
。查阅相关资料可知:无水 在空气中易潮解,100℃左右易升华。
在空气中易潮解,100℃左右易升华。
(1)写出装置A中发生反应的离子方程式:
(2)装置B中试剂为
(3)装置C的作用是验证氯气是否具有漂白性,为此,装置C中I、II、III处依次放入的物质是
| I | II | III | |
| 甲 | 湿润的有色布条 | 碱石灰 | 干燥的有色布条 |
| 乙 | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
| 丙 | 干燥的有色布条 | 无水氯化钙 | 湿润的有色布条 |
| 丁 | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
(4)该实验装置存在的缺陷是
(5)实验小组将制备的氯气通入水中,验证氯水中
 光照分解的产物。将新制的氯水加入三颈烧瓶内,将
光照分解的产物。将新制的氯水加入三颈烧瓶内,将 传感器、氯离子传感器、氧气传感器分别插入三颈烧瓶中(如图1),用强光照射氯水,进行实验并采集数据,获得相关变化曲线。若能证明
传感器、氯离子传感器、氧气传感器分别插入三颈烧瓶中(如图1),用强光照射氯水,进行实验并采集数据,获得相关变化曲线。若能证明 在光照下发生了分解反应,则图2中纵坐标不能表示的物理量是
在光照下发生了分解反应,则图2中纵坐标不能表示的物理量是
A.氧气的体积分数 B.氯离子的浓度 C.氯水的

(6)实验室中常用
 和
和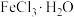 晶体共热制备无水氯化铁(另外两种产物为常见气体),其化学方程式为
晶体共热制备无水氯化铁(另外两种产物为常见气体),其化学方程式为
您最近一年使用:0次
名校
解题方法
2 . 某兴趣小组设计实验探究Ce-MnOx催化空气氧化CO的效率。回答问题:
步骤Ⅰ 以浓硫酸与甲酸混合加热制备CO
在通风橱中制备CO的装置如下(加热及夹持装置省略,甲酸HCOOH容易挥发):
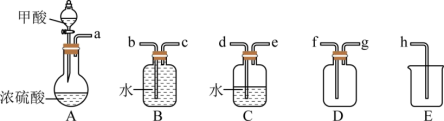
(1)装置A中盛放甲酸的仪器的名称为_____ ,反应中浓硫酸表现出脱水性,化学方程式为:_____ 。
(2)从B、C、D中选择合适装置收集CO,接口的连接顺序为(填写接口的字母标号):_____ 。
a→_____→_____→_____→_____→h
步骤Ⅱ 检验CO
(3)将CO通入银氨溶液 中,有NH3·H2O和黑色沉淀(小颗粒的银单质)生成,反应离子方程式为
中,有NH3·H2O和黑色沉淀(小颗粒的银单质)生成,反应离子方程式为_____ 。
步骤Ⅲ 探究Ce-MnOx催化空气氧化CO的效率
将一定量CO与空气混合,得到CO体积分数为1%的气体样品。使用下图装置(夹持装置省略),先通入N2排尽装置中的空气,然后调节管式炉温度至120℃,按一定流速通入气体样品。已知:I2O5是白色固体,易吸水潮解,可快速吸收CO: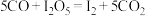 。
。
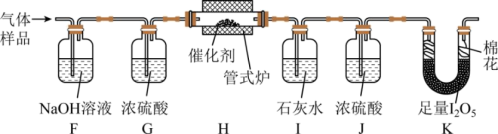
(4)通入11.2 L(已折算为标准状况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了0.1016 g I2。
①能证明CO被空气氧化的现象是_____ ;
②CO被催化氧化的百分率为_____ ;
③若未继续通入一段时间氮气,②的结果将_____ (填“偏大”“偏小”或“无影响”,1分)。
④步骤Ⅲ装置存在的不足之处是_____ 。
步骤Ⅰ 以浓硫酸与甲酸混合加热制备CO
在通风橱中制备CO的装置如下(加热及夹持装置省略,甲酸HCOOH容易挥发):

(1)装置A中盛放甲酸的仪器的名称为
(2)从B、C、D中选择合适装置收集CO,接口的连接顺序为(填写接口的字母标号):
a→_____→_____→_____→_____→h
步骤Ⅱ 检验CO
(3)将CO通入银氨溶液
 中,有NH3·H2O和黑色沉淀(小颗粒的银单质)生成,反应离子方程式为
中,有NH3·H2O和黑色沉淀(小颗粒的银单质)生成,反应离子方程式为步骤Ⅲ 探究Ce-MnOx催化空气氧化CO的效率
将一定量CO与空气混合,得到CO体积分数为1%的气体样品。使用下图装置(夹持装置省略),先通入N2排尽装置中的空气,然后调节管式炉温度至120℃,按一定流速通入气体样品。已知:I2O5是白色固体,易吸水潮解,可快速吸收CO:
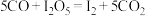 。
。
(4)通入11.2 L(已折算为标准状况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了0.1016 g I2。
①能证明CO被空气氧化的现象是
②CO被催化氧化的百分率为
③若未继续通入一段时间氮气,②的结果将
④步骤Ⅲ装置存在的不足之处是
您最近一年使用:0次
名校
3 . 碘化亚铁 在常温下为灰黑色固体,易升华,可溶于水,具有潮解性,常用于医药,可由碘单质和还原铁粉在加热条件下制备得到。
在常温下为灰黑色固体,易升华,可溶于水,具有潮解性,常用于医药,可由碘单质和还原铁粉在加热条件下制备得到。 )
)
(1)装置中盛碱石灰的仪器名称为_____ 。若无此装置,写出铁粉参与的副反应的化学方程式:_____ 。
(2)收集器浸泡在冷水中的原因是_____ 。
(3)试剂a为_____ ,其作用是_____ 。
Ⅱ、化学兴趣小组为了探究 的还原性,进行了如下实验:取一定量的
的还原性,进行了如下实验:取一定量的 溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。同学们对溶液变成黄色的原因提出了不同的看法:
溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。同学们对溶液变成黄色的原因提出了不同的看法:
甲同学认为:是因为被 氧化成
氧化成 ;乙同学认为:是因为被
;乙同学认为:是因为被 氧化成
氧化成 。
。
随后化学兴趣小组进行如下实验进行验证。
(4)上述实验②中现象为_____ 。化学兴趣小组得到的结论: 的还原性
的还原性_____  的还原性(填“
的还原性(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
(5)依据(4)中所得结论,试写出往过量 溶液中通入少量氯气后所发生反应的离子反应方程式:
溶液中通入少量氯气后所发生反应的离子反应方程式:_____ 。
 在常温下为灰黑色固体,易升华,可溶于水,具有潮解性,常用于医药,可由碘单质和还原铁粉在加热条件下制备得到。
在常温下为灰黑色固体,易升华,可溶于水,具有潮解性,常用于医药,可由碘单质和还原铁粉在加热条件下制备得到。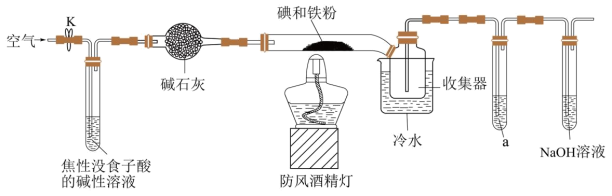
 )
)(1)装置中盛碱石灰的仪器名称为
(2)收集器浸泡在冷水中的原因是
(3)试剂a为
Ⅱ、化学兴趣小组为了探究
 的还原性,进行了如下实验:取一定量的
的还原性,进行了如下实验:取一定量的 溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。同学们对溶液变成黄色的原因提出了不同的看法:
溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。同学们对溶液变成黄色的原因提出了不同的看法:甲同学认为:是因为被
 氧化成
氧化成 ;乙同学认为:是因为被
;乙同学认为:是因为被 氧化成
氧化成 。
。随后化学兴趣小组进行如下实验进行验证。
| 实验步骤 | 现象 | 结论 |
| ①取少量黄色溶液于试管中,滴加淀粉溶液 | 试管中溶液变蓝色 | 甲同学观点正确 |
②取少量黄色溶液于试管中,滴加 溶液 溶液 | 乙同学观点不正确 |
(4)上述实验②中现象为
 的还原性
的还原性 的还原性(填“
的还原性(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。(5)依据(4)中所得结论,试写出往过量
 溶液中通入少量氯气后所发生反应的离子反应方程式:
溶液中通入少量氯气后所发生反应的离子反应方程式:
您最近一年使用:0次
2024-02-16更新
|
143次组卷
|
3卷引用:湖南省常德市第一中学2023-2024学年高一上学期期末考试化学试题
4 . 过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当易吸收空气中 而变质。
而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入___________ 溶液,充分振荡后有白色沉淀,证明 已经变质。
已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取ag样品,并设计用下图装置来测定过氧化钠的质量分数。

①A中发生反应离子方程式为___________ 。
②将仪器连接好以后,必须进行的第一步操作是___________ 。
③写出装置C中发生的所有反应的化学方程式___________ 、___________ 。
④D中NaOH溶液的作用___________ 。
⑤实验结束时,读取实验中生成气体的体积时,不合理的是___________ 。
A.直接读取气体体积,不需冷却到室温
B.上下移动量筒,使得E、F中液面高度相同
C.视线与凹液面的最低点相平读取量筒中水的体积
⑥读出量筒内水的体积后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为___________ 。
 而变质。
而变质。(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入
 已经变质。
已经变质。(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取ag样品,并设计用下图装置来测定过氧化钠的质量分数。

①A中发生反应离子方程式为
②将仪器连接好以后,必须进行的第一步操作是
③写出装置C中发生的所有反应的化学方程式
④D中NaOH溶液的作用
⑤实验结束时,读取实验中生成气体的体积时,不合理的是
A.直接读取气体体积,不需冷却到室温
B.上下移动量筒,使得E、F中液面高度相同
C.视线与凹液面的最低点相平读取量筒中水的体积
⑥读出量筒内水的体积后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为
您最近一年使用:0次
5 . 某化学实验小组为了验证在实验室制备 的过程中有水蒸气和
的过程中有水蒸气和 挥发出来,同时探究氯气的某些性质,设计了如图所示的实验装置(氯气易溶于
挥发出来,同时探究氯气的某些性质,设计了如图所示的实验装置(氯气易溶于 ,
, 不溶于
不溶于 )。
)。
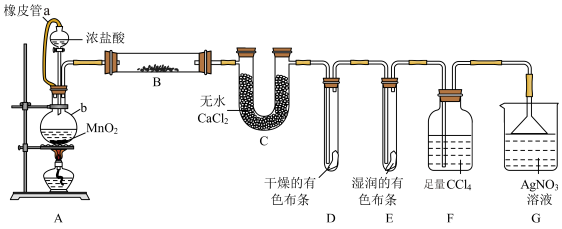
回答下列问题:
(1)装置中仪器b的名称是___________ 。
(2)装置A中发生反应的离子方程式为___________ ,连橡皮管a的作用是___________ 。
(3)一段时间后,根据装置D与E中出现的不同现象可得出的结论是___________ 。
(4)装置B中盛放的药品是___________ 。装置F的作用是___________ ,若有 挥发出来,装置G中的现象为
挥发出来,装置G中的现象为___________ 。
(5)若装置A中用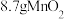 与足量浓盐酸混合加热,则被氧化的
与足量浓盐酸混合加热,则被氧化的 的物质的量是
的物质的量是___________  。
。
 的过程中有水蒸气和
的过程中有水蒸气和 挥发出来,同时探究氯气的某些性质,设计了如图所示的实验装置(氯气易溶于
挥发出来,同时探究氯气的某些性质,设计了如图所示的实验装置(氯气易溶于 ,
, 不溶于
不溶于 )。
)。
回答下列问题:
(1)装置中仪器b的名称是
(2)装置A中发生反应的离子方程式为
(3)一段时间后,根据装置D与E中出现的不同现象可得出的结论是
(4)装置B中盛放的药品是
 挥发出来,装置G中的现象为
挥发出来,装置G中的现象为(5)若装置A中用
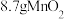 与足量浓盐酸混合加热,则被氧化的
与足量浓盐酸混合加热,则被氧化的 的物质的量是
的物质的量是 。
。
您最近一年使用:0次
名校
解题方法
6 . 某实验小组用如下实验装置模拟工业上制取硝酸:
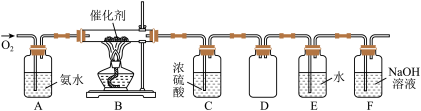
(1)控制氧气的流速是制硝酸的关键,该实验可通过观察氨水中_________ 控制氧气的流速。
(2)写出装置B中发生反应的化学方程式:__________________ 。
(3)由于水的比热容较大,A中挥发的水蒸气会影响B中的反应温度,所以在AB之间插入装有_________ 的干燥装置。
A.浓 B.碱石灰 C.
B.碱石灰 C.
(4)实验后装置 中
中 和
和 物质的量浓度较大的是
物质的量浓度较大的是_________ (填化学名称)。(装置 中发生的主要反应为:
中发生的主要反应为: ;
; )
)
(5)工业上要获得浓度较大的硝酸,往往在稀硝酸中加入吸水剂硝酸镁,然后在较低温度下进行蒸馏,但不能采用较高温度的原因是___________________ 。
(6)请从环境保护角度设计制备硝酸铜的方案,实验室可提供新制硝酸、Cu粉,写出方案中涉及到的化学方程式___________________ ;___________________ 。

(1)控制氧气的流速是制硝酸的关键,该实验可通过观察氨水中
(2)写出装置B中发生反应的化学方程式:
(3)由于水的比热容较大,A中挥发的水蒸气会影响B中的反应温度,所以在AB之间插入装有
A.浓
 B.碱石灰 C.
B.碱石灰 C.
(4)实验后装置
 中
中 和
和 物质的量浓度较大的是
物质的量浓度较大的是 中发生的主要反应为:
中发生的主要反应为: ;
; )
)(5)工业上要获得浓度较大的硝酸,往往在稀硝酸中加入吸水剂硝酸镁,然后在较低温度下进行蒸馏,但不能采用较高温度的原因是
(6)请从环境保护角度设计制备硝酸铜的方案,实验室可提供新制硝酸、Cu粉,写出方案中涉及到的化学方程式
您最近一年使用:0次
2024-01-27更新
|
493次组卷
|
2卷引用:湖南省岳阳市岳阳楼区2022-2023学年高一下学期期末考试化学试题
7 . 草酸亚铁不溶于水,可用于制药工业。草酸亚铁晶体(FeC2O4·2H2O)呈淡黄色,可用作照相显影剂。某化学活动小组分别设计了相应装置进行实验。回答下列问题:
I.制备草酸亚铁晶体(装置如图所示):
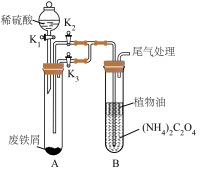
(1)盛放稀硫酸的仪器名称为___________ ;植物油的作用是___________ 。
(2)实验过程中,制备草酸亚铁的具体操作是___________ 。
(3)检验草酸亚铁晶体已洗净的操作方法为___________ 。
II.草酸亚铁晶体热分解产物的探究:
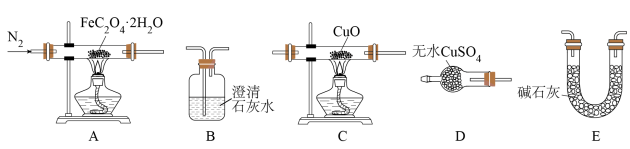
(4)按照气流从左到右的方向,上述装置的连接顺序为___________ →尾气处理装置(填图中字母,装置可重复使用)。
(5)实验结束后,C中黑色固体变为红色,B中澄清石灰水变浑浊,D中无水硫酸铜变为蓝色,A中残留FeO,则A处反应管中发生反应的化学方程式为___________ 。
III.运用热重分析法推测产物:
(6)称取54.0g草酸亚铁晶体(FeC2O4·2H2O)在隔绝空气的条件下加热,得到剩余固体质量随温度变化的曲线如图所示:
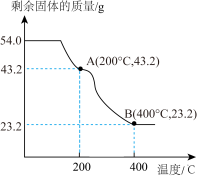
已知B点时,固体只含有一种铁的氧化物,根据上图可知B点固体物质的化学式为_______ 。
I.制备草酸亚铁晶体(装置如图所示):

(1)盛放稀硫酸的仪器名称为
(2)实验过程中,制备草酸亚铁的具体操作是
(3)检验草酸亚铁晶体已洗净的操作方法为
II.草酸亚铁晶体热分解产物的探究:

(4)按照气流从左到右的方向,上述装置的连接顺序为
(5)实验结束后,C中黑色固体变为红色,B中澄清石灰水变浑浊,D中无水硫酸铜变为蓝色,A中残留FeO,则A处反应管中发生反应的化学方程式为
III.运用热重分析法推测产物:
(6)称取54.0g草酸亚铁晶体(FeC2O4·2H2O)在隔绝空气的条件下加热,得到剩余固体质量随温度变化的曲线如图所示:

已知B点时,固体只含有一种铁的氧化物,根据上图可知B点固体物质的化学式为
您最近一年使用:0次
2023-11-14更新
|
816次组卷
|
4卷引用:湖南省衡阳市衡阳县2023-2024学年高一上学期1月期末考试化学试题
湖南省衡阳市衡阳县2023-2024学年高一上学期1月期末考试化学试题河北省石家庄精英中学2023-2024学年高三上学期第二次调研(期中)考试化学试题(已下线)实验探究题(已下线)T15-实验综合题
解题方法
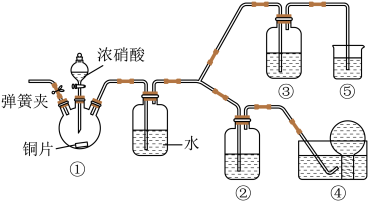
8 . 某学习小组为验证浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO,设计如图装置进行实验(夹持仪器已略去)。
【查阅资料】
NO与NaOH溶液不反应;NO2与NaOH溶液能反应(2NO2+2NaOH=NaNO3+NaNO2+H2O)。
备选药品:浓硝酸、2.4 mol·L 稀硝酸、蒸馏水、浓硫酸、NaOH溶液及CO2气体。
稀硝酸、蒸馏水、浓硫酸、NaOH溶液及CO2气体。
回答下列问题:
(1)连接好装置,紧接着的操作步骤是___________ ,再加入药品,打开装置①中的弹簧夹后通入CO2气体一段时间,关闭弹簧夹,将装置④中导管末端伸入倒置的烧瓶内,然后再通过①中___________ (填仪器名称)滴入浓硝酸,进行实验。
(2)装置①中发生反应的化学方程式为___________ 。
(3)若用质量分数为63.0%的浓硝酸(密度为1.25 g·cm )配制250 mL 2.4 mol·L
)配制250 mL 2.4 mol·L 的稀硝酸,除量筒、烧杯、胶头滴管、玻璃棒外,还要用到的玻璃仪器有
的稀硝酸,除量筒、烧杯、胶头滴管、玻璃棒外,还要用到的玻璃仪器有___________ ,则需量取63.0%的浓硝酸体积为___________ mL。
(4)装置中盛有水的洗气瓶的主要作用是(用化学方程式回答)___________ 。
(5)根据实验设计,装置③中盛放的试剂是___________ 。
(6)实验证明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO,则②和③装置中的实验现象是___________ 。

【查阅资料】
NO与NaOH溶液不反应;NO2与NaOH溶液能反应(2NO2+2NaOH=NaNO3+NaNO2+H2O)。
备选药品:浓硝酸、2.4 mol·L
 稀硝酸、蒸馏水、浓硫酸、NaOH溶液及CO2气体。
稀硝酸、蒸馏水、浓硫酸、NaOH溶液及CO2气体。回答下列问题:
(1)连接好装置,紧接着的操作步骤是
(2)装置①中发生反应的化学方程式为
(3)若用质量分数为63.0%的浓硝酸(密度为1.25 g·cm
 )配制250 mL 2.4 mol·L
)配制250 mL 2.4 mol·L 的稀硝酸,除量筒、烧杯、胶头滴管、玻璃棒外,还要用到的玻璃仪器有
的稀硝酸,除量筒、烧杯、胶头滴管、玻璃棒外,还要用到的玻璃仪器有(4)装置中盛有水的洗气瓶的主要作用是(用化学方程式回答)
(5)根据实验设计,装置③中盛放的试剂是
(6)实验证明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO,则②和③装置中的实验现象是
您最近一年使用:0次
9 . 过多 的排放,往往会产生污染。某研究性小组验证
的排放,往往会产生污染。某研究性小组验证 与炽热的铜粉会发生反应
与炽热的铜粉会发生反应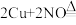
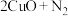 ,方案设计如下:
,方案设计如下:

已知: 能被酸性高锰酸钾溶液氧化成
能被酸性高锰酸钾溶液氧化成 ,此体系中产生的
,此体系中产生的 浓度较稀。
浓度较稀。
(1)装置C的名称___________ 。
(2)装置B中Cu单质的作用___________ 。
(3)有关该实验,下列说法不正确的是___________。
(4)实验过程中,装置E中溶液颜色变浅,则装置E发生的离子方程式为___________ 。
(5)有同学发现装置A溶液呈绿色,而不显蓝色;甲认为是该溶液中硝酸铜质量分数较高所致,而乙认为是该溶液溶解了生成的气体所致。设计方案来判断甲或乙哪种合理,下列方案中不可行的是___________。
 的排放,往往会产生污染。某研究性小组验证
的排放,往往会产生污染。某研究性小组验证 与炽热的铜粉会发生反应
与炽热的铜粉会发生反应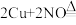
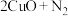 ,方案设计如下:
,方案设计如下:
已知:
 能被酸性高锰酸钾溶液氧化成
能被酸性高锰酸钾溶液氧化成 ,此体系中产生的
,此体系中产生的 浓度较稀。
浓度较稀。(1)装置C的名称
(2)装置B中Cu单质的作用
(3)有关该实验,下列说法不正确的是___________。
A.实验开始前要通 ,实验结束后也要通 ,实验结束后也要通 |
| B.B装置中若加入稀硫酸,可以提高氮原子的利用率 |
C.C装置中的 可用无水 可用无水 替代 替代 |
D.F装置中的试剂是 ,吸收尾气,防止污染环境 ,吸收尾气,防止污染环境 |
(5)有同学发现装置A溶液呈绿色,而不显蓝色;甲认为是该溶液中硝酸铜质量分数较高所致,而乙认为是该溶液溶解了生成的气体所致。设计方案来判断甲或乙哪种合理,下列方案中不可行的是___________。
| A.适当加热该绿色溶液,观察颜色变化 |
| B.加水稀释绿色溶液,观察颜色变化 |
| C.向该绿色溶液中通入氮气,观察颜色变化 |
| D.向硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化 |
您最近一年使用:0次
名校
解题方法
10 . 某实验小组利用下图装置探究浓硫酸与葡萄糖反应生成的气体成分。下列说法不正确的是


| A.使浓硫酸与葡萄糖反应发生的操作是将a中的Y形管向左倾斜 |
B.装置b中若出现白色沉淀,不可能是 或 或 |
C.装置d中出现浑浊,证明产生的气体中含有 |
D.装置e中可以盛放 溶液,f的作用为防倒吸 溶液,f的作用为防倒吸 |
您最近一年使用:0次



