1 . 某实验小组用漂白粉[主要成分为 、
、 ]和浓盐酸制备氯气,进行相关性质实验,并模拟制备“84”消毒液,实验装置如下图所示(夹持仪器已略):
]和浓盐酸制备氯气,进行相关性质实验,并模拟制备“84”消毒液,实验装置如下图所示(夹持仪器已略):
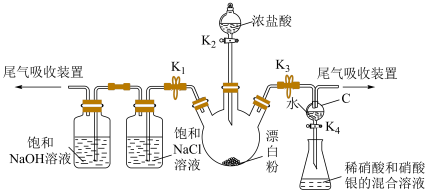
已知: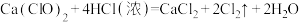
回答下列问题:
(1)A中盛浓盐酸的仪器名称是
(2)验证新制氯水的组成
①关闭 、
、 ,打开
,打开 、
、 ,至C中的水变为浅黄绿色时关闭
,至C中的水变为浅黄绿色时关闭 。
。
②取C中溶液,滴加少量紫色石蕊溶液,观察到的现象是
③甲同学打开 ,将C中溶液放入B中,观察到的现象是
,将C中溶液放入B中,观察到的现象是 溶于水生成
溶于水生成 。乙同学认为甲的结论不正确,乙同学的理由是
。乙同学认为甲的结论不正确,乙同学的理由是
(3)模拟制备“84”消毒液并测定其有效成分的物质的量浓度。操作为关闭
 ,打开
,打开 、
、 ,至E中充满大量黄绿色气体时关闭
,至E中充满大量黄绿色气体时关闭 。写出E中发出反应的离子方程式:
。写出E中发出反应的离子方程式: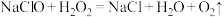 ,再加入足量硝酸酸化的硝酸银溶液,充分反应,过滤、洗涤、干燥、称量,得固体m g,试计算所制“84”消毒液中有效成分的物质的量浓度为
,再加入足量硝酸酸化的硝酸银溶液,充分反应,过滤、洗涤、干燥、称量,得固体m g,试计算所制“84”消毒液中有效成分的物质的量浓度为 (用含“V”和“m”的式子表示)。
(用含“V”和“m”的式子表示)。
您最近一年使用:0次
2024-01-22更新
|
82次组卷
|
2卷引用:云南民族大学附属高级中学2023-2024学年高一上学期期末考试化学试卷
名校
解题方法
2 . 某同学在实验室制备氨气,并探究氨气的部分性质。
实验一:制备氨气,探究氨气的溶解性
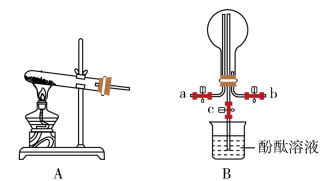
(1)该同学制备氨气的化学方程式为___________ ;B中用圆底烧瓶收集氨气时,请你选择氨气的进气口___________ (填“a”或b)。
(2)若观察到装置B烧瓶内产生了红色喷泉,则说明氨气具有的性质是___________ 和___________ ;你认为引发喷泉的操作应是___________ 。
实验二:探究氨气的还原性
已知: 呈红色固体,在酸性溶液中不稳定:
呈红色固体,在酸性溶液中不稳定: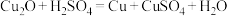 。
。
(3)装置 用于制备氨气,仪器的连接顺序为
用于制备氨气,仪器的连接顺序为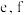 接
接___________ ,装置 的作用是
的作用是___________ 。实验开始前应先通一段时间的 ,其目的是
,其目的是___________ 。
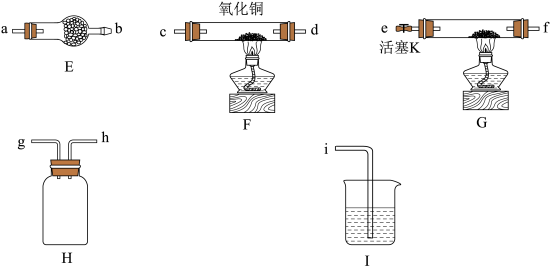
(4)反应结束后装置 中的氧化铜完全反应生成红色固体,为了探究红色固体的成分,进行了如下实验:
中的氧化铜完全反应生成红色固体,为了探究红色固体的成分,进行了如下实验:
取 红色固体于烧杯中,加入足量稀硫酸充分搅拌、静置、过滤、洗涤、干燥、称重,得固体
红色固体于烧杯中,加入足量稀硫酸充分搅拌、静置、过滤、洗涤、干燥、称重,得固体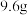 ,则红色固体的成分及其物质的量为
,则红色固体的成分及其物质的量为___________ 。
实验一:制备氨气,探究氨气的溶解性

(1)该同学制备氨气的化学方程式为
(2)若观察到装置B烧瓶内产生了红色喷泉,则说明氨气具有的性质是
实验二:探究氨气的还原性
已知:
 呈红色固体,在酸性溶液中不稳定:
呈红色固体,在酸性溶液中不稳定: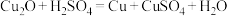 。
。(3)装置
 用于制备氨气,仪器的连接顺序为
用于制备氨气,仪器的连接顺序为 接
接 的作用是
的作用是 ,其目的是
,其目的是
(4)反应结束后装置
 中的氧化铜完全反应生成红色固体,为了探究红色固体的成分,进行了如下实验:
中的氧化铜完全反应生成红色固体,为了探究红色固体的成分,进行了如下实验:取
 红色固体于烧杯中,加入足量稀硫酸充分搅拌、静置、过滤、洗涤、干燥、称重,得固体
红色固体于烧杯中,加入足量稀硫酸充分搅拌、静置、过滤、洗涤、干燥、称重,得固体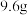 ,则红色固体的成分及其物质的量为
,则红色固体的成分及其物质的量为
您最近一年使用:0次
解题方法
3 . 硫酸是十分重要的化工原料。工业上用黄铁矿又称为二硫化亚铁( )制备硫酸的工艺如图所示。
)制备硫酸的工艺如图所示。
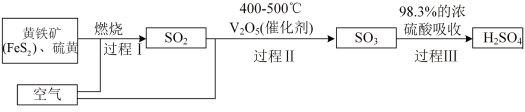
(1) 中硫元素的化合价是
中硫元素的化合价是_____ 。
(2)写出过程Ⅱ发生反应的化学方程式:_____ 。
(3)浓硫酸能氧化大多数金属单质和部分非金属单质,加热条件下,在木炭和浓硫酸的反应中,浓硫酸体现出的性质为_____(填序号)。
如图是模拟工业过程Ⅱ来探究 的催化氧化过程。
的催化氧化过程。
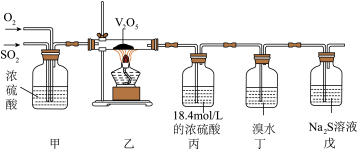
(4)装置甲的作用除干燥外还有_____ 。
(5)装置丙的目的是_____ 。反应结束后取1.0mL丙中的溶液稀释为5.0mL的稀硫酸,滴加几滴酚酞试剂、缓慢加入1.0mol/L的NaOH溶液,当混合溶液变红时,认为硫酸恰好完全反应,此时所用NaoH溶液体积大于36.8mL,说明_____ 。
(6)装置丁的作用是吸收 ,且溴水过量可保证其被完全吸收,现象是溴水颜色变浅,写出反应的化学方程式:
,且溴水过量可保证其被完全吸收,现象是溴水颜色变浅,写出反应的化学方程式:_____ 。
(7)装置戊中的现象是_____ 。
 )制备硫酸的工艺如图所示。
)制备硫酸的工艺如图所示。
(1)
 中硫元素的化合价是
中硫元素的化合价是(2)写出过程Ⅱ发生反应的化学方程式:
(3)浓硫酸能氧化大多数金属单质和部分非金属单质,加热条件下,在木炭和浓硫酸的反应中,浓硫酸体现出的性质为_____(填序号)。
| A.酸性 | B.氧化性 | C.脱水性 | D.吸水性 |
如图是模拟工业过程Ⅱ来探究
 的催化氧化过程。
的催化氧化过程。
(4)装置甲的作用除干燥外还有
(5)装置丙的目的是
(6)装置丁的作用是吸收
 ,且溴水过量可保证其被完全吸收,现象是溴水颜色变浅,写出反应的化学方程式:
,且溴水过量可保证其被完全吸收,现象是溴水颜色变浅,写出反应的化学方程式:(7)装置戊中的现象是
您最近一年使用:0次
4 . 如下图所示的装置中,A是氯气发生仪器,C、D为气体净化装置(C中装有饱和食盐水,D中装有浓硫酸),E是硬质玻璃管装有细铁丝网,F为干燥的空广口瓶,烧杯G中装有氢氧化钠溶液。
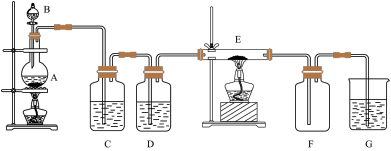
请回答下列问题:
(1)仪器A的名称是___________ ;B中盛装的药品是___________ ;
(2)实验室制备氯气的化学方程式为___________ ,其中还原剂为___________ ;
(3)C装置的作用是___________ ;D装置的作用是___________ ;
(4)E中发生化学反应的方程式为___________ ;
(5)烧杯G中氢氧化钠溶液的作用是_______ ;其发生反应的离子方程式为________ 。

请回答下列问题:
(1)仪器A的名称是
(2)实验室制备氯气的化学方程式为
(3)C装置的作用是
(4)E中发生化学反应的方程式为
(5)烧杯G中氢氧化钠溶液的作用是
您最近一年使用:0次
5 . 在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2。回答下列问题:

(1)I、II、III、IV装置可盛放的试剂是:I___________ ;II___________ ;III___________ ;IV___________ (将下列有关试剂的序号填入空格内)。
A.品红溶液 B.NaOH溶液 C.浓硫酸 D.酸性KMnO4溶液
(2)能说明SO2气体存在的现象是___________ 。
(3)使用装置II的目的是___________ 。
(4)使用装置III的目的是___________ 。
(5)确定含有乙烯的现象是___________ 。

(1)I、II、III、IV装置可盛放的试剂是:I
A.品红溶液 B.NaOH溶液 C.浓硫酸 D.酸性KMnO4溶液
(2)能说明SO2气体存在的现象是
(3)使用装置II的目的是
(4)使用装置III的目的是
(5)确定含有乙烯的现象是
您最近一年使用:0次
2023-06-29更新
|
60次组卷
|
18卷引用:云南省绥江县一中2018-2019学年高一下学期期末考试化学试题
云南省绥江县一中2018-2019学年高一下学期期末考试化学试题上海市奉城高级中学2018-2019学年高二上学期期末考试化学试题云南省元阳县一中2020-2021学年高一下学期6月份考试化学试题陕西省西安市蓝田县大学区联考2022-2023学年高二下学期6月期末考试化学试题(已下线)2012年人教版高中化学选修5 2.1脂肪烃练习卷(已下线)2014年高一化学人教版必修2 3.2.1乙烯练习卷内蒙古北京八中乌兰察布分校2016-2017学年高一下学期第二次调考化学试题高二人教版选修5 第三章 烃的含氧衍生物 第一节 醇酚吉林省公主岭市范家屯镇第一中学2019-2020学年高二上学期第二次月考化学试题黑龙江省大兴安岭地区漠河县第一中学2018-2019学年高二上学期第一次月考化学试题课时1 石油的炼制 乙烯——A学习区 夯实基础(鲁科版必修2)课时1 甲烷 石油的炼制与乙烯——A学习区 夯实基础(鲁科版(2019)第二册)山东省德州市齐河县实验中学2019-2020学年高一下学期期中考试化学试题福建省莆田第七中学2020-2021学年高二上学期第一次月考化学试题安徽省安庆桐城市第八中学2020-2021学年高二上学期第一次段考化学试题黑龙江省双鸭山市第一中学2020-2021学年高二下学期4月月考化学试题2.1.1有机化学反应的主要类型(课前)-鲁科版选择性必修3陕西省西安市蓝田县大学区联考2022-2023学年高二下学期4月期中考试化学试题
名校
解题方法
6 . 某兴趣小组为了探究SO2气体还原Fe3+的反应,他们使用的药品和装置如下图所示,下列说法不合理的是
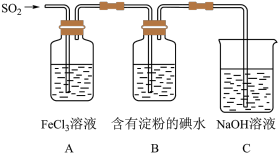
| A.能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色 |
| B.装置C的作用是吸收SO2尾气,防止污染空气 |
| C.为了验证A中发生了氧化还原反应,加入酸性KMnO4溶液,紫色褪去 |
| D.为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀 |
您最近一年使用:0次
2023-02-21更新
|
923次组卷
|
55卷引用:云南省丽江市宁蒗县第一中学2019—2020学年高一上学期期末考试化学试题
云南省丽江市宁蒗县第一中学2019—2020学年高一上学期期末考试化学试题云南省曲靖市罗平县第三中学2019-2020学年高一上学期期末考试化学试题云南省曲靖市沾益县炎方一中2019-2020学年高一上学期期末考试化学试题2015-2016学年黑龙江省大庆铁人中学高一上期末化学试卷2015-2016学年吉林省松原市油田高中高二下期末化学试卷【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高一上学期期末考试化学试题云南省西畴县二中2019-2020学年高二上学期开学考试化学试题安徽省滁州市定远县重点中学2018-2019学年高一上学期期末考试化学试题(已下线)2014年高考化学鲁科版3.3硫的转化练习卷2015-2016学年河北石家庄一中高一下学情反馈一化学卷2017届广东省中山一中高三上学期第一次统测化学试卷2017届黑龙江省牡丹江高级中学高三10月月考化学卷2017届河北省衡水中学高三上期中化学卷2017届山东省莱芜一中高三上学期10月月考化学试卷2017届河南省南阳一中高三上第三次周考化学卷福建省泰宁第一中学2018届高三上学期第一阶段考试化学试题宁夏石嘴山市第三中学2018届高三上学期期中考试化学试题(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第3讲 硫及其化合物【押题专练】(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第3讲 硫及其化合物【教学案】【全国百强校】黑龙江省牡丹江市第一高级中学2019届高三上学期期中考试化学试题山东省东营市第二中学2019届高三上学期模块考试(期中)化学试题贵州省剑河县第二中学2018-2019学年高一上学期12月份考试化学试题甘肃省甘谷第一中学2020届高三上学期第一次检测化学试题苏教版高中化学必修1专题4《硫 氮可持续发展》测试卷河南省商丘市第一高级中学2020届高三上学期期中考试化学试题河南省开封市第二十五中2019-2020高一下学期初分科考试化学试卷(已下线)专题4.3 硫及其化合物(练)——2020年高考化学一轮复习讲练测河北省衡水市桃城区第十四中学2019-2020学年高一下学期第五次综合测试化学试题(已下线)第四单元 非金属及其化合物测试题-2021年高考化学一轮复习名师精讲练(已下线)第15讲 硫及其化合物(精练)-2021年高考化学一轮复习讲练测福建省福州市闽江口联盟校2021届高三上学期期中联考化学试题(已下线)练习9 硫和二氧化硫-2020-2021学年【补习教材·寒假作业】高一化学(人教版2019)浙江省温州市瑞安市上海新纪元高级中学2021-2022学年高一9月份月考(5-6班)化学试题(已下线)4.2.1 含硫物质之间的转化(备作业)-【上好课】2021-2022学年高一化学同步备课系列(苏教版2019必修第一册)河南省林州市第一中学2021-2022学年高一下学期开学检测化学试题课后-5.1.3 不同价态含硫物质的转化-人教2019必修第二册广东省佛山市第一中学2021-2022学年高一下学期第一次段考(3月)化学试题湖南省常德市安乡县第一中学2021-2022 学年高二下学期期中考试化学试题湖南省湘潭市湘潭县第一中学2021-2022学年高三下学期期中考试化学试题上海交通大学附属中学2022-2023学年高二上学期开学摸底考试化学试题湖北省公安县第三中学2021-2022学年高三上学期8月质量检测化学试题安徽省宿州市第二中学2022-2023学年高一上学期第一次月考化学试题安徽省阜阳市第一中学2022-2023学年高一下学期第一次月考化学试题安徽省安庆市第一中学2022-2023学年高一下学期第一次月考化学试题安徽省亳州市第一中学2022-2023学年高一下学期第一次月考化学试题河南省郑州外国语学校2022-2023学年高一下学期第一次月考化学试题安徽省阜阳市太和中学2022-2023学年高一下学期第一次质量检测化学试题四川省广安市育才学校2022-2023学年高一下学期3月月考化学试题广东省广州市培英中学2022-2023学年高一下学期期中考试化学试题湖南省衡阳县第四中学2022-2023学年高一下学期第一次(3月)月考化学试题湖南省株洲市炎陵县2022-2023学年高一下学期3月月考化学试题安徽省淮北市树人高级中学2023-2024学年高一下学期开学考试化学试题北京师范大学第二附属中学2023-2024学年高一下学期3月化学测试题安徽省芜湖市第一中学2022-2023学年高一下学期3月份教学质量诊断测试化学试卷山西省大同市第一中学校2023-2024学年高一下学期4月期中考试化学试题
名校
解题方法
7 . 潜水艇中可用过氧化钠作为供氧剂。请适用适当的化学试剂,用图中的实验装置进行实验,证明过氧化钠可作供氧剂。
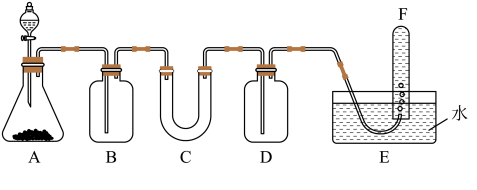
(1)A是制取CO2的装置,A装置主要仪器的名称为______ 、_____ ,写出A中发生反应的离子方程式:_____ 。
(2)填写表中空格:
(3)写出过氧化钠与二氧化碳反应的化学方程式:______ 。
(4)检验F中收集到的气体的现象是_____ 。

(1)A是制取CO2的装置,A装置主要仪器的名称为
(2)填写表中空格:
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | ① |
| C | ② | ③ |
| D | NaOH溶液 | ④ |
(4)检验F中收集到的气体的现象是
您最近一年使用:0次
名校
解题方法
8 . 实验表明,当乙醛加入到溴水中,溴水会褪色。针对此现象,某化学兴趣小组同学依据乙醛结构进行探究。
【实验假设】
(1)假设Ⅰ:醛基含有不饱和键,可与Br2发生_______ 反应(填反应类型)。
假设Ⅱ:乙醛具有α-H,可与溴水发生取代反应。无论乙醛发生几元取代反应,参加反应的Br2与生成的HBr的物质的量之比为_______ 。
假设Ⅲ:乙醛具有较强的还原性,可被溴水氧化,反应的化学方程式为_______ 。
【实验过程】针对以上假设,该小组同学设计了两组方案。
方案Ⅰ:通过对比反应现象判断反应类型。
结论:假设Ⅰ不成立。
(2)则试管2中的实验现象为_______ 。
方案Ⅱ:通过测定反应后混合液的pH判断反应类型。
注:苯酚和乙酸的电离及温度变化对混合液pH的影响可忽略不计。
(3)写出苯酚与溴水反应的化学方程式:_______ 。
(4)若试管4中反应后混合液的pH=1.85,则证明乙醛与溴水的反应为_______ 反应(填反应类型);若试管4中反应后混合液的pH_______ 1.85(填“大于”或“小于”),则证明乙醛与溴水的反应为氧化反应。
【实验假设】
(1)假设Ⅰ:醛基含有不饱和键,可与Br2发生
假设Ⅱ:乙醛具有α-H,可与溴水发生取代反应。无论乙醛发生几元取代反应,参加反应的Br2与生成的HBr的物质的量之比为
假设Ⅲ:乙醛具有较强的还原性,可被溴水氧化,反应的化学方程式为
【实验过程】针对以上假设,该小组同学设计了两组方案。
方案Ⅰ:通过对比反应现象判断反应类型。
| 序号 | 操作 | 现象 |
| 试管1 | 1mL溴水+1mL乙醛,充分振荡后静置 | 褪色 |
| 试管2 | 1mL溴的CCl4溶液+1mL乙醛,充分振荡后静置 |
(2)则试管2中的实验现象为
方案Ⅱ:通过测定反应后混合液的pH判断反应类型。
| 序号 | 操作 | pH |
| 试管3 | 加入20mL溴水,再加入10mL苯酚溶液,待完全反应后(苯酚过量),测定混合液pH | 1.85 |
| 试管4 | 加入20mL相同浓度的溴水,再加入10mL 20%的乙醛溶液(乙醛过量),3min后完全褪色,测定混合液pH |
(3)写出苯酚与溴水反应的化学方程式:
(4)若试管4中反应后混合液的pH=1.85,则证明乙醛与溴水的反应为
您最近一年使用:0次
9 . I.某化学兴趣小组利用如图装置进行“铁粉与水蒸气反应”的实验,并检验产物的性质(部分夹持装置已略去),请回答下列问题:
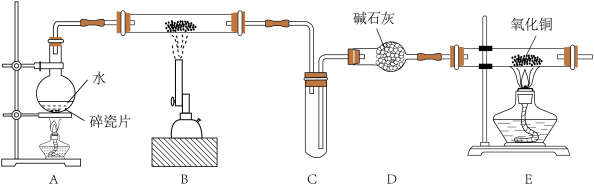
(1)A、B两个装置中应先点燃_______ (填序号)处的酒精(喷)灯。
(2)B装置硬质玻璃管中发生反应的化学方程式为_______ 。
(3)E装置中产生的现象是_______ 。
II.高铁酸钾 是一种新型净水剂,实验小组制备高铁酸钾
是一种新型净水剂,实验小组制备高铁酸钾 并探究其性质。
并探究其性质。
资料: 为紫色固体,微溶于
为紫色固体,微溶于 溶液;具有强氧化性,在酸性或中性溶液中快速产生
溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
(4)配平工业制备 反应的离子方程式:
反应的离子方程式:_______ 
(5)实验室制备 (夹持装置略):
(夹持装置略):
如图,A为氯气发生装置,其中反应方程式为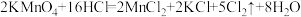 。
。
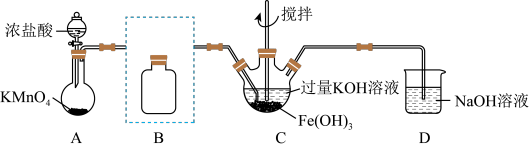
①B为未组装好的除杂装置,B中所用试剂的作用为_______ 。
②C中得到紫色固体, 发生的反应主要是
发生的反应主要是 ,除此之外C中
,除此之外C中 还会发生的反应有(用离子方程式表示)
还会发生的反应有(用离子方程式表示)_______ 。
(6)探究 的性质
的性质
取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有 。为证明
。为证明 是否氧化了
是否氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:
①由方案I中溶液变红可知a中含有_______ 。
②根据方案II得出:氧化性
_______  (填“>”或“<”),而此结论与
(填“>”或“<”),而此结论与 的制备实验证明的氧化性强弱关系相反,说明溶液的酸碱性会影响粒子的氧化性强弱。
的制备实验证明的氧化性强弱关系相反,说明溶液的酸碱性会影响粒子的氧化性强弱。

(1)A、B两个装置中应先点燃
(2)B装置硬质玻璃管中发生反应的化学方程式为
(3)E装置中产生的现象是
II.高铁酸钾
 是一种新型净水剂,实验小组制备高铁酸钾
是一种新型净水剂,实验小组制备高铁酸钾 并探究其性质。
并探究其性质。资料:
 为紫色固体,微溶于
为紫色固体,微溶于 溶液;具有强氧化性,在酸性或中性溶液中快速产生
溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。(4)配平工业制备
 反应的离子方程式:
反应的离子方程式:
(5)实验室制备
 (夹持装置略):
(夹持装置略):如图,A为氯气发生装置,其中反应方程式为
 。
。
①B为未组装好的除杂装置,B中所用试剂的作用为
②C中得到紫色固体,
 发生的反应主要是
发生的反应主要是 ,除此之外C中
,除此之外C中 还会发生的反应有(用离子方程式表示)
还会发生的反应有(用离子方程式表示)(6)探究
 的性质
的性质取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有
 。为证明
。为证明 是否氧化了
是否氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:| 方案I | 取少量a,滴加 溶液至过量,溶液呈红色。 溶液至过量,溶液呈红色。 |
| 方案II | 用 溶液充分洗涤C中所得固体,再用 溶液充分洗涤C中所得固体,再用 溶液将 溶液将 溶出,得到紫色溶液b.取少量b,滴加盐酸,有 溶出,得到紫色溶液b.取少量b,滴加盐酸,有 产生。 产生。 |
②根据方案II得出:氧化性

 (填“>”或“<”),而此结论与
(填“>”或“<”),而此结论与 的制备实验证明的氧化性强弱关系相反,说明溶液的酸碱性会影响粒子的氧化性强弱。
的制备实验证明的氧化性强弱关系相反,说明溶液的酸碱性会影响粒子的氧化性强弱。
您最近一年使用:0次
解题方法
10 . 电路板广泛用于计算机、手机等电子产品中。我区某中学化学兴趣小组拟制作带有“COP15”标志的电路板并对铁及其化合物的性质进行探究。
I.制作电路板
兴趣小组同学取一小块覆铜板,用油性笔在铜板上画出“COP15”标志(图1),然后浸入 溶液(图2)。过一段时间后,取出覆铜板并用水洗净,获得带有图案的印刷电路板(图3)和废液。
溶液(图2)。过一段时间后,取出覆铜板并用水洗净,获得带有图案的印刷电路板(图3)和废液。

(1)在覆铜板上制作出“COP15”图案过程中发生反应的化学方程式为_______ 。取少量废液于试管中,滴加几滴KSCN溶液,溶液出现红色,则废液中含有_______ (填离子符号)。
II.探究铁及其化合物的性质
(2)填写下表。
III.回收废液
(3)对腐蚀废液进行回收可有效利用金属资源。一种回收利用金属铜并获得氯化铁晶体的部分工艺流程如下:
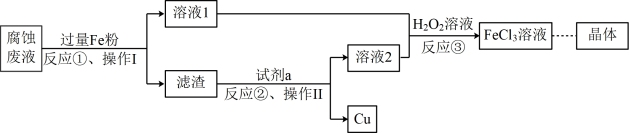
操作I为_______ ,试剂a是_______ 。反应③中加入 溶液的目的是
溶液的目的是_______ 。
I.制作电路板
兴趣小组同学取一小块覆铜板,用油性笔在铜板上画出“COP15”标志(图1),然后浸入
 溶液(图2)。过一段时间后,取出覆铜板并用水洗净,获得带有图案的印刷电路板(图3)和废液。
溶液(图2)。过一段时间后,取出覆铜板并用水洗净,获得带有图案的印刷电路板(图3)和废液。
(1)在覆铜板上制作出“COP15”图案过程中发生反应的化学方程式为
II.探究铁及其化合物的性质
(2)填写下表。
| 实验 | 实验操作 | 实验现象 | 离子方程式 | 实验结论 |
| a | 取少量废液于试管中,加入足量Fe粉 | 铁粉部分溶解,溶液呈浅绿色 | ① | ② |
| b | 取少量实验a中反应后的上层清液于试管中,滴加几滴氯水 | ③ |  |  具有还原性 具有还原性 |
III.回收废液
(3)对腐蚀废液进行回收可有效利用金属资源。一种回收利用金属铜并获得氯化铁晶体的部分工艺流程如下:

操作I为
 溶液的目的是
溶液的目的是
您最近一年使用:0次



