解题方法
1 . 某小组根据 既有还原性又有氧化性,探究其能否实现
既有还原性又有氧化性,探究其能否实现 或
或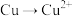 的转化。
的转化。
已知:
i.水合 既易被氧化也易被还原,因此水溶液中无法生成水合
既易被氧化也易被还原,因此水溶液中无法生成水合 ;
;
ii. 为白色固体,难溶于水,可溶于
为白色固体,难溶于水,可溶于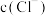 较大的溶液生成
较大的溶液生成 ,也可溶于氨水生成
,也可溶于氨水生成 (无色)。
(无色)。
Ⅰ. 与
与 的反应:向试管中通入足量
的反应:向试管中通入足量 (尾气处理装置已略),记录如下。
(尾气处理装置已略),记录如下。
(1)将b所得沉淀过滤,充分洗涤,进行下列实验,证实该沉淀为 。
。 ,推理过程是
,推理过程是_______ 。
②iii排除了干扰 检验的因素。写出iii中反应应离子方程式
检验的因素。写出iii中反应应离子方程式_______ ;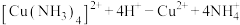
(2)进一步证实b中 作还原剂,补全实验方案和预期现象:取b中反应后的上层清液于试管中,
作还原剂,补全实验方案和预期现象:取b中反应后的上层清液于试管中,_______ 。
(3)由实验Ⅰ可推知,该条件下:①a中 不能将
不能将 还原为
还原为 或
或 ;②
;②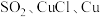 的还原性由强到弱的顺序为
的还原性由强到弱的顺序为_______ 。
综上所述,改变还原产物的价态或形态可以影响氧化还原反应能否发生。
Ⅱ. 与
与 的反应:向试管中通入足量
的反应:向试管中通入足量 (尾气处理装置已略),记录如下。
(尾气处理装置已略),记录如下。
(4)证明d所得棕色溶液中含有 :用滴管吸取少量棕色溶液,滴入蒸馏水中,出现白色沉淀。用平衡移动原理解释产生该现象的原因:
:用滴管吸取少量棕色溶液,滴入蒸馏水中,出现白色沉淀。用平衡移动原理解释产生该现象的原因:_______ 。
(5)经进一步检验,铜表面黑色沉淀为 。补全d中反应的离子方程式:
。补全d中反应的离子方程式:_______ 。
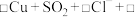 _______
_______ _______。
_______。
(6)与c对比,d能够发生反应的原因是_______ 。
 既有还原性又有氧化性,探究其能否实现
既有还原性又有氧化性,探究其能否实现 或
或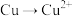 的转化。
的转化。已知:
i.水合
 既易被氧化也易被还原,因此水溶液中无法生成水合
既易被氧化也易被还原,因此水溶液中无法生成水合 ;
;ii.
 为白色固体,难溶于水,可溶于
为白色固体,难溶于水,可溶于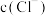 较大的溶液生成
较大的溶液生成 ,也可溶于氨水生成
,也可溶于氨水生成 (无色)。
(无色)。Ⅰ.
 与
与 的反应:向试管中通入足量
的反应:向试管中通入足量 (尾气处理装置已略),记录如下。
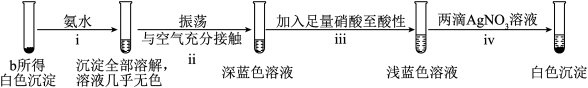
(尾气处理装置已略),记录如下。| 装置 | 编号 | 试剂 | 实验现象 |
| a | 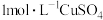 溶液 溶液 | 始终无明显变化 |
| b | 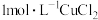 溶液 溶液 | 溶液变绿,进而变棕黄色,一段时间后出现白色沉淀 |
(1)将b所得沉淀过滤,充分洗涤,进行下列实验,证实该沉淀为
 。
。
 ,推理过程是
,推理过程是②iii排除了干扰
 检验的因素。写出iii中反应应离子方程式
检验的因素。写出iii中反应应离子方程式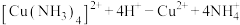
(2)进一步证实b中
 作还原剂,补全实验方案和预期现象:取b中反应后的上层清液于试管中,
作还原剂,补全实验方案和预期现象:取b中反应后的上层清液于试管中,(3)由实验Ⅰ可推知,该条件下:①a中
 不能将
不能将 还原为
还原为 或
或 ;②
;②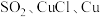 的还原性由强到弱的顺序为
的还原性由强到弱的顺序为综上所述,改变还原产物的价态或形态可以影响氧化还原反应能否发生。
Ⅱ.
 与
与 的反应:向试管中通入足量
的反应:向试管中通入足量 (尾气处理装置已略),记录如下。
(尾气处理装置已略),记录如下。| 装置 | 编号 | 试剂 | 实验现象 |
| c |  稀硫酸 稀硫酸 | 始终无明显变化 |
| d |  稀盐酸 稀盐酸 | 铜片表面变黑,溶液变为棕色 |
(4)证明d所得棕色溶液中含有
 :用滴管吸取少量棕色溶液,滴入蒸馏水中,出现白色沉淀。用平衡移动原理解释产生该现象的原因:
:用滴管吸取少量棕色溶液,滴入蒸馏水中,出现白色沉淀。用平衡移动原理解释产生该现象的原因:(5)经进一步检验,铜表面黑色沉淀为
 。补全d中反应的离子方程式:
。补全d中反应的离子方程式: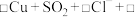 _______
_______ _______。
_______。(6)与c对比,d能够发生反应的原因是
您最近一年使用:0次
解题方法
2 .  是一种常见的无机物,它既是重要的物质资源,也是环境污染物之一,某学习小组改进教材中关于
是一种常见的无机物,它既是重要的物质资源,也是环境污染物之一,某学习小组改进教材中关于 的制备和性质探究实验。回答下列问题:
的制备和性质探究实验。回答下列问题:_______ 。
(2)查阅资料可知,可以用 固体(粉末状)和稀硫酸溶液反应制备
固体(粉末状)和稀硫酸溶液反应制备 ,该反应的优点是无需使用加热装置,则可选择的发生装置为
,该反应的优点是无需使用加热装置,则可选择的发生装置为_______ (填序号)。 的性质,完成下列表格
的性质,完成下列表格
(4)若直接将 通入品红溶液中,容易发生“倒吸”现象,小组同学增加如图防倒吸装置B,请在虚线框中画出该装置
通入品红溶液中,容易发生“倒吸”现象,小组同学增加如图防倒吸装置B,请在虚线框中画出该装置_______ 。
(5)装置F的作用是尾气处理,盛放的试剂为_______ 。
 是一种常见的无机物,它既是重要的物质资源,也是环境污染物之一,某学习小组改进教材中关于
是一种常见的无机物,它既是重要的物质资源,也是环境污染物之一,某学习小组改进教材中关于 的制备和性质探究实验。回答下列问题:
的制备和性质探究实验。回答下列问题:
(2)查阅资料可知,可以用
 固体(粉末状)和稀硫酸溶液反应制备
固体(粉末状)和稀硫酸溶液反应制备 ,该反应的优点是无需使用加热装置,则可选择的发生装置为
,该反应的优点是无需使用加热装置,则可选择的发生装置为
 的性质,完成下列表格
的性质,完成下列表格| 装置 | 现象 | 解释 |
| C | ① |  具有漂白性 具有漂白性 |
| D | ②浅黄绿色变为无色 | 其中发生反应的离子方程式为 |
| E | ③ |  具有 具有 |
(4)若直接将
 通入品红溶液中,容易发生“倒吸”现象,小组同学增加如图防倒吸装置B,请在虚线框中画出该装置
通入品红溶液中,容易发生“倒吸”现象,小组同学增加如图防倒吸装置B,请在虚线框中画出该装置(5)装置F的作用是尾气处理,盛放的试剂为
您最近一年使用:0次
名校
解题方法
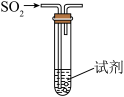
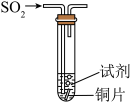
3 . 浓硫酸是一种具有高腐蚀性的强矿物酸,某实验小组设计如下实验探究浓硫酸的性质。
I.铜可与浓硫酸反应制备SO2。
(1)可选取的适宜发生装置是___________ (填标号),该装置内发生反应的化学方程式为__________ 。___________ 。
Ⅱ.该实验小组探究木炭和浓硫酸的反应并检验所得产物的实验装置如图。___________ ,第二瓶品红溶液的作用是___________ 。
(4)如果将装置中①②③三部分仪器的连接顺序变为②①③,则可以检出的物质是___________ ,不能检出的物质是____________ 。
(5)如果将仪器的连接顺序变为①③②,则可以检出的物质是____________ ,不能检出的物质是___________ 。
I.铜可与浓硫酸反应制备SO2。
(1)可选取的适宜发生装置是
Ⅱ.该实验小组探究木炭和浓硫酸的反应并检验所得产物的实验装置如图。
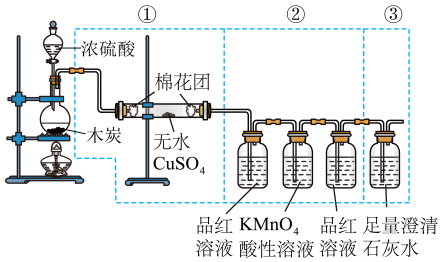
(4)如果将装置中①②③三部分仪器的连接顺序变为②①③,则可以检出的物质是
(5)如果将仪器的连接顺序变为①③②,则可以检出的物质是
您最近一年使用:0次
2024-05-05更新
|
54次组卷
|
3卷引用:辽宁省葫芦岛市长江卫生中等职业技术学校2023-2024学年高二下学期7月期末考试化学试题
名校
解题方法
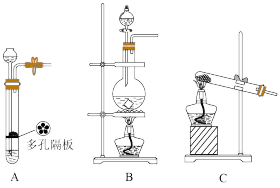
4 . 验证氧化性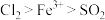 ,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已省略,气密性已检验)。
,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已省略,气密性已检验)。
Ⅰ.打开止水夹 ,通入一段时间
,通入一段时间 ,再将T型导管插入B中,继续通入
,再将T型导管插入B中,继续通入 ,然后关闭
,然后关闭 ,
, ,
, 。
。
Ⅱ.打开活塞a,滴加⼀定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,关闭 。
。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开 和活塞c,加入70%的硫酸溶液,一段时间后关闭
和活塞c,加入70%的硫酸溶液,一段时间后关闭 。
。
Ⅵ.更换试管D,重复过程Ⅳ,检验B中溶液的离子。
(1)检验B中 溶液中
溶液中 的现象为
的现象为__________ ,发生反应的离子方程式__________ 。
(2)过程Ⅰ的目的是_________________________________________________ 。
(3)若向过程ⅢB中的黄色溶液中通入 气体,会观察到有淡黄色沉淀生成,写出该反应的离子方程式:
气体,会观察到有淡黄色沉淀生成,写出该反应的离子方程式:__________ 。
(4)若将C中制取的 通入硫酸酸化的高锰酸钾溶液可使溶液褪色,其反应的离子方程式为
通入硫酸酸化的高锰酸钾溶液可使溶液褪色,其反应的离子方程式为__________ 。
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果⼀定能够证明氧化性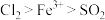 的是
的是_____________ (填“甲”“乙”或“丙”)。
(6)将B中的 溶液换成
溶液换成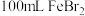 溶液并向其中通入
溶液并向其中通入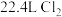 (标准状况下),若溶液中有
(标准状况下),若溶液中有 的
的 被氧化成单质
被氧化成单质 ,则原
,则原 溶液中
溶液中 的物质的量浓度为
的物质的量浓度为_____________ 。
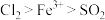 ,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已省略,气密性已检验)。
,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已省略,气密性已检验)。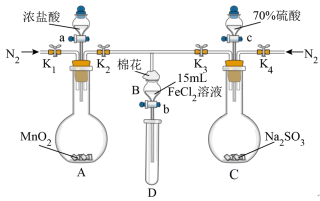
Ⅰ.打开止水夹
 ,通入一段时间
,通入一段时间 ,再将T型导管插入B中,继续通入
,再将T型导管插入B中,继续通入 ,然后关闭
,然后关闭 ,
, ,
, 。
。Ⅱ.打开活塞a,滴加⼀定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,关闭
 。
。Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开
 和活塞c,加入70%的硫酸溶液,一段时间后关闭
和活塞c,加入70%的硫酸溶液,一段时间后关闭 。
。Ⅵ.更换试管D,重复过程Ⅳ,检验B中溶液的离子。
(1)检验B中
 溶液中
溶液中 的现象为
的现象为(2)过程Ⅰ的目的是
(3)若向过程ⅢB中的黄色溶液中通入
 气体,会观察到有淡黄色沉淀生成,写出该反应的离子方程式:
气体,会观察到有淡黄色沉淀生成,写出该反应的离子方程式:(4)若将C中制取的
 通入硫酸酸化的高锰酸钾溶液可使溶液褪色,其反应的离子方程式为
通入硫酸酸化的高锰酸钾溶液可使溶液褪色,其反应的离子方程式为(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果⼀定能够证明氧化性
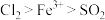 的是
的是过程为Ⅳ,B溶液中含有的离子 | 过程Ⅵ,B溶液中含有的离子 | |
甲 | 有 | 有 |
乙 | 既有 | 有 |
丙 | 有 | 有 |
 溶液换成
溶液换成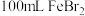 溶液并向其中通入
溶液并向其中通入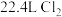 (标准状况下),若溶液中有
(标准状况下),若溶液中有 的
的 被氧化成单质
被氧化成单质 ,则原
,则原 溶液中
溶液中 的物质的量浓度为
的物质的量浓度为
您最近一年使用:0次
2022-11-24更新
|
410次组卷
|
4卷引用:辽宁省葫芦岛市2022-2023学年高一下学期7月期末考试化学试题
辽宁省葫芦岛市2022-2023学年高一下学期7月期末考试化学试题(已下线)猜想03 气体的制取、无机实验探究、无机综合应用(考题猜想)-2023-2024学年高一化学下学期期末考点大串讲(人教版2019必修第二册)(已下线)重难点02 常见物质的制取与性质探究-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(人教版2019必修第二册)天津市第一中学2022-2023学年高一上学期第二次月考化学试题
名校
解题方法
5 . 某同学用下图装置制取 Cl2 并探究性质,回答下列问题:
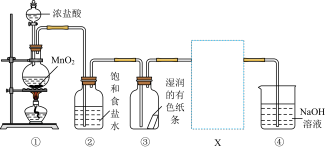
(1)装置①用于制取 Cl2,反应的化学方程式是_______ 。
(2)装置②的作用是_______ 。
(3)装置③中的现象是_______ 。
(4)为验证 Cl2 的氧化性强于 I2,在③、④之间增加装置 X,将装置 X 补充完整并标明所用试剂_______ ,装置 X 中发生反应的离子方程式是_______ 。
(5)装置④中发生反应的离子方程式是_______ 。

(1)装置①用于制取 Cl2,反应的化学方程式是
(2)装置②的作用是
(3)装置③中的现象是
(4)为验证 Cl2 的氧化性强于 I2,在③、④之间增加装置 X,将装置 X 补充完整并标明所用试剂
(5)装置④中发生反应的离子方程式是
您最近一年使用:0次
2021-01-23更新
|
259次组卷
|
5卷引用:辽宁省葫芦岛市普通高中2021-2022学年高一上学期期末学业质量监测化学试题
2012·上海·
名校
解题方法
6 . 某同学设计了钠与氯气反应的装置,如图。将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。先给钠预热,到钠熔融成圆球时,停止加热,通入氯气,即可见钠燃烧起来,生成大量白烟。以下叙述错误的是
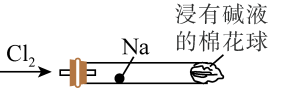
| A.钠着火燃烧产生苍白色火焰 |
| B.浸有NaOH溶液的棉球是用于吸收过量的氯气,以避免污染空气 |
| C.反应生成的大量白烟是氯化钠晶体 |
| D.若在棉球外沿滴一滴淀粉碘化钾溶液,可以判断氯气是否被碱液完全吸收 |
您最近一年使用:0次
2020-03-31更新
|
82次组卷
|
3卷引用:辽宁省葫芦岛市长江卫生中等职业技术学校2023-2024学年高二下学期7月期末考试化学试题
辽宁省葫芦岛市长江卫生中等职业技术学校2023-2024学年高二下学期7月期末考试化学试题福建省福州高级中学2023-2024学年高二下学期7月期末化学试题(已下线)上海市十三校2012届高三第二次联考化学试题
名校
解题方法
7 . 控制变量是科学研究重要方法。由下列实验现象一定能得出相应结论的是
| 选项 | A | B | C | D |
| 装置图 |  |  |  |  |
| 现象 | 右边试管产生气泡较快 | 左边棉球变棕黄色,右边棉球变蓝色 | B中产生白色沉淀,C中溶液颜色褪去 | 试管中液体变浑浊 |
| 结论 | 催化活性:Fe3+>Cu2+ | 氧化性:Br2>I2 | 硫酸亚铁铵分解的产物中除NH3外还含有SO3和SO2 | 非金属性:C>Si |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-02-24更新
|
395次组卷
|
4卷引用:辽宁省葫芦岛市2021届高三上学期期末考试化学试题
8 . 绿矾是含有一定量结晶水的硫酸亚铁。某化学兴趣小组对绿矾的某一性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化,再向试管中通入氯气,溶液逐渐变红。由此可知硫酸亚铁的一些性质为:_________ ;此过程中涉及的反应离子方程式为_______________ 。
(2)为探究硫酸亚铁的分解产物,无水硫酸亚铁固体置于装置A中,打开K1和K2,缓缓通入N2,加热。实验后反应管A中残留固体为红色粉末。
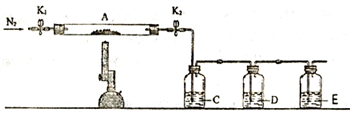
①C、D、E中的溶液依次为_______ (填标号)。C、D中有气泡冒出,C、D中还可观察到的现象分别为________ 、________ 。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出装置A 中反应的化学方程式_____________ 。
③装置E 的作用_____________ 。
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化,再向试管中通入氯气,溶液逐渐变红。由此可知硫酸亚铁的一些性质为:
(2)为探究硫酸亚铁的分解产物,无水硫酸亚铁固体置于装置A中,打开K1和K2,缓缓通入N2,加热。实验后反应管A中残留固体为红色粉末。

①C、D、E中的溶液依次为
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出装置A 中反应的化学方程式
③装置E 的作用
您最近一年使用:0次
9 . 某研究小组欲探究Na2O2 与水的反应,可供使用的试剂有: Na2O2、蒸馏水、KMnO4 酸性溶液、MnO2。Na2O2 样品与过量水反应,待完全反应不再产生氧气后,得溶液X。查阅资料表明,Na2O2与水反应还可生成H2O2。
(1)写出Na2O2与水生成O2的化学反应方程式____________ ,每生成1molO2,转移电子的物质的量为____________ 。
(2)Na2O2 与水反应生成H2O2的反应是否属于氧化还原反应______ (填是、否)。试设计实验证明Na2O2与水反应后的溶液X中含过氧化氢_______ 。
(3)取少量溶液X 于试管中,滴加FeSO4溶液,立即生成红褐色沉淀,则该反应的离子方程式为______________ 。
(4)若H2O2可与酸性KMnO4溶液反应,溶液褪色,放出氧气,完成并配平该反应的离子方程式:____ MnO4-+___H2O2+_____-----_____Mn2++____O2↑ +______。
(5)取40gNa2O2固体粉末与一定量二氧化碳反应后,固体质量变为47g,则该反应中消耗Na2O2的质量是______ g。
(1)写出Na2O2与水生成O2的化学反应方程式
(2)Na2O2 与水反应生成H2O2的反应是否属于氧化还原反应
(3)取少量溶液X 于试管中,滴加FeSO4溶液,立即生成红褐色沉淀,则该反应的离子方程式为
(4)若H2O2可与酸性KMnO4溶液反应,溶液褪色,放出氧气,完成并配平该反应的离子方程式:
(5)取40gNa2O2固体粉末与一定量二氧化碳反应后,固体质量变为47g,则该反应中消耗Na2O2的质量是
您最近一年使用:0次

 无
无


