1 . 化学反应A+B→C(放出能量)分两步进行:①A+B→X(吸收能量),②X→C(放出能量)。下列示意图中表示总反应过程中能量变化的是
A.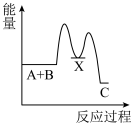 | B. |
C.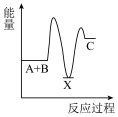 | D.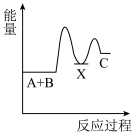 |
您最近一年使用:0次
2024-04-28更新
|
187次组卷
|
10卷引用:辽宁省葫芦岛市2022-2023学年高一下学期7月期末考试化学试题
辽宁省葫芦岛市2022-2023学年高一下学期7月期末考试化学试题浙江省台州市台州八校联盟2022-2023学年高二上学期11月期中联考化学试题(已下线)第04讲 化学反应与能量变化-【寒假自学课】2024年高一化学寒假提升学与练(人教版2019)山东省济宁市第一中学2023-2024学年高一下学期4月月考化学试题江苏省盐城市五校联考2023-2024学年高一下学期3月月考化学试题江苏省扬州市树人中学2023-2024学年高一下学期第一次月考化学 试题(已下线)清单03 化学反应与能量(考点清单)(讲+练)-2023-2024学年高一化学下学期期末考点大串讲(人教版2019必修第二册)广西来宾市忻城县高级中学2023-2024学年高一下学期期中考试化学试卷江西省景德镇市乐平中学2023-2024学年高一下学期4月期中考试化学试题北京景山学校2023-2024学年高一下学期期中考试化学试题
名校
2 . 痛风病与关节滑液中形成的尿酸钠(NaUr)有关(NaUr增多,病情加重),其化学原理为:
 。下列说法
。下列说法
| A.饮食中摄入过多食盐,会加重痛风病病情 | B.大量饮水会增大痛风病发作的可能性 |
| C.寒冷季节更易诱发关节疼痛 | D.患痛风病的人应少吃能代谢产生更多尿酸的食物 |
您最近一年使用:0次
2024-02-21更新
|
170次组卷
|
41卷引用:辽宁省葫芦岛市2020-2021学年高二上学期期末考试化学试题
辽宁省葫芦岛市2020-2021学年高二上学期期末考试化学试题北京市西城区2019-2020学年度高二上学期期末考试化学试题北京市房山区2020-2021学年高二上学期期末考试化学试题广东省汕头市聿怀中学2022-2023学年高二上学期期末线上考试化学试题安徽省宣城市2022-2023学年高二上学期期末调研考试化学试题广东省河源市龙川县第一中学2022-2023学年高二上学期期末考试化学试题云南省玉溪师范学院附属中学2022-2023学年高二下学期期末考试化学试题甘肃省平凉市第二中学2022-2023学年高二上学期期末考试(延考)化学试题上海市奉贤区2020届高三5月教学质量调研(二模)化学试题湖北省黄冈市麻城市实验高中2020-2021学年高二上学期10月月考化学试题江西省赣州市南康中学2020-2021学年高二上学期第二次大考化学试题内蒙古阿荣旗第一中学2020-2021学年高二上学期期中考试化学试题山西省朔州市怀仁县大地学校2020-2021学年高二上学期第三次月考化学试题北京市第四十三中学2020-2021学年高二上学期12月月考化学试题河南省焦作市县级重点中学2021-2022学年高二上学期期中考试化学试题吉林省长白山第二高级中学校2021-2022学年高三上学期第二次月考化学试题北京市第四十四中学2021-2022学年高二上学期期中考试化学试题北京市顺义区杨镇第一中学2021-2022学年高二上学期期中考试化学试题 北京市房山区2022-2023学年高二上学期期中质量检测化学试题北京市第七中学2022-2023学年高二上学期期中化学试题北京市顺义区杨镇第一中学2022-2023学年高二上学期期中检测化学试题广东省信宜市第二中学2022-2023学年高二上学期11月月考化学试题广东省珠海市实验中学2022-2023学年高二上学期第一次段考化学试题北京市顺义区2023届高三第一次统练化学试题(已下线)专题15 化学反应速率和化学平衡新疆乌鲁木齐市第四中学2022-2023学年高二下学期期中阶段诊断测试化学试题(已下线)第05讲 影响化学平衡的因素-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)北京市顺义牛栏山第一中学2023-2024学年高二上学期期中考试化学试题黑龙江省齐齐哈尔市恒昌中学校2022-2023学年高二上学期11月期中检测化学试题北京市清华大学附属中学2023-2024学年高二上学期期中考试化学试题北京市第六十六中学2023-2024学年高二上学期期中质量检测化学试题黑龙江省哈尔滨市第三十二中学校2023-2024学年高二上学期11月期中考试化学试题北京市大兴区兴华中学2023-2024学年高二上学期期中考试化学试题北京师范大学附属中学2023-2024学年高二上学期期中考试化学试卷北京市第一六六中学2022-2023学年高二上学期期中考试化学试卷北京师范大学第二附属中学2023-2024学年高二上学期期中考试化学试题浙江省宁波三锋教研联盟2023-2024学年高二上学期期中联考化学试题河南省信阳市淮滨县2022-2023学年高二上学期11月期中考试化学试题四川省内江市2025届第三中学高二上学期化学试卷北京市北京师范大学附属中学平谷第一分校2023-2024学年高二上学期期中考试化学试题北京市顺义区2022-2023学年高三上学期第一次统练化学试卷
名校
3 . Ⅰ.硫酸酸化的高锰酸钾溶液与草酸发生化学反应,反应如下:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O,某化学兴趣小组为了测定草酸浓度,主要做了如下实验。用0.1000mol/L酸性高锰酸钾溶液滴定未知浓度的H2C2O4溶液。实验中测得的数据记录如下:
回答问题:
(1)配制KMnO4标准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要图中的______ (填字母代号)。

(2)用配制好的高锰酸钾滴定草酸时,高锰酸钾溶液应盛装于______ 滴定管。滴定时,眼睛应注视______ 。
(3)该实验中未使用指示剂就可判断终点,到达终点的判断标志是________ 。
(4)根据表中数据,计算H2C2O4溶液的浓度_________ 。
(5)下列造成H2C2O4溶液的浓度偏高的是________。
Ⅱ.氧化还原滴定,可用于 粗产品的纯度测定。
粗产品的纯度测定。
称取m g产品配成250mL溶液,取25.00mL溶液加入足量的KI和稀H2SO4,充分反应后加入淀粉溶液作指示剂,用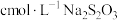 标准溶液滴定至终点(
标准溶液滴定至终点( ),平均消耗标准溶液的体积为VmL。
),平均消耗标准溶液的体积为VmL。
(6)加入KI和稀 后发生反应的离子方程式为
后发生反应的离子方程式为_________ 。
(7)滴定终点的现象为________ ,则产品中 的质量分数为
的质量分数为_______ %。
| 滴定次数 | H2C2O4体积 | 滴定前KMnO4体积 | 终点时KMnO4体积 |
| 1 | 25.00mL | 0.00mL | 21.41mL |
| 2 | 25.00mL | 0.02mL | 21.44mL |
| 3 | 25.00mL | 1.04mL | 22.47mL |
| 4 | 25.00mL | 0.04mL | 24.46 mL |
(1)配制KMnO4标准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要图中的

(2)用配制好的高锰酸钾滴定草酸时,高锰酸钾溶液应盛装于
(3)该实验中未使用指示剂就可判断终点,到达终点的判断标志是
(4)根据表中数据,计算H2C2O4溶液的浓度
(5)下列造成H2C2O4溶液的浓度偏高的是________。
| A.滴定终点读数时俯视 | B.滴定前有气泡,滴定后气泡消失 |
| C.润洗锥形瓶 | D.滴定过程中加入少量蒸馏水冲洗瓶壁 |
Ⅱ.氧化还原滴定,可用于
 粗产品的纯度测定。
粗产品的纯度测定。称取m g产品配成250mL溶液,取25.00mL溶液加入足量的KI和稀H2SO4,充分反应后加入淀粉溶液作指示剂,用
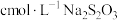 标准溶液滴定至终点(
标准溶液滴定至终点( ),平均消耗标准溶液的体积为VmL。
),平均消耗标准溶液的体积为VmL。(6)加入KI和稀
 后发生反应的离子方程式为
后发生反应的离子方程式为(7)滴定终点的现象为
 的质量分数为
的质量分数为
您最近一年使用:0次
名校
解题方法
4 . 下列各组离子在相应条件下可能大量共存的是
A.能使pH试纸变橙色的溶液中:  、K+、Cl-、Na+ 、K+、Cl-、Na+ |
B.由水电离产生的c(H+)=1×10−10mol∙L−1的溶液中: 、Mg2+、Na+、 、Mg2+、Na+、 |
C.在 =1×1010的溶液中: =1×1010的溶液中: 、Fe2+、Cl-、 、Fe2+、Cl-、 |
D.加水稀释pH增大的溶液:Na+、K+、Cl-、 |
您最近一年使用:0次
名校
解题方法
5 . 在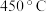 下
下 催化
催化 和
和 反应时的反应机理如下。
反应时的反应机理如下。
反应①: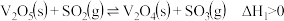
反应②: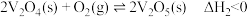 ,下列说法正确的是
,下列说法正确的是
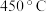 下
下 催化
催化 和
和 反应时的反应机理如下。
反应时的反应机理如下。反应①:
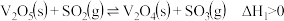
反应②:
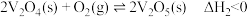 ,下列说法正确的是
,下列说法正确的是A.反应①的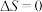 |
B. 在高温条件下能自发进行、低温条件下不能自发进行 在高温条件下能自发进行、低温条件下不能自发进行 |
C. |
D.使用 降低反应的焓变,氯碱工业使用阴离子交换膜可防止 降低反应的焓变,氯碱工业使用阴离子交换膜可防止 与 与 反应 反应 |
您最近一年使用:0次
2024-02-03更新
|
119次组卷
|
2卷引用:辽宁省葫芦岛市第一高级中学2023-2024学年高二上学期化学期末复习提升卷
名校
解题方法
6 . 完成下列问题。
(1)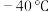 时,
时, 与冰反应生成
与冰反应生成 利
利 。常温常压下,
。常温常压下, 为无色气体,固态
为无色气体,固态 的晶体类型为
的晶体类型为________ , 水解反应的产物为
水解反应的产物为_____ (填化学式)。
(2) 中心原子为
中心原子为 ,
, 中心原子为
中心原子为 ,二者均为
,二者均为 形结构,但
形结构,但 中存在大
中存在大 键(
键( )。
)。 中
中 原子的轨道杂化方式
原子的轨道杂化方式____ ;为 键角
键角____  键角(填“>”“ <”或“=”)。比较
键角(填“>”“ <”或“=”)。比较 与
与 中
中 键的键长并说明原因
键的键长并说明原因_____ 。
(3)由硅原子核形成的三种微粒,电子排布式分别为:① 、②
、②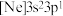 、③
、③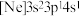 ,有关这些微粒的叙述,正确的是______。
,有关这些微粒的叙述,正确的是______。
(1)
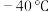 时,
时, 与冰反应生成
与冰反应生成 利
利 。常温常压下,
。常温常压下, 为无色气体,固态
为无色气体,固态 的晶体类型为
的晶体类型为 水解反应的产物为
水解反应的产物为(2)
 中心原子为
中心原子为 ,
, 中心原子为
中心原子为 ,二者均为
,二者均为 形结构,但
形结构,但 中存在大
中存在大 键(
键( )。
)。 中
中 原子的轨道杂化方式
原子的轨道杂化方式 键角
键角 键角(填“>”“ <”或“=”)。比较
键角(填“>”“ <”或“=”)。比较 与
与 中
中 键的键长并说明原因
键的键长并说明原因(3)由硅原子核形成的三种微粒,电子排布式分别为:①
 、②
、②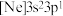 、③
、③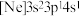 ,有关这些微粒的叙述,正确的是______。
,有关这些微粒的叙述,正确的是______。| A.微粒半径:③>①>② | B.电子排布属于基态原子(或离子)的是:①② |
| C.电离一个电子所需最低能量:①>②>③ | D.得电子能力:①>② |
您最近一年使用:0次
名校
7 . 完成下列问题。
(1) 属于二元酸,写出它与KOH反应生成酸式盐的化学方程式
属于二元酸,写出它与KOH反应生成酸式盐的化学方程式________ 。
(2) 与
与 溶液反应生成的酸式盐只有一种,则
溶液反应生成的酸式盐只有一种,则 是
是____ 元酸;若反应生成正盐,则该正盐的化学式为________ ,其中磷原子的杂化方式为________ 。
(3)将6 g CH3COOH溶于水制成1 L溶液,此溶液的物质的量浓度为_________ ,若此温度下醋酸的电离常数K=1×10−5,pH为_____ ,若升高温度, K将______ (填“变大”、“变小”或“不变”)。
(4)已知常温下,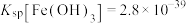 ;
;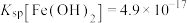 。向1L含
。向1L含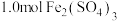 和
和 的酸性溶液中加碱至溶液
的酸性溶液中加碱至溶液 ,溶液体积无变化,所得溶液中
,溶液体积无变化,所得溶液中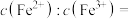
______ 。
(5)“84”消毒液是一种以NaClO为主要成分的高效消毒剂,NaClO溶液呈______ 性(填“酸”“碱”或“中”),原因可用离子方程式表示为________ 。
(6)少量 通入到过量的NaClO溶液中发生反应的离子方程式
通入到过量的NaClO溶液中发生反应的离子方程式________ 。
(7)利用原电池装置证明了反应Ag++Fe2+=Ag+Fe3+能够发生,其中石墨为_____ 极,负极溶液是______ ,证明反应Ag++Fe2+=Ag+Fe3+能够发生的实验操作及现象是________ 。
(1)
 属于二元酸,写出它与KOH反应生成酸式盐的化学方程式
属于二元酸,写出它与KOH反应生成酸式盐的化学方程式(2)
 与
与 溶液反应生成的酸式盐只有一种,则
溶液反应生成的酸式盐只有一种,则 是
是(3)将6 g CH3COOH溶于水制成1 L溶液,此溶液的物质的量浓度为
(4)已知常温下,
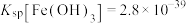 ;
;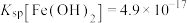 。向1L含
。向1L含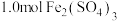 和
和 的酸性溶液中加碱至溶液
的酸性溶液中加碱至溶液 ,溶液体积无变化,所得溶液中
,溶液体积无变化,所得溶液中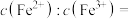
(5)“84”消毒液是一种以NaClO为主要成分的高效消毒剂,NaClO溶液呈
(6)少量
 通入到过量的NaClO溶液中发生反应的离子方程式
通入到过量的NaClO溶液中发生反应的离子方程式(7)利用原电池装置证明了反应Ag++Fe2+=Ag+Fe3+能够发生,其中石墨为
您最近一年使用:0次
名校
解题方法
8 . X、Y、Z、Q、R是位于同一短周期的元素,且原子序数递增,它们组成的化合物结构如图所示,X、R的最外层电子数之和等于Q的核电荷数。下列叙述中正确的是


| A.简单离子半径:X<Q<R,青蒿素结构如上右图,该分子中包含9个手性碳原子 |
B.化合物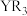 中各原子最外层均满足8电子稳定结构 中各原子最外层均满足8电子稳定结构 |
C.四氟肼N2F4电子式: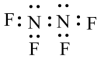 ,水在结冰时体积膨胀,是水分子间存在氢键 ,水在结冰时体积膨胀,是水分子间存在氢键 |
| D.该化合物的阴离子中所有原子均满足8电子稳定结构 |
您最近一年使用:0次
名校
解题方法
9 . 下列实验操作、现象及结论均正确的是
| 选项 | 操作和现象 | 结论 |
| A | 常温下,用pH计分别测定等体积 溶液和 溶液和 溶液的pH,pH均为7 溶液的pH,pH均为7 | 两种 中水的电离程度相同 中水的电离程度相同 |
| B | 向2mL KI溶液中滴加2mL KI溶液中滴加2mL 的 的 溶液,充分反应后加入2mL 溶液,充分反应后加入2mL ,取上层溶液滴加KSCN溶液,溶液变红色 ,取上层溶液滴加KSCN溶液,溶液变红色 |  与KI反应存在限度 与KI反应存在限度 |
| C | 向溶有 的 的 溶液中通入气体X,出现白色沉淀,向 溶液中通入气体X,出现白色沉淀,向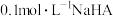 溶液中滴加酚酞,溶液变为浅红色 溶液中滴加酚酞,溶液变为浅红色 | X有强氧性,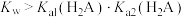 |
| D | 向2mL  溶液中滴入3滴 溶液中滴入3滴 NaOH溶液,再滴入4滴 NaOH溶液,再滴入4滴  溶液,先产生白色沉淀,后产生红褐色沉淀 溶液,先产生白色沉淀,后产生红褐色沉淀 | 同温度下的 : :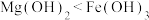 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
10 . 下表为元素周期表中短周期的一部分,A—G代表6种短周期元素。
已知C与氢元素能组成生活中最常见的化合物W。请填写下列空白。
(1)写出A元素的两种核素___________ (用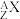 形式表示);
形式表示);
(2)与D同主族的下一周期元素的简单离子的结构示意图___________ ;
(3)G的单质与W反应的离子方程式为___________ ;
(4)B元素与氢元素组成含有10个电子和18个电子的分子的化学式分别为___________ ;
(5)A、B、C非金属性由强到弱的顺序为___________ (用元素符号表示);理由是___________ ;
(6)设计能说明E、F的金属性或非金属性强弱的实验___________ 。
| A | B | C | ||||
| D | E | F | G |
(1)写出A元素的两种核素
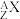 形式表示);
形式表示);(2)与D同主族的下一周期元素的简单离子的结构示意图
(3)G的单质与W反应的离子方程式为
(4)B元素与氢元素组成含有10个电子和18个电子的分子的化学式分别为
(5)A、B、C非金属性由强到弱的顺序为
(6)设计能说明E、F的金属性或非金属性强弱的实验
您最近一年使用:0次



