完成下列问题。
(1)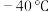 时,
时, 与冰反应生成
与冰反应生成 利
利 。常温常压下,
。常温常压下, 为无色气体,固态
为无色气体,固态 的晶体类型为
的晶体类型为________ , 水解反应的产物为
水解反应的产物为_____ (填化学式)。
(2) 中心原子为
中心原子为 ,
, 中心原子为
中心原子为 ,二者均为
,二者均为 形结构,但
形结构,但 中存在大
中存在大 键(
键( )。
)。 中
中 原子的轨道杂化方式
原子的轨道杂化方式____ ;为 键角
键角____  键角(填“>”“ <”或“=”)。比较
键角(填“>”“ <”或“=”)。比较 与
与 中
中 键的键长并说明原因
键的键长并说明原因_____ 。
(3)由硅原子核形成的三种微粒,电子排布式分别为:① 、②
、②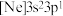 、③
、③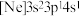 ,有关这些微粒的叙述,正确的是______。
,有关这些微粒的叙述,正确的是______。
(1)
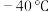 时,
时, 与冰反应生成
与冰反应生成 利
利 。常温常压下,
。常温常压下, 为无色气体,固态
为无色气体,固态 的晶体类型为
的晶体类型为 水解反应的产物为
水解反应的产物为(2)
 中心原子为
中心原子为 ,
, 中心原子为
中心原子为 ,二者均为
,二者均为 形结构,但
形结构,但 中存在大
中存在大 键(
键( )。
)。 中
中 原子的轨道杂化方式
原子的轨道杂化方式 键角
键角 键角(填“>”“ <”或“=”)。比较
键角(填“>”“ <”或“=”)。比较 与
与 中
中 键的键长并说明原因
键的键长并说明原因(3)由硅原子核形成的三种微粒,电子排布式分别为:①
 、②
、②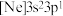 、③
、③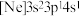 ,有关这些微粒的叙述,正确的是______。
,有关这些微粒的叙述,正确的是______。| A.微粒半径:③>①>② | B.电子排布属于基态原子(或离子)的是:①② |
| C.电离一个电子所需最低能量:①>②>③ | D.得电子能力:①>② |
更新时间:2024-02-02 11:05:13
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】前四周期的A、B、C、D四种元素在周期表中均与元素X紧密相邻.已知元素X最高价氧化物的化学式为X2O5,B、D同主族且B元素的原子半径是同族元素中最小的,C的最高价氧化物对应的水化物是强酸.
(1)D元素基态原子的电子排布式为____________ .
(2)A、C、X三种元素原子的第一电离能由大到小的顺序为_______________ (用相应的元素符号作答).
(3)B、X、D氢化物的沸点由高到低的顺序为_______________ (用相应的化学式作答).
(4)E元素是A元素所在周期中电负性最大的,试推测下列微粒的立体构型:
(5)元素B的一种氢化物B2H4具有重要的用途.有关B2H4的说法正确的是____________ .
A.B2H4分子间可形成氢键 B.B原子是sp3杂化
C.B2H4分子中含有5个σ键和1个π键 D.B2H4晶体变为液态时破坏共价键
(6)F元素基态原子M层上有5对成对电子,F形成的单质有δ、γ、α三种同素异形体,三种晶胞(如图所示)中F原子的配位数之比为____________ ,δ、γ、α三种晶胞的边长之比为____________ 。

(1)D元素基态原子的电子排布式为
(2)A、C、X三种元素原子的第一电离能由大到小的顺序为
(3)B、X、D氢化物的沸点由高到低的顺序为
(4)E元素是A元素所在周期中电负性最大的,试推测下列微粒的立体构型:
| 微粒 | EO2﹣ | EO3﹣ |
| 立体构型名称 |
(5)元素B的一种氢化物B2H4具有重要的用途.有关B2H4的说法正确的是
A.B2H4分子间可形成氢键 B.B原子是sp3杂化
C.B2H4分子中含有5个σ键和1个π键 D.B2H4晶体变为液态时破坏共价键
(6)F元素基态原子M层上有5对成对电子,F形成的单质有δ、γ、α三种同素异形体,三种晶胞(如图所示)中F原子的配位数之比为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】下表为长式周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1) 元素⑩的基态原子的价电子排布式为_________________ 。
(2) 元素②的一种氢化物(分子中含有6个原子) 是重要的化工原料,常把该氢化物的产 量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是________ 。
A.分子中含有分子间的氢键
B.属于含有极性键的非极性分子
C.只含有4个sp'-s的δ键和1个P-P的π键
D.该氢化物分子中②原子采用sp2杂化
(3)下图所示为血红蛋白和肌红蛋白的活性部分(血红素) 的结构式。此结构片段中含有的化学键有________ (填序号)。

A.离子键 B.金属键 C.极性键 D.非极性键 E.配位键 F.氢键G. δ键 H.Π键
(4)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据。

请回答:表中的金属元素是______ (填字母);若A、B、C为原子序数依次增大的同周期相邻元素,表中显示B比A和C 的第一电离能都略大,其原因是__________ 。

请回答下列问题:
(1) 元素⑩的基态原子的价电子排布式为
(2) 元素②的一种氢化物(分子中含有6个原子) 是重要的化工原料,常把该氢化物的产 量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是
A.分子中含有分子间的氢键
B.属于含有极性键的非极性分子
C.只含有4个sp'-s的δ键和1个P-P的π键
D.该氢化物分子中②原子采用sp2杂化
(3)下图所示为血红蛋白和肌红蛋白的活性部分(血红素) 的结构式。此结构片段中含有的化学键有

A.离子键 B.金属键 C.极性键 D.非极性键 E.配位键 F.氢键G. δ键 H.Π键
(4)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据。

请回答:表中的金属元素是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】铝、钛的合金及其化合物用途非常广泛,回答下列问题:
(1)Al65Cu20Co15是一种准晶体,准晶体是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过___ 方法区分晶体、准晶体和非晶体。
(2)基态Al原子价电子排布式为____ ,铝的第一电离能比镁的低,是因为____ 。
(3)AlF3的熔点(1040℃)比AlCl3(194℃)高得多,这是因为____ ;气态时,氯化铝以双聚体的形式存在,画出Al2Cl6的结构:____ 。
(4)TiO2+检验反应为TiO2++H2O2=[TiO(H2O2)]2+(橙红色),配离子[TiO(H2O2)]2+中与中心原子形成配位键的原子是__ ;H2O2中氧原子的杂化方式是___ ,H2O2的沸点(158℃)比键合方式相同的S2Cl2(138℃)的高,其原因是____ 。
(5)铝钛合金可用作磁控溅射镀膜的原材料,它的晶体结构及晶胞参数如图所示(Ti、Al位于面心或顶点)。阿伏加 德罗常数的值为NA,则该铝钛合金的密度为__ g·cm-3(列出表达式)。

(1)Al65Cu20Co15是一种准晶体,准晶体是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过
(2)基态Al原子价电子排布式为
(3)AlF3的熔点(1040℃)比AlCl3(194℃)高得多,这是因为
(4)TiO2+检验反应为TiO2++H2O2=[TiO(H2O2)]2+(橙红色),配离子[TiO(H2O2)]2+中与中心原子形成配位键的原子是
(5)铝钛合金可用作磁控溅射镀膜的原材料,它的晶体结构及晶胞参数如图所示(Ti、Al位于面心或顶点)。阿伏加 德罗常数的值为NA,则该铝钛合金的密度为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】氟在已知元素中电负性最大,被同学们称为“最牛”非金属元素。回答下列问题:
(1)基态F原子的核外电子排布式是________ ,其电子在原子核外的空间运动状态是______ 种。
(2)氟氧化物O2F2、OF2的结构已经确定。
①O2F2是___________ (填“极性”或“非极性”)分子。
②依据下表数据推测O—O键的稳定性:O2F2___________ H2O2(填“>”或“<”)。
③OF2中F-O-F的键角___________ (填“>”或“<”)H2O中H-O-H的键角。
(3)HF是一种有特殊性质的氢化物。
①已知:氢键(X—H…Y)中三原子在一条直线上时,作用力最强。测定结果表明, 固体中HF分子排列成锯齿形。画出含3个HF的重复单元结构:
固体中HF分子排列成锯齿形。画出含3个HF的重复单元结构:___________ 。
②HF中加入BF3可以解离出H2F+和具有正四面体形结构的阴离子,写出解离过程的离子方程式:___________ 。
(1)基态F原子的核外电子排布式是
(2)氟氧化物O2F2、OF2的结构已经确定。
①O2F2是
②依据下表数据推测O—O键的稳定性:O2F2
| O2F2 | H2O2 | |
| O—O键长/pm | 121 | 148 |
(3)HF是一种有特殊性质的氢化物。
①已知:氢键(X—H…Y)中三原子在一条直线上时,作用力最强。测定结果表明,
 固体中HF分子排列成锯齿形。画出含3个HF的重复单元结构:
固体中HF分子排列成锯齿形。画出含3个HF的重复单元结构:②HF中加入BF3可以解离出H2F+和具有正四面体形结构的阴离子,写出解离过程的离子方程式:
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】B、N、O、Fe、Co、Zn等元素及其化合物是生活和工业的重要材料。
(1)上述6种元素在元素周期表中位于ds区的元素有__ 。(填元素符号)
(2)原子中运动电子有两种相反的自旋状态,若一种自旋状态用+ 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态锌原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态锌原子,其价电子自旋磁量子数的代数和为___ 。
(3)自然界中不存在单质硼,主要存在的是硼的氧化物,从键能角度分析其原因是___ 。
(4)肼(N2H4)可视为NH3分子中的一个氢原子被—NH2取代形成的。肼可用作火箭燃料,其燃烧反应是:N2O4+2N2H4=3N2+4H2O,若该反应中生成3molπ键,则断裂的N—H键有__ mol。
(5)量子化学计算预测未知化合物是现代化学的发展途径之一,有人通过计算预言铁存在四氧化物,分子构型是四面体,但该分子中铁为+6价而不是+8价,该分子中铁的价电子排布式为__ ,该分子中氧的化合价有__ ,该分子的结构示意图为___ 。
(6)钴(Co)可形成分子式为Co(NH3)5BrSO4的两种配合物,其中一种的化学式为[Co(NH3)5BrSO4],往其溶液中加BaCl2溶液时,产生白色沉淀;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为__ 。
(1)上述6种元素在元素周期表中位于ds区的元素有
(2)原子中运动电子有两种相反的自旋状态,若一种自旋状态用+
 表示,与之相反的用-
表示,与之相反的用- 表示,称为电子的自旋磁量子数。对于基态锌原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态锌原子,其价电子自旋磁量子数的代数和为(3)自然界中不存在单质硼,主要存在的是硼的氧化物,从键能角度分析其原因是
(4)肼(N2H4)可视为NH3分子中的一个氢原子被—NH2取代形成的。肼可用作火箭燃料,其燃烧反应是:N2O4+2N2H4=3N2+4H2O,若该反应中生成3molπ键,则断裂的N—H键有
(5)量子化学计算预测未知化合物是现代化学的发展途径之一,有人通过计算预言铁存在四氧化物,分子构型是四面体,但该分子中铁为+6价而不是+8价,该分子中铁的价电子排布式为
(6)钴(Co)可形成分子式为Co(NH3)5BrSO4的两种配合物,其中一种的化学式为[Co(NH3)5BrSO4],往其溶液中加BaCl2溶液时,产生白色沉淀;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】重铬酸钾( ),室温下为橘红色结晶性粉末,溶于水,不溶于乙醇。实验室以铬铁矿(主要成分为
),室温下为橘红色结晶性粉末,溶于水,不溶于乙醇。实验室以铬铁矿(主要成分为 ,还含有硅、铝等杂质)为原料,利用固体碱熔氧化法制备
,还含有硅、铝等杂质)为原料,利用固体碱熔氧化法制备 的步骤如下:
的步骤如下:
步骤I.熔融氧化
将6g铬铁矿与4g氯酸钾在研钵中混合均匀,取碳酸钠和氢氧化钠各4.5g于仪器A中混匀后,小火熔融,再将矿粉分批加入坩埚中并不断搅拌。用煤气灯强热,灼烧30~35min,稍冷几分钟,加水,过滤,得滤液i,滤渣中含红棕色固体。
步骤Ⅱ.中和除杂
将滤液i用稀硫酸调pH为7~8,加热煮沸3min后,趁热过滤,用少量蒸馏水洗涤残渣,得滤液ii。
步骤Ⅲ.结晶
将滤液ii转移至蒸发皿中,用6 硫酸调pH后加入1g氯化钾,在水浴上浓缩至表面有晶膜为止,冷却结晶,过滤得重铬酸钾晶体,烘干,称量。
硫酸调pH后加入1g氯化钾,在水浴上浓缩至表面有晶膜为止,冷却结晶,过滤得重铬酸钾晶体,烘干,称量。
步骤Ⅳ.纯度测定
利用库仑滴定法测定 固体样品的纯度:取mg样品,配成250mL溶液,取2mL溶液进行库仑法滴定,重复三次实验,测定平均电量(Q)为1.158C,已知计算
固体样品的纯度:取mg样品,配成250mL溶液,取2mL溶液进行库仑法滴定,重复三次实验,测定平均电量(Q)为1.158C,已知计算 的浓度公式为
的浓度公式为 (F为96500
(F为96500 ,N为1个
,N为1个 转化为
转化为 时转移的电子数,V为滴定样品溶液的体积)。已知:常见微粒在不同pH条件下的存在形式如下图所示。当离子浓度
时转移的电子数,V为滴定样品溶液的体积)。已知:常见微粒在不同pH条件下的存在形式如下图所示。当离子浓度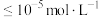 ,则认为该微粒已除尽。
,则认为该微粒已除尽。

回答下列问题:
(1)仪器A为_______(填标号)。
(2)若用 代替
代替 ,则理论上转化1mol
,则理论上转化1mol  所需
所需 的体积(标准状况,单位为L)是所消耗
的体积(标准状况,单位为L)是所消耗 物质的量的
物质的量的_______ 倍。
(3)步骤I中“分批加入”的目的是_______ 。
(4)若步骤Ⅱ中“调pH至3~4”的不良后果是_______ 。
(5)进一步提纯步骤Ⅲ所得晶体的方法是_______ 。
(6)探究pH对 溶液的氧化性强弱的影响。
溶液的氧化性强弱的影响。
(7) 与浓盐酸反应可制得
与浓盐酸反应可制得 ,已知部分卤素单质的键能如下表:
,已知部分卤素单质的键能如下表:
试解释键能 的原因
的原因_______ 。
(8) 固体样品的纯度为
固体样品的纯度为_______ (用含m的式子表示)。
 ),室温下为橘红色结晶性粉末,溶于水,不溶于乙醇。实验室以铬铁矿(主要成分为
),室温下为橘红色结晶性粉末,溶于水,不溶于乙醇。实验室以铬铁矿(主要成分为 ,还含有硅、铝等杂质)为原料,利用固体碱熔氧化法制备
,还含有硅、铝等杂质)为原料,利用固体碱熔氧化法制备 的步骤如下:
的步骤如下:步骤I.熔融氧化
将6g铬铁矿与4g氯酸钾在研钵中混合均匀,取碳酸钠和氢氧化钠各4.5g于仪器A中混匀后,小火熔融,再将矿粉分批加入坩埚中并不断搅拌。用煤气灯强热,灼烧30~35min,稍冷几分钟,加水,过滤,得滤液i,滤渣中含红棕色固体。
步骤Ⅱ.中和除杂
将滤液i用稀硫酸调pH为7~8,加热煮沸3min后,趁热过滤,用少量蒸馏水洗涤残渣,得滤液ii。
步骤Ⅲ.结晶
将滤液ii转移至蒸发皿中,用6
 硫酸调pH后加入1g氯化钾,在水浴上浓缩至表面有晶膜为止,冷却结晶,过滤得重铬酸钾晶体,烘干,称量。
硫酸调pH后加入1g氯化钾,在水浴上浓缩至表面有晶膜为止,冷却结晶,过滤得重铬酸钾晶体,烘干,称量。步骤Ⅳ.纯度测定
利用库仑滴定法测定
 固体样品的纯度:取mg样品,配成250mL溶液,取2mL溶液进行库仑法滴定,重复三次实验,测定平均电量(Q)为1.158C,已知计算
固体样品的纯度:取mg样品,配成250mL溶液,取2mL溶液进行库仑法滴定,重复三次实验,测定平均电量(Q)为1.158C,已知计算 的浓度公式为
的浓度公式为 (F为96500
(F为96500 ,N为1个
,N为1个 转化为
转化为 时转移的电子数,V为滴定样品溶液的体积)。已知:常见微粒在不同pH条件下的存在形式如下图所示。当离子浓度
时转移的电子数,V为滴定样品溶液的体积)。已知:常见微粒在不同pH条件下的存在形式如下图所示。当离子浓度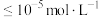 ,则认为该微粒已除尽。
,则认为该微粒已除尽。
回答下列问题:
(1)仪器A为_______(填标号)。
| A.普通坩埚 | B. 坩埚 坩埚 | C.氮化硅坩埚 | D.石英坩埚 |
 代替
代替 ,则理论上转化1mol
,则理论上转化1mol  所需
所需 的体积(标准状况,单位为L)是所消耗
的体积(标准状况,单位为L)是所消耗 物质的量的
物质的量的(3)步骤I中“分批加入”的目的是
(4)若步骤Ⅱ中“调pH至3~4”的不良后果是
(5)进一步提纯步骤Ⅲ所得晶体的方法是
(6)探究pH对
 溶液的氧化性强弱的影响。
溶液的氧化性强弱的影响。| 实验操作 | 实验现象 | 实验结论 |
向酸化的 溶液中加入一定量甲醇 溶液中加入一定量甲醇 | 溶液形成蓝紫色溶液,并产生无色无味的气体 | |
向碱化的 溶液中加入相同量甲醇 溶液中加入相同量甲醇 | 酸性条件下 溶液的氧化性更强 溶液的氧化性更强 |
 与浓盐酸反应可制得
与浓盐酸反应可制得 ,已知部分卤素单质的键能如下表:
,已知部分卤素单质的键能如下表:| 化学键 | F-F | C1-Cl | Br-Br |
键能/( ) ) | 157 | 242.7 | 193.7 |
 的原因
的原因(8)
 固体样品的纯度为
固体样品的纯度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】B、N、F、Ti、Fe等都是重要的材料元素,其单质及化合物在诸多领域都有广泛的应用。
(1)在基态Ti原子中,核外存在________ 对自旋相反的电子,核外电子中占据的最高能层符号为___ ,占据该能层电子的电子云轮廓图形状为_________ 。
(2)南京理工大学团队成功合成了能在室温稳定存在的五氮阴离子盐(N5)6(H3O)3(NH4)4Cl,五氮阴离子N5-是制备全氮类物质N5+N5-的重要中间体,下列说法不正确的是_________ 。
A. (N5)6(H3O)3(NH4)4Cl中含四种离子 B. N5+N5-属于共价化合物
C. 每个N5-中含有36个电子 D. N5+N5-中既含极性键又含非极性键
(3)NH3分子空间结构为_______ ;在 BF3中B原子的杂化方式为______ 。
(4)六氟合钛酸钾(K2TiF6)中存在[TiF6]2-离子,则钛元素的化合价是______ ,配体是_____ 。
(5)碳酸盐的热分解是由于晶体中阳离子结合碳酸根离子中的氧离子,使碳酸根离子分解为二氧化碳分子的结果。已知
请解释碱土金属元素碳酸盐热分解温度的变化规律:____________ 。
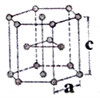
(6)金属钛有两种同素异形体,常温下是六方堆积,高温下是体心立方堆积。如图所示是钛晶体的一种晶胞,晶胞参数a = 0.295nm,c=0.469nm,则该钛晶体的密度为______ g/cm3(用NA表示阿伏伽德罗常数的值,列出计算式即可)。
(1)在基态Ti原子中,核外存在
(2)南京理工大学团队成功合成了能在室温稳定存在的五氮阴离子盐(N5)6(H3O)3(NH4)4Cl,五氮阴离子N5-是制备全氮类物质N5+N5-的重要中间体,下列说法不正确的是
A. (N5)6(H3O)3(NH4)4Cl中含四种离子 B. N5+N5-属于共价化合物
C. 每个N5-中含有36个电子 D. N5+N5-中既含极性键又含非极性键
(3)NH3分子空间结构为
(4)六氟合钛酸钾(K2TiF6)中存在[TiF6]2-离子,则钛元素的化合价是
(5)碳酸盐的热分解是由于晶体中阳离子结合碳酸根离子中的氧离子,使碳酸根离子分解为二氧化碳分子的结果。已知
| 碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
| 热分解温度/℃ | 402 | 900 | 1172 | 1360 |
| 阳离子半径/ pm | 66 | 99 | 112 | 135 |
请解释碱土金属元素碳酸盐热分解温度的变化规律:
(6)金属钛有两种同素异形体,常温下是六方堆积,高温下是体心立方堆积。如图所示是钛晶体的一种晶胞,晶胞参数a = 0.295nm,c=0.469nm,则该钛晶体的密度为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)基态Ga原子的核外电子排布式为[Ar]________ 。
(2)根据元素周期律,元素的电负性Ga________ (填“大于”或“小于”,下同)As,第一电离能B________ Ga;BF3和NH3的分子能够通过配位键相结合的原因是_______________________ 。
(3)杀虫剂Na3AsO4中阴离子的空间构型为________ ,As原子采取________ 杂化。
(4)组成相似的GaF3和GaCl3晶体,前者属于离子晶体,后者属于分子晶体,从F-和Cl-结构的不同分析其原因是_____________ 。
(5)原子晶体GaAs的晶胞参数a=x pm,它的晶胞结构如下图所示。该晶胞内部存在的共价键数为________ ;A原子距离B原子所在六面体的侧面的最短距离为________ (用x表示)pm;该晶体的密度为________ g·cm-3(阿伏伽德罗常数的值用NA表示)
 。
。
(1)基态Ga原子的核外电子排布式为[Ar]
(2)根据元素周期律,元素的电负性Ga
(3)杀虫剂Na3AsO4中阴离子的空间构型为
(4)组成相似的GaF3和GaCl3晶体,前者属于离子晶体,后者属于分子晶体,从F-和Cl-结构的不同分析其原因是
(5)原子晶体GaAs的晶胞参数a=x pm,它的晶胞结构如下图所示。该晶胞内部存在的共价键数为
 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】铬是人体必需的微量元素,对维持人体正常的生理功能有着重要的作用。铬是胰岛素不可缺少的辅助成分,它参与糖代谢过程,能够促进脂肪和蛋白质的合成,对于人体的生长发育起着积极的促进作用。虽然铬对维护人体健康有着十分重要的作用,但食用不当也会带来很大的危害。由于无机铬很不容易被人体所吸收,铬只有以有机化合物的形式进入人体内才能被吸收。而在铬的化合物中,六价铬具有很强的毒性,尤以铬酸盐和重铬酸盐的毒性最为突出。
(1)铬原子的基态电子排布式为_______ 。
(2)氯化铬酰(CrO2Cl2)常温下为暗红色液体,熔点-96.5℃、沸点117℃,能与丙酮(CH3COCH3)、CCl4、CS2等互溶。
①丙酮中碳原子采取的杂化方式为_______ ;
②CS2属于_______ (填极性”或“非极性”)分子,其电子式为_______ ;
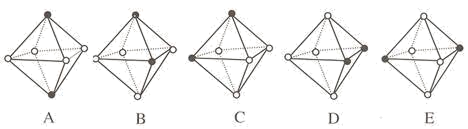
(3)CrCl3·6H2O(相对分子质量为266.5)有多种不同颜色的异构体(均是配合物,配位数为6)。为测定蒸发CrCl3溶液析出的暗绿色晶体是哪种异构体,取2.665gCrCl3·6H2O配成溶液,滴加足量AgNO3溶液,得到沉淀1.435g。该异构体为_______ (填化学式)。下列是暗绿色晶体配离子的空间结构(中心原子位于正八面体的中心,已省去),其中B与_______ 具有完全相同的结构。(填字母)
(4)六价铬的化合物有剧毒,所以要对Cr(VI)(罗马数字表示元素的化合价,下同)废水进行化学处理,使其转化为毒性较低的Cr(III)。最常见的是铁氧磁体法,即把FeSO4·7H2O加入含Cr(VI)的废水中,在pH<4时,Fe2+将Cr(VI)还原为Cr(III),调节溶液pH达8~10,使溶液中的Fe(II)、Fe(III)、Cr(III)析出组成相当于Fe(II)[Fex(III)·Cr2-x(III)]O4(磁性材料铁氧体的组成)沉淀。试回答:
①若废水中六价铬以Cr2O 存在。试写出在酸性条件下硫酸亚铁还原Cr2O
存在。试写出在酸性条件下硫酸亚铁还原Cr2O 的离子方程式并配平
的离子方程式并配平_______ 。
②根据上述结果可确定铁氧磁体中x=_______ 。
(1)铬原子的基态电子排布式为
(2)氯化铬酰(CrO2Cl2)常温下为暗红色液体,熔点-96.5℃、沸点117℃,能与丙酮(CH3COCH3)、CCl4、CS2等互溶。
①丙酮中碳原子采取的杂化方式为
②CS2属于
(3)CrCl3·6H2O(相对分子质量为266.5)有多种不同颜色的异构体(均是配合物,配位数为6)。为测定蒸发CrCl3溶液析出的暗绿色晶体是哪种异构体,取2.665gCrCl3·6H2O配成溶液,滴加足量AgNO3溶液,得到沉淀1.435g。该异构体为

(4)六价铬的化合物有剧毒,所以要对Cr(VI)(罗马数字表示元素的化合价,下同)废水进行化学处理,使其转化为毒性较低的Cr(III)。最常见的是铁氧磁体法,即把FeSO4·7H2O加入含Cr(VI)的废水中,在pH<4时,Fe2+将Cr(VI)还原为Cr(III),调节溶液pH达8~10,使溶液中的Fe(II)、Fe(III)、Cr(III)析出组成相当于Fe(II)[Fex(III)·Cr2-x(III)]O4(磁性材料铁氧体的组成)沉淀。试回答:
①若废水中六价铬以Cr2O
 存在。试写出在酸性条件下硫酸亚铁还原Cr2O
存在。试写出在酸性条件下硫酸亚铁还原Cr2O 的离子方程式并配平
的离子方程式并配平②根据上述结果可确定铁氧磁体中x=
您最近一年使用:0次
【推荐1】(1)在①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,⑦(NH4)2SO4,⑧乙醇中,由极性键形成的非极性分子有_______ (填序号,以下同),含有金属离子的物质是__ ,分子间可形成氢键的物质是________ ,属于离子晶体的是__ ,属于原子晶体的是__ ,①~⑤五种物质的熔点由高到低的顺序是__ 。
(2)A,B,C,D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3500 ℃
试推断它们的晶体类型:A.__ ;B.__ ;C.__ ;D.__ 。
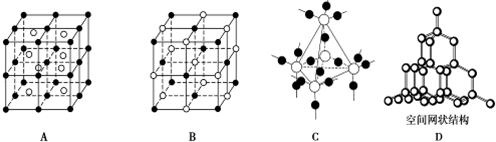
(3)下图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:A.__ ;B.__ ;C.__ D.____ 。
.
(2)A,B,C,D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3500 ℃
试推断它们的晶体类型:A.
(3)下图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:A.
.

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】Q、R、X、Y、Z五种元素的原子序数依次递增。已知:①Z的原子序数为29,其余的均为短周期主族元素;②Y原子价电子(外围电子)排布为msnmpn;③R原子核外L层电子数为奇数;④Q、X原子p轨道的电子数分别为2和4;请回答下列问题:
(1)Z2+的核外电子排布式是________ 。
(2)Q、R、Y三种元素的第一电离能数值由小至大的顺序为________ (用元素符号作答)。
(3)Q的一种氢化物相对分子质量为26,其分子中σ键与π键的键数之比为________ 。
(4)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于________ (填晶体类型)。
(1)Z2+的核外电子排布式是
(2)Q、R、Y三种元素的第一电离能数值由小至大的顺序为
(3)Q的一种氢化物相对分子质量为26,其分子中σ键与π键的键数之比为
(4)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐3】A、B、C、D是四种短周期元素,E是过渡元素.A、B、C同周期,C、D同主族,A的原子结构示意图为: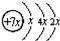 ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题:
(1)写出下列元素的符号:A_____ B_____ C_____ D_____
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是_____ ,碱性最强的是_____ .
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是_____ ,电负性最大的元素是_____ .
(4)D的氢化物比C的氢化物的沸点_____ (填“高“或“低“),原因_____
(5)E元素原子的核电荷数是_____ ,E元素在周期表的位置_____ .
(6)A、B、C最高价氧化物的晶体类型是分别是_____ 晶体、_____ 晶体、_____ 晶体
(7)画出D原子的核外电子轨道表示式_______________________ .
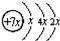 ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题:(1)写出下列元素的符号:A
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是
(4)D的氢化物比C的氢化物的沸点
(5)E元素原子的核电荷数是
(6)A、B、C最高价氧化物的晶体类型是分别是
(7)画出D原子的核外电子轨道表示式
您最近一年使用:0次



