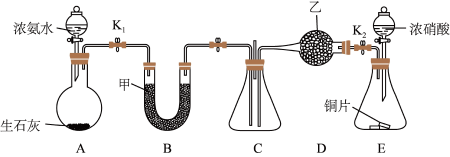
1 . 化学自主实验小组通过实验探究NH3、NO2的性质。
I.利用如图所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持固定装置略去)。___________ 。
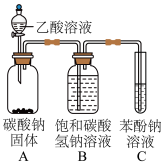
(2)甲、乙分别是___________ (填字母)。
a.浓硫酸、碱石灰 b.五氧化二磷、碱石灰
c.碱石灰、无水氯化钙 d.五氧化二磷、五氧化二磷
(3)若NO2能够被NH3还原,预期C装置中能观察到的现象是___________ 。
(4)此实验装置存在一个明显的缺陷是___________ 。
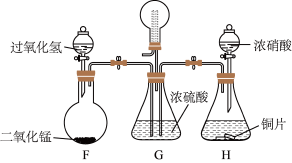
II.探究NO2、O2混合气体的喷泉实验。___________ (填字母)。
a.进气管短,出气管长 b.进气管长,出气管短 c.进气管、出气管等长
(6)G装置有多种作用,请任写出其中两种___________ 。
(7)常温常压下,G装置上的圆底烧瓶集满气体进行喷泉实验,若最终液体充满整个烧瓶,则所得溶液物质的量浓度为___________ mol·L-1(已知常温常压下气体摩尔体积为VL/mol)。
I.利用如图所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持固定装置略去)。
(2)甲、乙分别是
a.浓硫酸、碱石灰 b.五氧化二磷、碱石灰
c.碱石灰、无水氯化钙 d.五氧化二磷、五氧化二磷
(3)若NO2能够被NH3还原,预期C装置中能观察到的现象是
(4)此实验装置存在一个明显的缺陷是
II.探究NO2、O2混合气体的喷泉实验。
a.进气管短,出气管长 b.进气管长,出气管短 c.进气管、出气管等长
(6)G装置有多种作用,请任写出其中两种
(7)常温常压下,G装置上的圆底烧瓶集满气体进行喷泉实验,若最终液体充满整个烧瓶,则所得溶液物质的量浓度为
您最近一年使用:0次
2024-04-29更新
|
146次组卷
|
2卷引用:福建省福州九县(区、市)一中(高中)2023-2024学年高一下学期4月期中联考化学试题
2 . 兴趣小组查阅文献后,设计实验对苯酚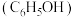 的性质进行探究,回答以下问题。
的性质进行探究,回答以下问题。
已知:ⅰ. 25℃,相关弱酸的电离平衡常数如下:Ka1(H2CO3)=4.2×10−7,Ka2(H2CO3)=5.6×10−11,Ka(C6H5OH)=1.3×10−10。
ⅱ.苯酚与 显色反应的化学方程式为:Fe3++6C6H5OH
显色反应的化学方程式为:Fe3++6C6H5OH [Fe(C6H5O)6]3−(紫色)+6H+。
[Fe(C6H5O)6]3−(紫色)+6H+。
Ⅰ.探究苯酚酸性的强弱
(1)苯酚的电离方程式为___________ 。
(2)兴趣小组按如图装置进行实验,证明酸性强弱顺序为CH3COOH>H2CO3> C6H5OH,所依据的实验现象为___________ ,C中反应的化学方程式为___________ 。
兴趣小组对以上实验的现象提出猜想。
猜想1: 对铁离子与苯酚的反应有促进作用。
对铁离子与苯酚的反应有促进作用。
猜想2: 对铁离子与苯酚的反应有抑制作用。
对铁离子与苯酚的反应有抑制作用。
(3)向实验1反应后溶液中继续加入 固体,若溶液颜色无变化,则可得出的结论是
固体,若溶液颜色无变化,则可得出的结论是___________ 。
(4)向实验1反应后溶液中加入___________ 固体(填化学式),若溶液颜色变为浅紫色,说明猜想2成立。
(5)兴趣小组同学提出猜想3:溶液的 会影响显色效果,并设计如下实验进行验证。
会影响显色效果,并设计如下实验进行验证。
①实验4中生成的红褐色沉淀是___________ (填化学式)。
②实验5中滴加盐酸至过量,溶液由紫色变为浅黄色,结合平衡移动原理解释原因___________ 。
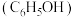 的性质进行探究,回答以下问题。
的性质进行探究,回答以下问题。已知:ⅰ. 25℃,相关弱酸的电离平衡常数如下:Ka1(H2CO3)=4.2×10−7,Ka2(H2CO3)=5.6×10−11,Ka(C6H5OH)=1.3×10−10。
ⅱ.苯酚与
 显色反应的化学方程式为:Fe3++6C6H5OH
显色反应的化学方程式为:Fe3++6C6H5OH [Fe(C6H5O)6]3−(紫色)+6H+。
[Fe(C6H5O)6]3−(紫色)+6H+。Ⅰ.探究苯酚酸性的强弱
(1)苯酚的电离方程式为
(2)兴趣小组按如图装置进行实验,证明酸性强弱顺序为CH3COOH>H2CO3> C6H5OH,所依据的实验现象为
| 实验1 | 实验2 |
|
|
猜想1:
 对铁离子与苯酚的反应有促进作用。
对铁离子与苯酚的反应有促进作用。猜想2:
 对铁离子与苯酚的反应有抑制作用。
对铁离子与苯酚的反应有抑制作用。(3)向实验1反应后溶液中继续加入
 固体,若溶液颜色无变化,则可得出的结论是
固体,若溶液颜色无变化,则可得出的结论是(4)向实验1反应后溶液中加入
(5)兴趣小组同学提出猜想3:溶液的
 会影响显色效果,并设计如下实验进行验证。
会影响显色效果,并设计如下实验进行验证。| 实验 | 操作 | 现象 |
| 3 | 向2mL苯酚溶液(调节 )中滴加0.1mol/LFeCl3溶液 )中滴加0.1mol/LFeCl3溶液 | 溶液显紫色 |
| 4 | 向2mL苯酚溶液(调节 )中滴加0.1mol/LFeCl3溶液 )中滴加0.1mol/LFeCl3溶液 | 生成红褐色沉淀 |
| 5 | 向实验4所得悬浊液中逐滴加入0.1mol/L盐酸至过量 | 沉淀逐渐溶解,溶液变为紫色;继续滴加盐酸,溶液由紫色变为浅黄色 |
②实验5中滴加盐酸至过量,溶液由紫色变为浅黄色,结合平衡移动原理解释原因
您最近一年使用:0次
2024-04-26更新
|
137次组卷
|
2卷引用:北京市北京大学附属中学2023-2024学年高二下学期期中考试化学试题
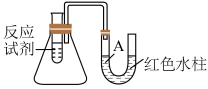
3 . 下图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应。___________ 。
(2)该反应是___________ (填“放热”或“吸热”)反应,结合实验现象写出判断依据___________ 。
(2)该反应是
您最近一年使用:0次
2024-04-25更新
|
51次组卷
|
2卷引用:上海市松江二中2023-2024学年高一下学期期中测试 化学试卷
22-23高一下·新疆阿克苏·期末
解题方法
4 . 实验室可用图中装置(略去部分夹持仪器)制取 并验证其性质。
并验证其性质。___________ ,装置A中发生反应的化学方程式为___________ 。
(2)仪器组装完成后,关闭两端活塞,向装置B的长颈漏斗内注入液体至形成一段液柱,若___________ ,则整个装置气密性良好。
(3)装置B的作用之一是通过观察产生气泡的多少判断 生成的快慢,其中的液体最好选择
生成的快慢,其中的液体最好选择___________ (填序号)。
a.蒸馏水 b.饱和 溶液 c.饱和
溶液 c.饱和 溶液 d.饱和
溶液 d.饱和 溶液
溶液
(4)C试管中的试剂可以验证二氧化硫的氧化性,现象为___________ 。
(5)为验证二氧化硫的还原性,充分反应后,取试管D中的溶液分成三份,分别进行实验:
方案I:向第一份溶液中加入 溶液,有白色沉淀生成;
溶液,有白色沉淀生成;
方案II:向第二份溶液中加入 溶液,有白色沉淀生成;
溶液,有白色沉淀生成;
方案III:向第三份溶液中加入 溶液,有产生白色沉淀。
溶液,有产生白色沉淀。
上述方案中合理的是方案___________ (填“I”“II”或“III”)。
 并验证其性质。
并验证其性质。
(2)仪器组装完成后,关闭两端活塞,向装置B的长颈漏斗内注入液体至形成一段液柱,若
(3)装置B的作用之一是通过观察产生气泡的多少判断
 生成的快慢,其中的液体最好选择
生成的快慢,其中的液体最好选择a.蒸馏水 b.饱和
 溶液 c.饱和
溶液 c.饱和 溶液 d.饱和
溶液 d.饱和 溶液
溶液(4)C试管中的试剂可以验证二氧化硫的氧化性,现象为
(5)为验证二氧化硫的还原性,充分反应后,取试管D中的溶液分成三份,分别进行实验:
方案I:向第一份溶液中加入
 溶液,有白色沉淀生成;
溶液,有白色沉淀生成;方案II:向第二份溶液中加入
 溶液,有白色沉淀生成;
溶液,有白色沉淀生成;方案III:向第三份溶液中加入
 溶液,有产生白色沉淀。
溶液,有产生白色沉淀。上述方案中合理的是方案
您最近一年使用:0次
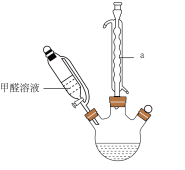
5 . 为探究甲醛与新制Cu(OH)2反应的产物,设计了如下实验。回答下列问题:
I.反应装置如下:
(1)仪器a的名称是___________ ,该反应需控制温度为65℃,宜采用的加热方式为___________ (填标号)。
A.酒精灯加热 B.砂浴 C.油浴 D.水浴
II.为探究气体产物、溶液中产物与固体产物的成分,小组同学经过讨论分析后,关于产物成分有如下猜想:
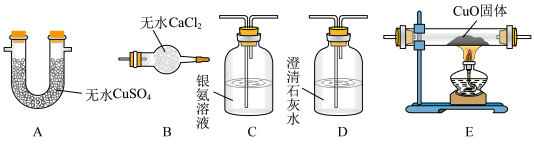
(2)为确定气体成分,下列实验装置的连接顺序是___________ ( 按气流方向填大写字母,个别装置可重复使用)。(已知:CO与银氨溶液能发生氧化还原反应)___________ 。
(3)为确定溶液中产物与固体产物,小组做了以下实验: (无色),Cu(NH3)
(无色),Cu(NH3) 易被氧化生成Cu(NH3)
易被氧化生成Cu(NH3) 。
。
①由实验现象可知,液体产物中存在离子是___________ (填离子符号)。
②滤渣1中加入足量浓氨水时,主要反应的离子方程式为___________ 。
③滤液2在空气中放置一段时间后,显蓝色的离子是___________ (填离子符号)。
④通过定量测定发现,固体产物主要是铜。综合以上分析,若主要还原产物的物质的量相等,甲醛与新制氢氧化铜发生的主要反应的化学方程式是___________ 。
I.反应装置如下:
(1)仪器a的名称是
A.酒精灯加热 B.砂浴 C.油浴 D.水浴
II.为探究气体产物、溶液中产物与固体产物的成分,小组同学经过讨论分析后,关于产物成分有如下猜想:
| 气体产物 | H2、CO、CO2 |
| 溶液中产物 | HCOO-、 |
| 固体产物 | Cu、Cu2O |
(3)为确定溶液中产物与固体产物,小组做了以下实验:
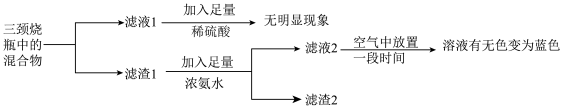
 (无色),Cu(NH3)
(无色),Cu(NH3) 易被氧化生成Cu(NH3)
易被氧化生成Cu(NH3) 。
。①由实验现象可知,液体产物中存在离子是
②滤渣1中加入足量浓氨水时,主要反应的离子方程式为
③滤液2在空气中放置一段时间后,显蓝色的离子是
④通过定量测定发现,固体产物主要是铜。综合以上分析,若主要还原产物的物质的量相等,甲醛与新制氢氧化铜发生的主要反应的化学方程式是
您最近一年使用:0次
2023-06-19更新
|
100次组卷
|
4卷引用:青海省西宁市大通回族土族自治县2023-2024学年高三上学期期中考试理综试题
名校
6 . 某食品膨松剂作用物质为NaHCO3,某兴趣小组研究加热情况下该膨松剂放出气体的量,设计实验的装置图如下。
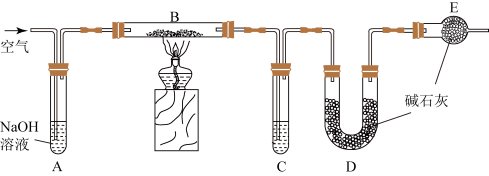
已知:碱石灰是固体氢氧化钠和氧化钙的混合物;2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
回答下列问题:
(1)A装置中NaOH溶液的作用是除去空气中的_______ ,C装置内所盛试剂是_______ ,E装置的作用是_______ ,若没有E装置,测定的结果_______ (填“偏高”、“偏低”或“无影响”);若没有A装置,B装置左侧用橡皮塞封闭,实验结果将_______ (填“偏高”、“偏低”或“无影响”)。
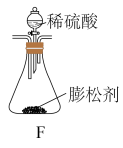
(2)充分加热后,测得D的质量增加6.6g,若装置B换为装置F进行实验(膨松剂质量相同)。不考虑导致误差因素,则测得D的质量增加_______ 。
(3)分解产物Na2CO3是重要化工原料,研究其性质:分别取少量NaCO3溶液,
①与碱反应:滴加澄清石灰水,现象为_______ ,
②与盐反应:滴加X溶液,产生白色沉淀,则X可能为_______ (写其中一种的名称)。
③与酸反应:滴加盐酸,开始没有气泡,反应产生两种盐,推测两种盐的化学式_______ ;
(4)取a克Na2CO3与NaHCO3混合物进行下列三组实验,其中能测定Na2CO3质量分数的是_______ (填序号)。
A.充分加热,质量减少b克
B.与足量稀盐酸充分反应,加热、蒸干,灼烧,得b克固体
C.与足量稀硫酸充分反应,逸出气体用氯化钙吸收,增重b克
任选上述合理方案中的一种,计算Na2CO3的质量分数为_______ 。


已知:碱石灰是固体氢氧化钠和氧化钙的混合物;2NaHCO3
 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑回答下列问题:
(1)A装置中NaOH溶液的作用是除去空气中的
(2)充分加热后,测得D的质量增加6.6g,若装置B换为装置F进行实验(膨松剂质量相同)。不考虑导致误差因素,则测得D的质量增加
(3)分解产物Na2CO3是重要化工原料,研究其性质:分别取少量NaCO3溶液,
①与碱反应:滴加澄清石灰水,现象为
②与盐反应:滴加X溶液,产生白色沉淀,则X可能为
③与酸反应:滴加盐酸,开始没有气泡,反应产生两种盐,推测两种盐的化学式
(4)取a克Na2CO3与NaHCO3混合物进行下列三组实验,其中能测定Na2CO3质量分数的是
A.充分加热,质量减少b克
B.与足量稀盐酸充分反应,加热、蒸干,灼烧,得b克固体
C.与足量稀硫酸充分反应,逸出气体用氯化钙吸收,增重b克
任选上述合理方案中的一种,计算Na2CO3的质量分数为
您最近一年使用:0次
2023-06-08更新
|
542次组卷
|
6卷引用:广东省惠州市实验中学2022-2023学年高一上学期期中考试化学试题
广东省惠州市实验中学2022-2023学年高一上学期期中考试化学试题(已下线)期中测试卷一【测试范围:第一、二章】-2023-2024学年高一化学上学期期中考点大串讲(人教版2019必修第一册)江西省南昌市第一中学2023-2024学年高一上学期11月期中考试化学试题四川省眉山市仁寿第一中学校南校区2023-2024学年高一上学期开学化学试题广东省佛山市南海区2022-2023学年高一上学期初高衔接学习素养测试化学试题浙江省东阳市横店高级中学2022-2023学年高一上学期10月份检测化学试题
名校
7 . 某小组利用一定浓度 溶液制备
溶液制备 ,再用
,再用 氧化
氧化 ,并检验氧化产物。
,并检验氧化产物。
Ⅰ.制备 。
。
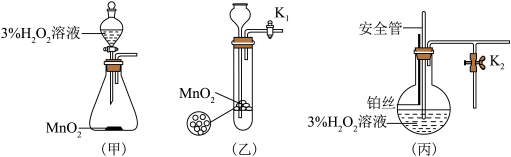
该小组同学设计了如下气体发生装置(夹持装置省略)___________ 。
(2)乙装置中,用粘合剂将 制成团,放在多孔塑料片上,连接好装置,气密性良好后打开活塞
制成团,放在多孔塑料片上,连接好装置,气密性良好后打开活塞 ,经长颈漏斗向试管中缓慢加入3%
,经长颈漏斗向试管中缓慢加入3% 溶液至
溶液至___________ ,欲使反应停止,关闭活塞 即可,此时装置中的现象是
即可,此时装置中的现象是___________ 。
(3)丙装置中盛装3% 溶液的仪器名称为
溶液的仪器名称为___________ 。丙装置可用于制备较多 ,催化剂铂丝可上下移动。制备过程中如果体系内压强过大,安全管中的现象是
,催化剂铂丝可上下移动。制备过程中如果体系内压强过大,安全管中的现象是___________ ,此时可以将铂丝抽离 溶液,还可以采取的安全措施是
溶液,还可以采取的安全措施是___________ 。
(4)丙装置的特点是___________ (填序号)。
a.可以控制制备反应的开始和结束
b.可通过调节催化剂与液体接触的面积来控制反应的速率
c.与乙装置相比,产物中的 含量高、杂质种类少
含量高、杂质种类少
Ⅱ.氧化 。
。
该小组同学设计的氧化 的装置如图(夹持装置省略)
的装置如图(夹持装置省略)___________ 。
②乙醇催化氧化的化学方程式为___________ 。
Ⅲ.检验产物
(6)为检验上述实验收集到的产物,该小组同学进行了如下实验并得出相应结论。
已知:a.乙醛的结构简式为 。
。
b.乙醛的官能团为醛基( ),常温下能使酸性
),常温下能使酸性 溶液褪色;加热条件下,能与新制
溶液褪色;加热条件下,能与新制 悬浊液反应生成砖红色沉淀(
悬浊液反应生成砖红色沉淀( )。
)。
实验①~③中的结论不合理的是___________ (填序号),原因是___________ 。
 溶液制备
溶液制备 ,再用
,再用 氧化
氧化 ,并检验氧化产物。
,并检验氧化产物。Ⅰ.制备
 。
。该小组同学设计了如下气体发生装置(夹持装置省略)
(2)乙装置中,用粘合剂将
 制成团,放在多孔塑料片上,连接好装置,气密性良好后打开活塞
制成团,放在多孔塑料片上,连接好装置,气密性良好后打开活塞 ,经长颈漏斗向试管中缓慢加入3%
,经长颈漏斗向试管中缓慢加入3% 溶液至
溶液至 即可,此时装置中的现象是
即可,此时装置中的现象是(3)丙装置中盛装3%
 溶液的仪器名称为
溶液的仪器名称为 ,催化剂铂丝可上下移动。制备过程中如果体系内压强过大,安全管中的现象是
,催化剂铂丝可上下移动。制备过程中如果体系内压强过大,安全管中的现象是 溶液,还可以采取的安全措施是
溶液,还可以采取的安全措施是(4)丙装置的特点是
a.可以控制制备反应的开始和结束
b.可通过调节催化剂与液体接触的面积来控制反应的速率
c.与乙装置相比,产物中的
 含量高、杂质种类少
含量高、杂质种类少Ⅱ.氧化
 。
。该小组同学设计的氧化
 的装置如图(夹持装置省略)
的装置如图(夹持装置省略)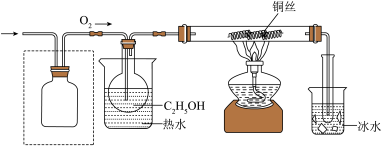
②乙醇催化氧化的化学方程式为
Ⅲ.检验产物
(6)为检验上述实验收集到的产物,该小组同学进行了如下实验并得出相应结论。
已知:a.乙醛的结构简式为
 。
。b.乙醛的官能团为醛基(
 ),常温下能使酸性
),常温下能使酸性 溶液褪色;加热条件下,能与新制
溶液褪色;加热条件下,能与新制 悬浊液反应生成砖红色沉淀(
悬浊液反应生成砖红色沉淀( )。
)。| 实验序号 | 检验试剂和反应条件 | 现象 | 结论 |
| ① | 酸性 溶液 溶液 | 紫色褪去 | 产物含有乙醛 |
| ② | 新制 悬浊液,加热 悬浊液,加热 | 生成砖红色沉淀 | 产物含有乙醛 |
| ③ | 微红色含酚酞的 溶液 溶液 | 微红色褪去 | 产物可能含有乙酸 |
您最近一年使用:0次
2023-06-01更新
|
139次组卷
|
2卷引用:吉林省长春市吉大附中实验学校2022-2023学年高一下学期期中考试化学试题
22-23高一下·全国·期中
8 . 二氧化硫的制备
(1)反应原理:_________ ,利用强酸制弱酸的原理制备SO2
(2)实验装置:
①气体发生装置类型:_________ [固液常温制取气体]
②发生装置所用仪器的名称为__________ 、____________
(3)在还原性探究实验中,发生反应:_________
(4)在氧化性探究实验中,发生反应:_________
(5)在漂白性探究实验中,品红溶液褪色,加热后________
(6)尾气处理:__________
(7)SO2密度比空气大,在水中溶解度较大,选择________ 法收集
(8)思考探究:除去酸性气体中HCl的方法?_________
| 发生装置(原理) | 性质探究 | 尾气处理 |
 | ||
(2)实验装置:
①气体发生装置类型:
②发生装置所用仪器的名称为
(3)在还原性探究实验中,发生反应:
(4)在氧化性探究实验中,发生反应:
(5)在漂白性探究实验中,品红溶液褪色,加热后
(6)尾气处理:
(7)SO2密度比空气大,在水中溶解度较大,选择
(8)思考探究:除去酸性气体中HCl的方法?
您最近一年使用:0次
22-23高一上·四川广安·期末
9 . 化学小组同学为研究氯气制备和氯水的成分及性质进行了如下实验。
【实验1】制备氯气。下图是实验室制取纯净、干燥氯气装置图。
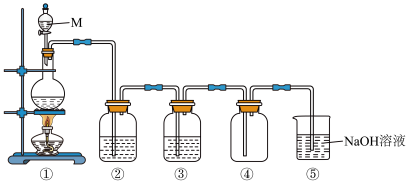
(1)M仪器的名称是___________ ,①中反应的反应的化学方程式是___________ 。
(2)③中存放的试剂是___________ 。
(3)⑤中反应的离子方程式是___________ 。
【实验2】研究氯水性质。实验操作及现象如下表。
资料:淀粉的特征反应——遇 变蓝色
变蓝色
(4)实验2-1可证明氧化性
___________  (填“>”或“<”);实验2-2中使溶液褪色的粒子是
(填“>”或“<”);实验2-2中使溶液褪色的粒子是___________ 。
(5)证明氯水中含有氯离子的方案是___________ 。
(6)同学们发现久置的氯水会失去漂白性,溶液由黄绿色变为无色。为探究氯水失效的原因,进行实验:用强光照射盛有氯水的密闭广口瓶,并用传感器测定广口瓶中数据,得到如下曲线。
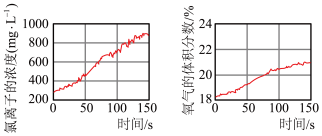
上两图中曲线变化的原因是___________ 。
【实验1】制备氯气。下图是实验室制取纯净、干燥氯气装置图。

(1)M仪器的名称是
(2)③中存放的试剂是
(3)⑤中反应的离子方程式是
【实验2】研究氯水性质。实验操作及现象如下表。
资料:淀粉的特征反应——遇
 变蓝色
变蓝色| 实验2-1 | 实验2-2 | |
| 实验操作(氯水均为新制) | 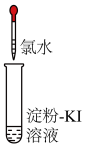 | 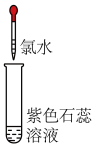 |
| 实验现象 | 溶液变蓝 | 石蕊溶液先变红,后褪色 |

 (填“>”或“<”);实验2-2中使溶液褪色的粒子是
(填“>”或“<”);实验2-2中使溶液褪色的粒子是(5)证明氯水中含有氯离子的方案是
(6)同学们发现久置的氯水会失去漂白性,溶液由黄绿色变为无色。为探究氯水失效的原因,进行实验:用强光照射盛有氯水的密闭广口瓶,并用传感器测定广口瓶中数据,得到如下曲线。

上两图中曲线变化的原因是
您最近一年使用:0次
22-23高一下·湖南长沙·阶段练习
名校
解题方法
10 . 实验室采用如图所示装置制取氯气并验证其性质,下列说法错误的是
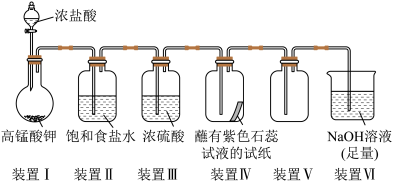

A.装置Ⅰ中反应的离子方程式为 |
| B.装置Ⅱ中饱和食盐水的作用是除去挥发出来的氯化氢气体 |
| C.装置Ⅳ中可观察到试纸先变红后褪色 |
D.每转移0.2mol电子,同时生成2.24L  |
您最近一年使用:0次





