1 . 如图是有关钠与水反应及产物检验的实验装置。实验开始时先向管内加入滴有酚酞试液的水,使水位达到B端管口,然后迅速塞紧橡胶塞并拔掉大头针,此时Na掉入水中。回答下列问题:
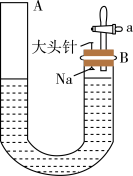
(1)钠与水反应的化学方程式为_____________ 。
(2)钠与水反应的现象有很多,不同的现象证明不同的性质。
①能证明钠的密度比水小的现象是_________ 。
②能证明钠的熔点低的现象是_________ 。
③能证明有氢氧化钠生成的现象是__________ 。
④能证明有气体产生的现象是A端液面________ (填“上升”“下降”或“不变”,下同),B端液面________ 。

(1)钠与水反应的化学方程式为
(2)钠与水反应的现象有很多,不同的现象证明不同的性质。
①能证明钠的密度比水小的现象是
②能证明钠的熔点低的现象是
③能证明有氢氧化钠生成的现象是
④能证明有气体产生的现象是A端液面
您最近一年使用:0次
2019-08-31更新
|
1847次组卷
|
15卷引用:陕西省西安市第八十五中学2019-2020学年高一上学期期末考试化学试题
陕西省西安市第八十五中学2019-2020学年高一上学期期末考试化学试题第二课时 研究物质性质的基本方法 练习内蒙古集宁一中(西校区)2019-2020学年高一上学期期末考试化学试题甘肃省古浪县第二中学2019-2020学年高一12月基础知识竞赛化学试题(已下线)1.2.1 研究物质性质的基本方法 练习(1)——《高中新教材同步备课》(鲁科版 必修第一册)(已下线)3.2.1 钠的性质与制备练习(1)——《高中新教材同步备课》(苏教版 必修第一册)安徽省肥东县高级中学2020-2021学年高一上学期第二次月考化学试题湖北省黄冈市2020-2021学年高一上学期期中联考化学试题甘肃省武威市民勤县第四中学2020-2021学年高一上学期期末考试(普通班)化学试题四川省自贡市田家炳中学2020-2021学年高一下学期开学考试化学试题安徽省亳州市第五完全中学2021-2022学年高一上学期期中考试化学试题甘肃省庄浪县阳川中学2021-2022学年高三上学期第二次月考化学试题重庆市万州纯阳中学校2021-2022学年高一10月月考化学(B卷)试题广东省华南师范大学附属中学2020-2021学年高一上学期期中考试化学试题湖北省武汉海淀外国语实验学校2022-2023学年高一上学期10月月考化学试题
解题方法
2 . 某同学对科学探究实验有着浓厚兴趣,他喜欢自己动手做实验,记录实验现象,并探究现象后的本质。实验如下:
(1)向蓝色的硫酸铜溶液中慢慢滴加氨水,生成蓝色絮状沉淀_____ (请用离子方程式说明),继续滴加沉淀消失,得到深蓝色溶液______ (用离子方程式说明)。
(2)已知Co(NH3)5BrSO4可形成两种Co的配合物。为了探索其化学式,他取了两种配合物的溶液于甲、乙两支试管中,甲中加BaCl2溶液无现象,加AgNO3溶液生成淡黄色沉淀,乙中加BaCl2生成白色沉淀,加AgNO3无现象,则甲、乙试管中的配合物化学式分别为____ 、______ 。
(1)向蓝色的硫酸铜溶液中慢慢滴加氨水,生成蓝色絮状沉淀
(2)已知Co(NH3)5BrSO4可形成两种Co的配合物。为了探索其化学式,他取了两种配合物的溶液于甲、乙两支试管中,甲中加BaCl2溶液无现象,加AgNO3溶液生成淡黄色沉淀,乙中加BaCl2生成白色沉淀,加AgNO3无现象,则甲、乙试管中的配合物化学式分别为
您最近一年使用:0次
解题方法
3 . 硫元素是动植物生长不可缺少的元素,广泛存在于自然界中。
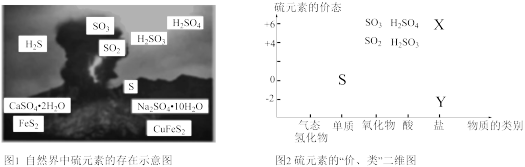
(1)从图1中选择符合图2要求的X、Y代表的物质:X_______ ,Y_______ 。
(2)硫酸是重要的化工原料,查阅资料,工业制硫酸的过程如图:
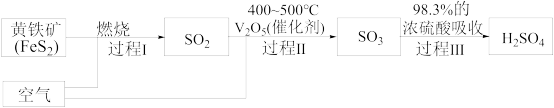
①上述过程中,没有发生氧化还原反应的是_______ (填“Ⅰ”、“Ⅱ”或“Ⅲ”)。
②过程Ⅰ的化学反应方程式为_______ 。
③下列对浓硫酸的叙述正确的是_______ (填字母)。
A.常温下,浓硫酸与铁、铝不反应,所以铁质、铝质容器能盛放浓硫酸
B.浓硫酸具有吸水性,故能使蔗糖炭化
C.浓硫酸和铜片加热既表现出酸性,又表现出氧化性
D.浓硫酸与亚硫酸钠反应制取 时,浓硫酸表现出强氧化性
时,浓硫酸表现出强氧化性
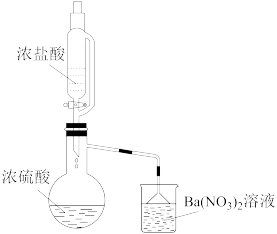
(3)某兴趣小组为验证浓硫酸的性质进行实验,如图实验中观察到蒸馏烧瓶内有白雾,原因是_______ ;烧杯中出现白色沉淀,原因是_______ 。

(1)从图1中选择符合图2要求的X、Y代表的物质:X
(2)硫酸是重要的化工原料,查阅资料,工业制硫酸的过程如图:
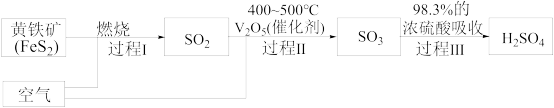
①上述过程中,没有发生氧化还原反应的是
②过程Ⅰ的化学反应方程式为
③下列对浓硫酸的叙述正确的是
A.常温下,浓硫酸与铁、铝不反应,所以铁质、铝质容器能盛放浓硫酸
B.浓硫酸具有吸水性,故能使蔗糖炭化
C.浓硫酸和铜片加热既表现出酸性,又表现出氧化性
D.浓硫酸与亚硫酸钠反应制取
 时,浓硫酸表现出强氧化性
时,浓硫酸表现出强氧化性(3)某兴趣小组为验证浓硫酸的性质进行实验,如图实验中观察到蒸馏烧瓶内有白雾,原因是

您最近一年使用:0次
4 . 元素周期表反映了元素之间的内在联系,是学习、研究和应用化学的一种重要工具。
Ⅰ.如图是元素周期表的一部分,回答下列问题:
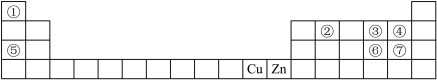
(1)①~⑦号元素中原子半径最大的是___________ (填元素符号),其最高价氧化物对应的水化物中含有的化学键是___________ 。该元素的单质与氧气在加热条件下反应生成R,用电子式表示R的形成过程___________ 。
(2)①~⑦号元素的最高价氧化物对应的水化物中,酸性最强的是___________ (填化学式,下同),碱性最强的是___________ 。
(3)将锌片、铜片用导线连接后浸入⑥的最高价氧化物对应水化物的稀溶液中,构成了原电池,则负极的电极反应式是___________ 。一段时间后,若锌片的质量减少了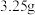 ,则导线中通过电子
,则导线中通过电子___________  。
。
Ⅱ.某小组为探究 的氧化性强弱,设计实验如下:
的氧化性强弱,设计实验如下:
资料:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
(4)实验①可得出氧化性强弱:___________ 。
(5)实验②观察到的现象是___________ ,甲同学根据此现象得出结论:氧化性 。乙同学认为实验②不能充分证明氧化性
。乙同学认为实验②不能充分证明氧化性 ,他补做了实验③。
,他补做了实验③。
补做实验③的目的是___________ 。
Ⅰ.如图是元素周期表的一部分,回答下列问题:

(1)①~⑦号元素中原子半径最大的是
(2)①~⑦号元素的最高价氧化物对应的水化物中,酸性最强的是
(3)将锌片、铜片用导线连接后浸入⑥的最高价氧化物对应水化物的稀溶液中,构成了原电池,则负极的电极反应式是
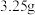 ,则导线中通过电子
,则导线中通过电子 。
。Ⅱ.某小组为探究
 的氧化性强弱,设计实验如下:
的氧化性强弱,设计实验如下:资料:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
| 序号 | 实验① | 实验② |
| 实验操作 | 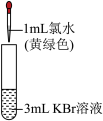 | 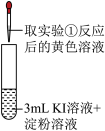 |
| 现象 | 溶液变为黄色 |
(5)实验②观察到的现象是
 。乙同学认为实验②不能充分证明氧化性
。乙同学认为实验②不能充分证明氧化性 ,他补做了实验③。
,他补做了实验③。| 实验③ | 另取实验①反应后的黄色溶液少许,先加入足量的 固体,充分振荡,然后加入 固体,充分振荡,然后加入 溶液和淀粉溶液。 溶液和淀粉溶液。 |
您最近一年使用:0次
5 . 某小组探究镁与醋酸溶液反应的实质。
【实验】在常温水浴条件下进行实验Ⅰ~Ⅲ,记录生成气体的体积和溶液 变化,如图1、2。
变化,如图1、2。
Ⅰ.取 光亮的镁屑(过量)放入
光亮的镁屑(过量)放入 溶液中;
溶液中;
Ⅱ.取 光亮的镁屑放入
光亮的镁屑放入 溶液(
溶液( )中;
)中;
Ⅲ.取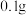 光亮的镁屑放入
光亮的镁屑放入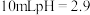 的
的 溶液中。
溶液中。
【数据】
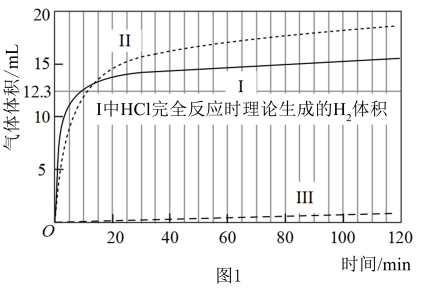
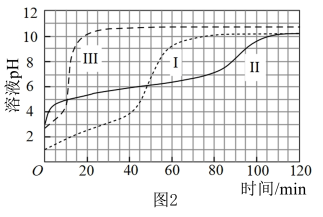
(1)起始阶段Ⅰ中主要反应的离子方程式为___________ 。
(2)Ⅱ起始溶液中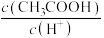 约为
约为___________ (用“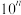 ”表示)。
”表示)。
(3)起始阶段,导致Ⅱ和Ⅲ中气体生成速率差异的主要因素不是 ,实验证据是
,实验证据是___________ 。
基于溶液组成预测Ⅱ的气体生成速率快于Ⅲ的原因是 能直接与
能直接与 反应。
反应。
验证:【实验Ⅳ】室温下,将一小段打磨光亮的镁条投入 冰醋酸中,立即产生大量气体。
冰醋酸中,立即产生大量气体。
(4)选择冰醋酸的理由是___________ 。
探究醋酸溶液中与 反应的主要微粒。
反应的主要微粒。
【实验Ⅴ】与实验Ⅱ相同的条件和试剂用量,将溶液换成含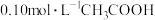 和
和 的
的 混合溶液(
混合溶液( )。各时刻气体生成的瞬时速率(
)。各时刻气体生成的瞬时速率( )对比如下。
)对比如下。
(5)①将a~c时刻对应溶液中的粒子浓度进行排序: :
:___________ (用“>”或“=”连接表示,下同);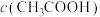 :
:___________ 。
②结合a~c中微粒浓度的比值分析, 和
和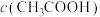 中哪一因素对气体生成速率影响更大:
中哪一因素对气体生成速率影响更大:___________ 。
(6)综合以上实验得出结论:
①镁与醋酸溶液反应时, 、
、 、
、 均能与镁反应产生氢气。
均能与镁反应产生氢气。
② 反应产生气体的主要微粒是
反应产生气体的主要微粒是___________ 。
【实验】在常温水浴条件下进行实验Ⅰ~Ⅲ,记录生成气体的体积和溶液
 变化,如图1、2。
变化,如图1、2。Ⅰ.取
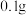 光亮的镁屑(过量)放入
光亮的镁屑(过量)放入 溶液中;
溶液中;Ⅱ.取
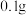 光亮的镁屑放入
光亮的镁屑放入 溶液(
溶液( )中;
)中;Ⅲ.取
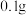 光亮的镁屑放入
光亮的镁屑放入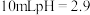 的
的 溶液中。
溶液中。【数据】


(1)起始阶段Ⅰ中主要反应的离子方程式为
(2)Ⅱ起始溶液中
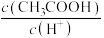 约为
约为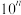 ”表示)。
”表示)。(3)起始阶段,导致Ⅱ和Ⅲ中气体生成速率差异的主要因素不是
 ,实验证据是
,实验证据是基于溶液组成预测Ⅱ的气体生成速率快于Ⅲ的原因是
 能直接与
能直接与 反应。
反应。验证:【实验Ⅳ】室温下,将一小段打磨光亮的镁条投入
 冰醋酸中,立即产生大量气体。
冰醋酸中,立即产生大量气体。(4)选择冰醋酸的理由是
探究醋酸溶液中与
 反应的主要微粒。
反应的主要微粒。【实验Ⅴ】与实验Ⅱ相同的条件和试剂用量,将溶液换成含
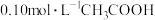 和
和 的
的 混合溶液(
混合溶液( )。各时刻气体生成的瞬时速率(
)。各时刻气体生成的瞬时速率( )对比如下。
)对比如下。| a.Ⅴ起始速率 | b.Ⅱ起始速率 | c.Ⅱ进行到 时速率 时速率 |
| 2.1 | 2.3 | 0.8 |
(5)①将a~c时刻对应溶液中的粒子浓度进行排序:
 :
: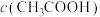 :
:②结合a~c中微粒浓度的比值分析,
 和
和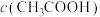 中哪一因素对气体生成速率影响更大:
中哪一因素对气体生成速率影响更大:(6)综合以上实验得出结论:
①镁与醋酸溶液反应时,
 、
、 、
、 均能与镁反应产生氢气。
均能与镁反应产生氢气。②
 反应产生气体的主要微粒是
反应产生气体的主要微粒是
您最近一年使用:0次
6 . 甲、乙组同学分别做了以下探究实验。
(1)甲组探究Cl2 与Na2SO3 溶液反应,实验装置如下。
①写出制取氯气的化学方程式______________ 。
②该装置的不足之处除无尾气吸收装置外,另一处是______________ 。
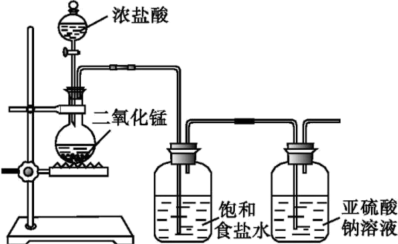
③Cl2与Na2SO3溶液反应的离子方程式为____________ 。
④设计实验,简述实验步骤,证明洗气瓶中的Na2SO3已被氧化_________ 。
(2)乙组探究乙酸乙酯在不同温度、不同浓度NaOH 溶液中的水解速率。取四只大小相同的试管,在试管外壁贴上体积刻度纸,按下表进行对照实验。在两种不同温度的水浴中加热相同时间后,记录酯层的体积来确定水解反应的速率
⑤请完成上表,其中V2=______ ,V4=______ ,V5=_______ 。
⑥实验中,可用饱和食盐水替代蒸馏水,以减小乙酸乙酯在水中的溶解度,使实验结果更准确;但不能用饱和Na2CO3溶液替代蒸馏水,其原因是____ ;实验中,试管IV比试管II中的酯层减少更快,其原因有:温度高速率快,还可能有_________ 。 (乙酸乙酯沸点 为77.1℃)
(1)甲组探究Cl2 与Na2SO3 溶液反应,实验装置如下。
①写出制取氯气的化学方程式
②该装置的不足之处除无尾气吸收装置外,另一处是

③Cl2与Na2SO3溶液反应的离子方程式为
④设计实验,简述实验步骤,证明洗气瓶中的Na2SO3已被氧化
(2)乙组探究乙酸乙酯在不同温度、不同浓度NaOH 溶液中的水解速率。取四只大小相同的试管,在试管外壁贴上体积刻度纸,按下表进行对照实验。在两种不同温度的水浴中加热相同时间后,记录酯层的体积来确定水解反应的速率
| 实验试剂 | 试管I | 试管II | 试管Ⅲ | 试管IV |
| 乙酸乙酯/mL | 1 | V1 | V2 | V3 |
| 1mol/L NaOH/ mL | V4 | 3 | 0 | V5 |
| 蒸馏水/mL | 0 | V6 | 5 | 2 |
⑤请完成上表,其中V2=
⑥实验中,可用饱和食盐水替代蒸馏水,以减小乙酸乙酯在水中的溶解度,使实验结果更准确;但不能用饱和Na2CO3溶液替代蒸馏水,其原因是
您最近一年使用:0次
7 . (A)如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。试回答下列问题:

(1)实验1中,沉淀最终变为________ 色,写出沉淀变色的化学方程式_______________________________ 。
(2)实验2甲针筒内的现象是:有___________ 生成,活塞________ 移动(填向外、向内、不)。反应后甲针筒内有少量的残留气体,正确的处理方法是将其通入___________ 溶液中。
(3)实验3中,甲中的3mL气体是NO2和N2O4的混合气体,那么甲中最后剩余的无色气体是_______ ,写出NO2与H2O反应的化学方程式为_______________________________ 。
(4)实验4中,已知:3Cl2+2NH3→N2+6HCl。甲针筒内活塞有移动,针筒内有白烟产生外,气体的颜色变为____________ 。最后针筒内剩余气体的体积约为________ mL。

| 实验序号 | 甲针筒内物质 | 乙针筒内物质 | 甲针简的现象 |
| 1 | 10mLFeSO4溶液 | 10mLNH3 | 生成白色沉淀,后变色 |
| 2 | 20mLH2S | 10mLSO2 | |
| 3 | 30mLNO2(主要) | 10mLH2O(l) | 剩有无色气体,活塞自动向内压缩 |
| 4 | 15mLCl2 | 40mLNH3 |
(1)实验1中,沉淀最终变为
(2)实验2甲针筒内的现象是:有
(3)实验3中,甲中的3mL气体是NO2和N2O4的混合气体,那么甲中最后剩余的无色气体是
(4)实验4中,已知:3Cl2+2NH3→N2+6HCl。甲针筒内活塞有移动,针筒内有白烟产生外,气体的颜色变为
您最近一年使用:0次
8 . 如图在衬白纸的玻璃片中央放置适量的KMnO4颗粒,在周围分别滴加一滴含有酚酞的澄清石灰水、FeCl2溶液,然后在KMnO4晶体上滴加适量的浓盐酸,迅速盖好表面皿。提示:实验室中所用的少量氯气可以用下述原理制取:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,此反应在常温下即能进行。

(1)浓盐酸在反应中表现出来的性质是______ (填写编号),氧化剂与还原剂物质的量之比为______ ,氧化产物为______ 。
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(2)产生0.1 mol Cl2,则转移电子的物质的量为______ mol。
(3)a处反应的化学方程式是___________________________ ,工业上用此原理制取漂白粉。
(4)b处离子方程式是________________________ 。
(5)高锰酸钾标准溶液经常用来滴定测量物质的含量。用高锰酸钾法间接测定石灰石中CaCO3的含量的方法为: 称取试样0.1250g,用稀盐酸溶解后加入(NH4)2C2O4得CaC2O4沉淀。沉淀经过滤洗涤后溶于稀硫酸中。滴定生成的H2C2O4用去浓度为0.0 16mo/LKMnO4溶液25.00mL。
①写出CaC2O4沉淀溶解的离子方程式:___________________
②配平并完成下列高锰酸钾滴定草酸反应的离子方程式:____ MnO4-+___ H2C2O4+____ =___ Mn2++___ CO2↑+____
③石灰石中CaCO3的百分含量:_______

(1)浓盐酸在反应中表现出来的性质是
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(2)产生0.1 mol Cl2,则转移电子的物质的量为
(3)a处反应的化学方程式是
(4)b处离子方程式是
(5)高锰酸钾标准溶液经常用来滴定测量物质的含量。用高锰酸钾法间接测定石灰石中CaCO3的含量的方法为: 称取试样0.1250g,用稀盐酸溶解后加入(NH4)2C2O4得CaC2O4沉淀。沉淀经过滤洗涤后溶于稀硫酸中。滴定生成的H2C2O4用去浓度为0.0 16mo/LKMnO4溶液25.00mL。
①写出CaC2O4沉淀溶解的离子方程式:
②配平并完成下列高锰酸钾滴定草酸反应的离子方程式:
③石灰石中CaCO3的百分含量:
您最近一年使用:0次
2019-09-30更新
|
133次组卷
|
2卷引用:陕西省渭南市临渭区尚德中学2020届高三上学期第一次月考化学试卷
名校
解题方法
9 . 如图所示的初中化学中的一些重要实验,请回答下列问题:
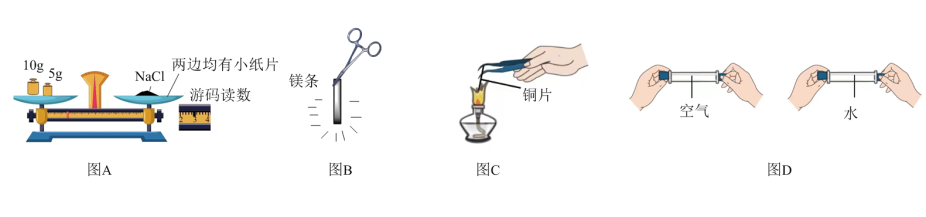
(1)图A称量NaCl的实际质量是___ 。
(2)图B反应的实验现象是__ 。
(3)图C反应的表达式为__ 。
(4)图D实验目的是__ 。

(1)图A称量NaCl的实际质量是
(2)图B反应的实验现象是
(3)图C反应的表达式为
(4)图D实验目的是
您最近一年使用:0次
解题方法
10 . (1)在一个白色点滴板的二个孔穴中分别加入火柴梗、少量CuSO4·5H2O。分别滴入几滴浓硫酸,观察现象。回答下列问题:
浓硫酸滴到火柴梗上,火柴梗变________ (填实验现象),说明浓硫酸具有________ 性。
浓硫酸滴入CuSO4·5H2O中,胆矾________ (填实验现象),说明浓硫酸具有_________ 性。
(2)为探究Fe3+能转化为Fe2+,实验室提供下列试剂:铁粉、0.1mol·L-1 FeCl3溶液、0.1mol·L-1 FeCl2溶液、KSCN溶液、新制氯水。请你就实验操作、实验现象、结论完成以下填空:
取少量_____________ 溶液于试管中,加入足量____________ ,充分振荡后静置,滴加1至2滴_________________ ,无明显变化,说明Fe3+已转化为Fe2+。
浓硫酸滴到火柴梗上,火柴梗变
浓硫酸滴入CuSO4·5H2O中,胆矾
(2)为探究Fe3+能转化为Fe2+,实验室提供下列试剂:铁粉、0.1mol·L-1 FeCl3溶液、0.1mol·L-1 FeCl2溶液、KSCN溶液、新制氯水。请你就实验操作、实验现象、结论完成以下填空:
取少量
您最近一年使用:0次
2016-12-09更新
|
300次组卷
|
2卷引用:2014-2015陕西省西安市庆安中学高一上学期期末考试化学试卷



