1 . 已知甲是短周期某主族元素的最简单氢化物,该物质有如下转化关系(反应条件部分省略)。
甲 乙
乙 丙
丙 丁
丁
Ⅰ.若丙在常温常压为红棕色气体。
(1)写出实验室制取甲的化学方程式:__________ 。
(2)写出甲→乙的化学方程式:__________ 。
Ⅱ.若乙是具有刺激性气味的气体,丁为二元酸。某小组欲通过以下装置探究乙的部分性质。__________ 。
(4)试管A的作用为__________ 。
(5)若M是 溶液,试管B中观察到的现象为
溶液,试管B中观察到的现象为__________ ;为证明乙的氧化产物在溶液中的存在形式,某同学向试管B反应后的溶液中加入硝酸酸化的 溶液,判断是否出现白色沉淀。该做法
溶液,判断是否出现白色沉淀。该做法__________ (填“合理”或“不合理”),理由是__________ 。
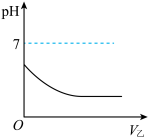
(6)将乙逐渐通入M溶液,测得溶液pH随通入乙气体体积的变化如图所示,则M溶液可能是__________ (填标号)。
甲
 乙
乙 丙
丙 丁
丁Ⅰ.若丙在常温常压为红棕色气体。
(1)写出实验室制取甲的化学方程式:
(2)写出甲→乙的化学方程式:
Ⅱ.若乙是具有刺激性气味的气体,丁为二元酸。某小组欲通过以下装置探究乙的部分性质。
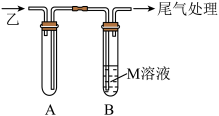
(4)试管A的作用为
(5)若M是
 溶液,试管B中观察到的现象为
溶液,试管B中观察到的现象为 溶液,判断是否出现白色沉淀。该做法
溶液,判断是否出现白色沉淀。该做法(6)将乙逐渐通入M溶液,测得溶液pH随通入乙气体体积的变化如图所示,则M溶液可能是
您最近一年使用:0次
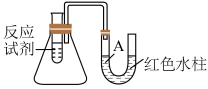
2 . 下图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应。___________ 。
(2)该反应是___________ (填“放热”或“吸热”)反应,结合实验现象写出判断依据___________ 。
(2)该反应是
您最近一年使用:0次
2024-04-23更新
|
69次组卷
|
2卷引用:上海市松江二中2023-2024学年高一下学期期中测试 化学试卷
解题方法
3 . 钠与水反应的实验过程如图①、②、③所示。

(1)将图②中的现象与解释用直线连接起来________ 。
(2)图③中滴加酚酞试液后,观察到溶液变红,说明有___________ 生成;
(3)钠与水反应的化学方程式是___________ 。

(1)将图②中的现象与解释用直线连接起来
| 实验现象 | 解释 |
| 钠熔成小球 | 产生了气体 |
| 钠四处游动,嘶嘶作响 | 钠的密度比水小 |
| 钠浮在水面上 | 钠与水反应放热且钠的熔点低 |
(2)图③中滴加酚酞试液后,观察到溶液变红,说明有
(3)钠与水反应的化学方程式是
您最近一年使用:0次
4 . 实验室用如下装置制取干燥纯净的氯气,并用氯气进行实验。回答下列问题:
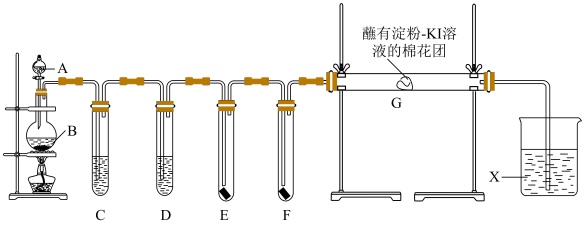
(1)装置连接完成后必须进行的操作是________ 。
(2)实验室制氯气的反应方程式为 ,其中参加反应的还原剂与氧化剂的数目之比为
,其中参加反应的还原剂与氧化剂的数目之比为_____ 。
(3)试管D中试剂为_______ 。
(4)E中为红色干布条,F中为红色湿布条,可观察到的现象是_______ 。对比E和F中现象的差异可得出的结论_______ 。
(5)装置G处棉花团变蓝,写出发生反应的化学方程式_______ (提示:淀粉遇I2变蓝)。

(1)装置连接完成后必须进行的操作是
(2)实验室制氯气的反应方程式为
 ,其中参加反应的还原剂与氧化剂的数目之比为
,其中参加反应的还原剂与氧化剂的数目之比为(3)试管D中试剂为
(4)E中为红色干布条,F中为红色湿布条,可观察到的现象是
(5)装置G处棉花团变蓝,写出发生反应的化学方程式
您最近一年使用:0次
名校
5 . 在实验室里,某同学取一小块金属钠做钠与水反应的实验。试完成下列问题:
(1)切开的金属钠暴露在空气中,最先观察到的现象是___________ ,所发生反应的化学方程式是___________ 。
(2)将钠投入水中后,钠熔化成一个小球,根据这一现象你能得出的结论是①___________ ,②___________ 。
(3)将一块绿豆粒大小的钠投入到滴加了石蕊试剂的水中,不可能观察到的现象是___________。
(4)根据上述实验过程中钠所发生的有关变化,试说明金属钠保存在煤油中的目的是___________ 。
(1)切开的金属钠暴露在空气中,最先观察到的现象是
(2)将钠投入水中后,钠熔化成一个小球,根据这一现象你能得出的结论是①
(3)将一块绿豆粒大小的钠投入到滴加了石蕊试剂的水中,不可能观察到的现象是___________。
| A.钠熔化成小球并在液面上游动 | B.发出“嘶嘶”声响 |
| C.小球最后消失 | D.溶液最后变红 |
您最近一年使用:0次
名校
解题方法
6 . 钠及其化合物在认识物质转化规律以及生产生活中均有重要应用。
(1)金属与水的反应
①Na的原子结构示意图是___________ 。
②钠与水反应的化学方程式是___________ 。
③钠与水的反应放出热量的现象是___________ 。
④钠、镁与水均能反应,通过比较反应的难易程度,可知钠的金属性强于镁。
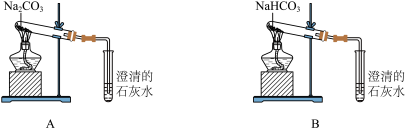
(2)钠、钾失火时,可用不同的灭火剂灭火。如金属钠失火,可用Na2CO3干粉灭火,但不能用NaHCO3灭火,结合反应方程式说明原因___________ 。
(3)Na2CO3和NaHCO3是两种常见的钠盐。下列关于Na2CO3和NaHCO3的说法中,正确的是___________ (填字母)。
a.Na2CO3和NaHCO3的溶液均显碱性
b.相同温度下,NaHCO3的溶解度大于Na2CO3
c.向等质量的Na2CO3和NaHCO3固体中分别滴加足量的盐酸,相同条件下产生CO2的体积也相同
(4)按下图所示装置实验,可得到“Na2CO3的热稳定性比NaHCO3强”的结论,证据是________ 。
(1)金属与水的反应

①Na的原子结构示意图是
②钠与水反应的化学方程式是
③钠与水的反应放出热量的现象是
④钠、镁与水均能反应,通过比较反应的难易程度,可知钠的金属性强于镁。
(2)钠、钾失火时,可用不同的灭火剂灭火。如金属钠失火,可用Na2CO3干粉灭火,但不能用NaHCO3灭火,结合反应方程式说明原因
(3)Na2CO3和NaHCO3是两种常见的钠盐。下列关于Na2CO3和NaHCO3的说法中,正确的是
a.Na2CO3和NaHCO3的溶液均显碱性
b.相同温度下,NaHCO3的溶解度大于Na2CO3
c.向等质量的Na2CO3和NaHCO3固体中分别滴加足量的盐酸,相同条件下产生CO2的体积也相同
(4)按下图所示装置实验,可得到“Na2CO3的热稳定性比NaHCO3强”的结论,证据是

您最近一年使用:0次
7 . 从氧化还原反应角度预测 的化学性质实验用品:Zn、酸性
的化学性质实验用品:Zn、酸性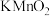 溶液、KOH溶液
溶液、KOH溶液
 的化学性质实验用品:Zn、酸性
的化学性质实验用品:Zn、酸性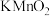 溶液、KOH溶液
溶液、KOH溶液| 预测性质 | 选择反应物 | 预测产物 | 预测依据 |
您最近一年使用:0次
名校
8 . 三草酸合铁酸钾晶体 可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾
可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾 在一定条件下加热分解,对所得气体产物和固体产物进行探究。
在一定条件下加热分解,对所得气体产物和固体产物进行探究。
(1)三草酸合铁酸钾晶体 属于
属于___________ (填“混合物、酸、碱或盐”);已知该物质中铁的化合价为 ,则该物质中C的化合价为
,则该物质中C的化合价为___________ 。
Ⅰ.气体产物成分探究
(2)将气体产物依次通过(A)澄清石灰水(过量)、(B)浓硫酸、(C)灼热氧化铜、(D)澄清石灰水,观察到A、D中澄清石灰水均变浑浊,C中有红色固体生成,则气体产物的成分是___________ 。(填化学式)
Ⅱ.固体产物成分探究
(3)该小组同学查阅资料后推知,固体产物中铁元素以 和Fe存在,完成实验设计。
和Fe存在,完成实验设计。
实验前,先预测 的性质。用新制纯净的
的性质。用新制纯净的 粉末,完成以下实验设计表格:(已知铁元素的化合价有0、
粉末,完成以下实验设计表格:(已知铁元素的化合价有0、 、
、 ,稀溶液中
,稀溶液中 、
、 的颜色分别为浅绿色、黄色)
的颜色分别为浅绿色、黄色)
限选 试剂:炭粉、酸性 溶液、稀盐酸、
溶液、稀盐酸、 溶液、澄清石灰水。
溶液、澄清石灰水。
 可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾
可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾 在一定条件下加热分解,对所得气体产物和固体产物进行探究。
在一定条件下加热分解,对所得气体产物和固体产物进行探究。(1)三草酸合铁酸钾晶体
 属于
属于 ,则该物质中C的化合价为
,则该物质中C的化合价为Ⅰ.气体产物成分探究
(2)将气体产物依次通过(A)澄清石灰水(过量)、(B)浓硫酸、(C)灼热氧化铜、(D)澄清石灰水,观察到A、D中澄清石灰水均变浑浊,C中有红色固体生成,则气体产物的成分是
Ⅱ.固体产物成分探究
(3)该小组同学查阅资料后推知,固体产物中铁元素以
 和Fe存在,完成实验设计。
和Fe存在,完成实验设计。实验前,先预测
 的性质。用新制纯净的
的性质。用新制纯净的 粉末,完成以下实验设计表格:(已知铁元素的化合价有0、
粉末,完成以下实验设计表格:(已知铁元素的化合价有0、 、
、 ,稀溶液中
,稀溶液中 、
、 的颜色分别为浅绿色、黄色)
的颜色分别为浅绿色、黄色) 溶液、稀盐酸、
溶液、稀盐酸、 溶液、澄清石灰水。
溶液、澄清石灰水。预测的 性质 性质 | 预测的依据 | 预期现象 |
| 能与 | 从组成看, 属于碱性氧化物 属于碱性氧化物 | 固体溶解,溶液为浅绿色 |
| 能与 | ||
| 能与炭粉反应 |
您最近一年使用:0次
名校
解题方法
9 . 以下是有关铝的实验探究,请回答相关问题:
(1)用铝粉和 Fe2O3做铝热反应实验,需要的试剂还有___________。
(2)镁能发生和铝类似的“镁热反应”,写出镁在高温下和 Fe2O3反应的化学方程式___________ 。
(3)向集满CO2的铝制易拉罐中加入过量 NaOH 浓溶液,立即封闭罐口,易拉罐渐渐凹瘪; 再过一段时间,罐壁又重新凸起。写出罐壁又重新凸起发生的相关离子方程式:___________ 。
(4)向铝粉中添加少量 NH4Cl固体并充分混合,将其加热到1000℃时可与 N₂反应制备 AlN,下列说法正确的是___________
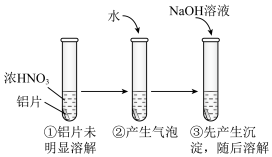
(5)用打磨过的铝片进行如下实验, 下列分析不合理的是___________
(6)为探究铝片(未打磨)与Na2CO3溶液的反应,实验如下:
下列说法不正确的是___________
(7)某铝土矿的主要成分为Al2O3·xH2O,还含有Fe2O3和 SiO2杂质。称取 17.50g铝土矿样品,加入 200mL1.65mol/L 的稀硫酸,恰好完全反应,过滤得沉淀0.30g,然后在滤液中加入足量的 NaOH 溶液,得到沉淀 2.14g。
①该试样中Fe2O3的物质的量为___________ mol。
② 样品中Al2O3·xH2O的x=__________ 。
(1)用铝粉和 Fe2O3做铝热反应实验,需要的试剂还有___________。
| A.KCl | B.KClO3 | C.MnO2 | D.Mg |
(2)镁能发生和铝类似的“镁热反应”,写出镁在高温下和 Fe2O3反应的化学方程式
(3)向集满CO2的铝制易拉罐中加入过量 NaOH 浓溶液,立即封闭罐口,易拉罐渐渐凹瘪; 再过一段时间,罐壁又重新凸起。写出罐壁又重新凸起发生的相关离子方程式:
(4)向铝粉中添加少量 NH4Cl固体并充分混合,将其加热到1000℃时可与 N₂反应制备 AlN,下列说法正确的是___________
| A.AlN是一种金属材料 |
| B.AlN与足量氢氧化钠溶液共热时生成氢氧化铝和氨气 |
| C.少量 NH4Cl能够破坏 Al表面的 Al2O3薄膜 |
| D.AlN与足量盐酸反应的离子方程式为AlN+3H+=Al3++NH3↑ |
(5)用打磨过的铝片进行如下实验, 下列分析不合理的是___________

| A.①中铝片发生了钝化 |
| B.②中产生的气泡是氮氧化合物,不是氢气 |
| C.③中沉淀溶解的离子方程式是Al(OH)3+OH-=[Al(OH)4]- |
| D.②中加水稀释过程中,仅发生了氧化还原反应 |
(6)为探究铝片(未打磨)与Na2CO3溶液的反应,实验如下:
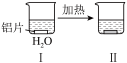 |  | |
| 无明显现象 | 铝片表面产生细小气泡 | 出现白色沉淀,产生大量气泡(经检验为H2和CO2) |
A.Na2CO3溶液中存在水解平衡: 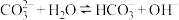 |
| B.对比Ⅰ 、Ⅲ,推测 Na2CO3溶液能破坏铝表面的氧化膜 |
| C.Ⅳ溶液中可能存在大量 Al3+ |
D.推测出现白色浑浊的可能原因:[Al(OH)4]-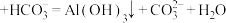 |
(7)某铝土矿的主要成分为Al2O3·xH2O,还含有Fe2O3和 SiO2杂质。称取 17.50g铝土矿样品,加入 200mL1.65mol/L 的稀硫酸,恰好完全反应,过滤得沉淀0.30g,然后在滤液中加入足量的 NaOH 溶液,得到沉淀 2.14g。
①该试样中Fe2O3的物质的量为
② 样品中Al2O3·xH2O的x=
您最近一年使用:0次
名校
解题方法
10 . 氯酸钾为无色或白色晶体,是一种强氧化剂。某化学小组制取氯酸钾并进行有关探究实验。
I.制取氯酸钾
利用如图所示的实验装置进行实验。回答下列问题:
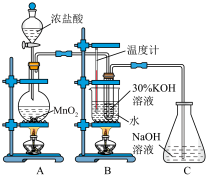
(1)装置A中盛装浓盐酸的仪器名称是___________ 。
(2)装置A中发生反应的离子方程式为___________ 。
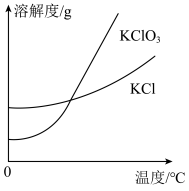
(3)氯气和氢氧化钾溶液在加热的条件下可制得氯酸钾,若装置B中加热温度过低,所得主要氧化产物为___________ (填化学式)。已知氯酸钾和氯化钾的溶解度曲线如图所示,反应结束后,从装置B所得溶液中提取氯酸钾晶体的实验操作是蒸发浓缩、___________ 、洗涤、干燥。
II.探究氯酸钾与碘化钾的反应
(4)在不同条件下KClO3可将KI氧化为I2或KIO3.室温下,该小组设计了系列实验研究硫酸浓度对反应产物的影响,实验记录如下表:
①3号试管实验中x的值为___________ ;1号试管实验的作用是___________ 。
②假设氧化产物唯一,还原产物为KCl,2号试管中主要反应的离子方程式为___________ 。
③由该系列实验可得出的结论是___________ 。
I.制取氯酸钾
利用如图所示的实验装置进行实验。回答下列问题:

(1)装置A中盛装浓盐酸的仪器名称是
(2)装置A中发生反应的离子方程式为
(3)氯气和氢氧化钾溶液在加热的条件下可制得氯酸钾,若装置B中加热温度过低,所得主要氧化产物为

II.探究氯酸钾与碘化钾的反应
(4)在不同条件下KClO3可将KI氧化为I2或KIO3.室温下,该小组设计了系列实验研究硫酸浓度对反应产物的影响,实验记录如下表:
| 试管编号 | 1 | 2 | 3 | 4 |
| 0.20mol·L-1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
| KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
| 6.0mol·L-1H2SO4/mL | 0 | 3.0 | x | 9.0 |
| 蒸馏水/mL | 9.0 | 6.0 | 5.0 | 0 |
| 取少量反应后溶液滴加淀粉溶液 | 无现象 | 变蓝 | 变蓝 | 无现象 |
②假设氧化产物唯一,还原产物为KCl,2号试管中主要反应的离子方程式为
③由该系列实验可得出的结论是
您最近一年使用:0次
2023-11-13更新
|
439次组卷
|
2卷引用:广东省汕头市潮阳实验学校2024届高三上学期期中考试化学试题



