名校
解题方法
1 . 三氯化铬(CrCl3)是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室制取CrCl3的反应为Cr2O3(s)+3CCl4(g) 2CrCl3(s)+3COCl2(g),其实验装置如下图所示:
2CrCl3(s)+3COCl2(g),其实验装置如下图所示:
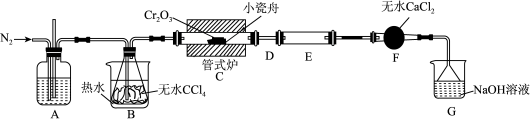
已知:①COCl2(俗称光气)有毒,遇水发生水解:COCl2+H2O=CO2+2HCl;
②碱性条件下,H2O2可将Cr3+氧化为 ;酸性条件下,H2O2将
;酸性条件下,H2O2将 还原为Cr3+。
还原为Cr3+。
请回答下列问题:
(1)A中的试剂为_______ ;无水CaCl2的作用是_______ ;反应结束后要继续通入一段时间氮气,主要目的是_______ 。
(2)装置E用来收集产物。实验过程中若D处出现堵塞,可观察到的现象是_______ ;可通过_______ (填操作)使实验继续进行。
(3)装置G中发生反应的离子方程式为_______ 。
(4)测定产品中CrCl3质量分数的实验步骤如下:
I.取mgCrCl3产品,在强碱性条件下,加入过量的30%H2O2溶液,小火加热使CrCl3完全转化为 ,继续加热一段时间;
,继续加热一段时间;
II.冷却后加适量的蒸馏水,再滴入适量的浓硫酸和浓磷酸(加浓磷酸的目的是为了防止指示剂提前变色),使 转化为
转化为 ;
;
III.用新配制的cmol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2标准溶液VmL(已知 被Fe2+还原为Cr3+)。
被Fe2+还原为Cr3+)。
①产品中CrCl3质量分数表达式为_______ %。
②下列操作将导致产品中CrCl3质量分数测定值偏低的是_______ (填字母标号)。
A.步骤I中未继续加热一段时间
B.步骤III中所用(NH4)2Fe(SO4)2溶液已变质
C.步骤II中未加浓磷酸
D.步骤III中读数时,滴定前俯视,滴定后平视
 2CrCl3(s)+3COCl2(g),其实验装置如下图所示:
2CrCl3(s)+3COCl2(g),其实验装置如下图所示:
已知:①COCl2(俗称光气)有毒,遇水发生水解:COCl2+H2O=CO2+2HCl;
②碱性条件下,H2O2可将Cr3+氧化为
 ;酸性条件下,H2O2将
;酸性条件下,H2O2将 还原为Cr3+。
还原为Cr3+。请回答下列问题:
(1)A中的试剂为
(2)装置E用来收集产物。实验过程中若D处出现堵塞,可观察到的现象是
(3)装置G中发生反应的离子方程式为
(4)测定产品中CrCl3质量分数的实验步骤如下:
I.取mgCrCl3产品,在强碱性条件下,加入过量的30%H2O2溶液,小火加热使CrCl3完全转化为
 ,继续加热一段时间;
,继续加热一段时间;II.冷却后加适量的蒸馏水,再滴入适量的浓硫酸和浓磷酸(加浓磷酸的目的是为了防止指示剂提前变色),使
 转化为
转化为 ;
;III.用新配制的cmol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2标准溶液VmL(已知
 被Fe2+还原为Cr3+)。
被Fe2+还原为Cr3+)。①产品中CrCl3质量分数表达式为
②下列操作将导致产品中CrCl3质量分数测定值偏低的是
A.步骤I中未继续加热一段时间
B.步骤III中所用(NH4)2Fe(SO4)2溶液已变质
C.步骤II中未加浓磷酸
D.步骤III中读数时,滴定前俯视,滴定后平视
您最近一年使用:0次
2021-06-05更新
|
1281次组卷
|
11卷引用:山西省阳泉市2021届高三下学期第三次教学质量检测(三模)理综化学试题
山西省阳泉市2021届高三下学期第三次教学质量检测(三模)理综化学试题山东省临沂市2021届高三第一次模拟考试化学试题山东省济南市平阴县第一中学2021届高三下学期3月月考化学试题山东省2020-2021学年普通高中学业水平等级考试化学试题(已下线)重点7 化学实验综合题-2021年高考化学【热点·重点·难点】专练(山东专用)(已下线)2021年高考化学押题预测卷(新课标Ⅱ卷)(02)(含考试版、答题卡、参考答案、全解全析)(已下线)押山东卷第20题 化学实验综合题-备战2021年高考化学临考题号押题(山东卷)四川省成都市第七中学高2022届高三10月阶段考试理综测试化学试题(已下线)专题17 综合实验设计、探究和评价-备战2022年高考化学真题及地市好题专项集训【山东专用】(已下线)专题10 化学实验综合—2022年高考化学二轮复习讲练测(全国版)-测试山东省菏泽市单县第二中学2023届高三第一次模拟考试化学试题
2 . 三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化,碱性条件下能被H2O2氧化为Cr(Ⅵ)。制三氯化铬的流程如下:
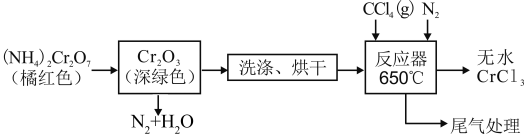
(1)重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤的原因是________ ,如何判断其已洗涤干净:_____
(2)已知CCl4沸点为76.8 ℃,为保证稳定的CCl4气流,适宜加热方式是______ 。
(3)用如图装置制备CrCl3时,主要步骤包括:①将产物收集到蒸发皿中;②加热反应管至400 ℃,开始向三颈烧瓶中通入氮气,使CCl4蒸气经氮气载入反应管进行反应,继续升温到650 ℃;③三颈烧瓶中装入150 mL CCl4,并加热CCl4,温度控制在50~60 ℃之间;④反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源;⑤停止加热CCl4,继续通入氮气;⑥检查装置气密性。正确的顺序为:⑥→③→________ 。
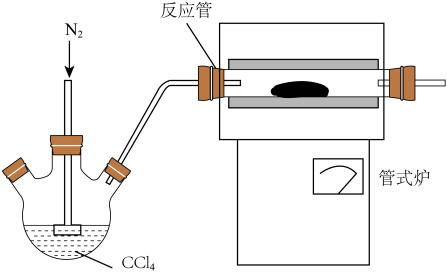
(4)已知反应管中发生的主要反应有:Cr2O3+3CCl4 2CrCl3+3COCl2,因光气有剧毒,实验需在通风橱中进行,并用乙醇处理COCl2,生成一种含氧酸酯(C5H10O3),用乙醇处理尾气的化学方程式为
2CrCl3+3COCl2,因光气有剧毒,实验需在通风橱中进行,并用乙醇处理COCl2,生成一种含氧酸酯(C5H10O3),用乙醇处理尾气的化学方程式为_____ 。
(5)样品中三氯化铬质量分数的测定
称取样品0.330 0 g,加水溶解并定容于250 mL容量瓶中。移取25.00 mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸腾后加入1 g Na2O2,充分加热煮沸,适当稀释,然后加入过量的2 mol/L H2SO4溶液至溶液呈强酸性,此时铬以Cr2O72-存在,再加入1.1 g KI,塞上塞子,摇匀,于暗处静置5分钟后,加入1 mL指示剂,用0.025 0 mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00 mL。已知Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O, 2Na2S2O3+I2= Na2S4O6+2NaI。
①该实验可选用的指示剂名称为______ 。
②移入碘量瓶的CrCl3溶液需加热煮沸,加入Na2O2后也要加热煮沸,其主要原因是____ 。
③样品中无水三氯化铬的质量分数为____ (结果保留一位小数)。

(1)重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤的原因是
(2)已知CCl4沸点为76.8 ℃,为保证稳定的CCl4气流,适宜加热方式是
(3)用如图装置制备CrCl3时,主要步骤包括:①将产物收集到蒸发皿中;②加热反应管至400 ℃,开始向三颈烧瓶中通入氮气,使CCl4蒸气经氮气载入反应管进行反应,继续升温到650 ℃;③三颈烧瓶中装入150 mL CCl4,并加热CCl4,温度控制在50~60 ℃之间;④反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源;⑤停止加热CCl4,继续通入氮气;⑥检查装置气密性。正确的顺序为:⑥→③→

(4)已知反应管中发生的主要反应有:Cr2O3+3CCl4
 2CrCl3+3COCl2,因光气有剧毒,实验需在通风橱中进行,并用乙醇处理COCl2,生成一种含氧酸酯(C5H10O3),用乙醇处理尾气的化学方程式为
2CrCl3+3COCl2,因光气有剧毒,实验需在通风橱中进行,并用乙醇处理COCl2,生成一种含氧酸酯(C5H10O3),用乙醇处理尾气的化学方程式为(5)样品中三氯化铬质量分数的测定
称取样品0.330 0 g,加水溶解并定容于250 mL容量瓶中。移取25.00 mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸腾后加入1 g Na2O2,充分加热煮沸,适当稀释,然后加入过量的2 mol/L H2SO4溶液至溶液呈强酸性,此时铬以Cr2O72-存在,再加入1.1 g KI,塞上塞子,摇匀,于暗处静置5分钟后,加入1 mL指示剂,用0.025 0 mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00 mL。已知Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O, 2Na2S2O3+I2= Na2S4O6+2NaI。
①该实验可选用的指示剂名称为
②移入碘量瓶的CrCl3溶液需加热煮沸,加入Na2O2后也要加热煮沸,其主要原因是
③样品中无水三氯化铬的质量分数为
您最近一年使用:0次



