1 . 富马酸亚铁(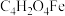 相对分子质量为170)常用于治疗缺铁性贫血,也可作食品营养强化剂。某化学兴趣小组用富马酸(HOOCCH=CHCOOH)和
相对分子质量为170)常用于治疗缺铁性贫血,也可作食品营养强化剂。某化学兴趣小组用富马酸(HOOCCH=CHCOOH)和 制备富马酸亚铁,并对其纯度进行测定,过程如下:
制备富马酸亚铁,并对其纯度进行测定,过程如下:
步骤Ⅰ 富马酸亚铁晶体的制备

步骤Ⅱ 产品纯度的测定
取0.400g样品置于250mL锥形瓶中,加入15.00mL硫酸,加热溶解后冷却,再加入50.00mL新煮沸过的冷水和2滴邻二氮菲指示液,此时溶液呈红色;立即用0.1000 的硫酸铈铵
的硫酸铈铵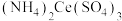 标准液滴定(还原产物为
标准液滴定(还原产物为 ),滴定终点溶液变为浅蓝色。平行测定三次,平均消耗22.00mL标准液。根据以上两个实验步骤,回答下列问题:
),滴定终点溶液变为浅蓝色。平行测定三次,平均消耗22.00mL标准液。根据以上两个实验步骤,回答下列问题:
(1)合成富马酸亚铁时使用如图所示装置(加热和夹持装置略去)。
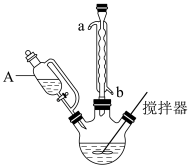
仪器A的名称是_______ ,球形冷凝管的作用为_______ 。
(2)步骤Ⅱ中硫酸铈铵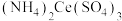 应装入
应装入_______ (填“酸式”或“碱式”)滴定管。
(3)步骤Ⅰ中调pH最好选用的酸为_______ 。
a.盐酸 b.硫酸 c.硝酸
步骤Ⅰ中调pH为6.6的目的是_______ 。合成富马酸亚铁的化学方程式为_______ 。
(4)根据上述实验数据,测得产品的纯度是_______ %(保留三位有效数字)。
(5)下列操作会导致测定纯度偏高的是_______ 。
a.加入的冷水没有煮沸过
b.滴定终点读数时仰视刻度线
c.滴定速度过慢,样品部分变质
d.溶液变为浅蓝色立即读数,很快溶液颜色恢复
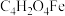 相对分子质量为170)常用于治疗缺铁性贫血,也可作食品营养强化剂。某化学兴趣小组用富马酸(HOOCCH=CHCOOH)和
相对分子质量为170)常用于治疗缺铁性贫血,也可作食品营养强化剂。某化学兴趣小组用富马酸(HOOCCH=CHCOOH)和 制备富马酸亚铁,并对其纯度进行测定,过程如下:
制备富马酸亚铁,并对其纯度进行测定,过程如下:步骤Ⅰ 富马酸亚铁晶体的制备

步骤Ⅱ 产品纯度的测定
取0.400g样品置于250mL锥形瓶中,加入15.00mL硫酸,加热溶解后冷却,再加入50.00mL新煮沸过的冷水和2滴邻二氮菲指示液,此时溶液呈红色;立即用0.1000
 的硫酸铈铵
的硫酸铈铵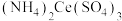 标准液滴定(还原产物为
标准液滴定(还原产物为 ),滴定终点溶液变为浅蓝色。平行测定三次,平均消耗22.00mL标准液。根据以上两个实验步骤,回答下列问题:
),滴定终点溶液变为浅蓝色。平行测定三次,平均消耗22.00mL标准液。根据以上两个实验步骤,回答下列问题:(1)合成富马酸亚铁时使用如图所示装置(加热和夹持装置略去)。

仪器A的名称是
(2)步骤Ⅱ中硫酸铈铵
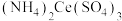 应装入
应装入(3)步骤Ⅰ中调pH最好选用的酸为
a.盐酸 b.硫酸 c.硝酸
步骤Ⅰ中调pH为6.6的目的是
(4)根据上述实验数据,测得产品的纯度是
(5)下列操作会导致测定纯度偏高的是
a.加入的冷水没有煮沸过
b.滴定终点读数时仰视刻度线
c.滴定速度过慢,样品部分变质
d.溶液变为浅蓝色立即读数,很快溶液颜色恢复
您最近一年使用:0次
名校
解题方法
2 . 已知 在
在 时溶解度最小。某工厂利用钒铬渣提取液(主要成分为
时溶解度最小。某工厂利用钒铬渣提取液(主要成分为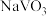 和
和 )制备
)制备 和
和 晶体,流程如下:
晶体,流程如下:
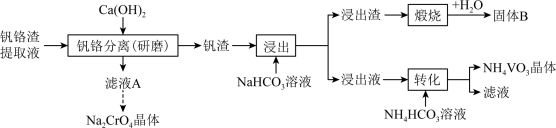
不同温度下相关物质的溶解度
(1)关于“钒铬分离”过程,下列说法正确的是_______。
(2)从滤液A中获取 晶体时,应采用的结晶方法为
晶体时,应采用的结晶方法为_______ ;残留的含铬废水不能直接排放,处理时需要经过“酸化→还原→沉降”三个步骤用 溶液还原时,还原产物为
溶液还原时,还原产物为 ,则反应的离子方程式
,则反应的离子方程式_______ 。
(3)钒渣成份是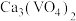 ,“浸出”过程中生成
,“浸出”过程中生成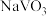 的离子方程式为
的离子方程式为_______ 。
(4)“转化”过程中选用 溶液不选用
溶液不选用 溶液的可能原因为
溶液的可能原因为_______ 。(写一条原因即可)
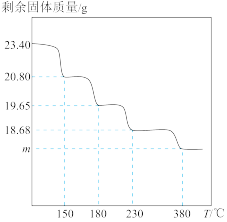
(5)该流程中可循环利用的物质有_______ 。
(6)研究表明 固体(固体的组成用
固体(固体的组成用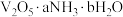 表示)热分解得到
表示)热分解得到 的过程可分为四步,每一步产生
的过程可分为四步,每一步产生 和
和 的物质的量之比依次为2∶1、3∶1、3∶2、3∶2,取
的物质的量之比依次为2∶1、3∶1、3∶2、3∶2,取 固体进行热重分析,剩余固体质量与温度关系如图,
固体进行热重分析,剩余固体质量与温度关系如图, 时剩余固体的组成可表示为:
时剩余固体的组成可表示为:_______ 。
 在
在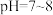 时溶解度最小。某工厂利用钒铬渣提取液(主要成分为
时溶解度最小。某工厂利用钒铬渣提取液(主要成分为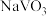 和
和 )制备
)制备 和
和 晶体,流程如下:
晶体,流程如下:
不同温度下相关物质的溶解度
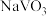 |  | 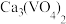 | 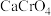 | |
 | 19.3 | 84.0 | 0.1 | 5.5 |
 | 22.5 | 96.5 | 0.09 | 2.49 |
 | 26.3 | 102 | 0.09 | 1.3 |
A.研磨可防止生成的沉淀覆在 表面,提高 表面,提高 利用率 利用率 |
| B.研磨减小了所得钒渣的粒径,提高了后续步骤中钒渣的浸出率 |
C.相对于 、 、 ,工业上更宜选用 ,工业上更宜选用 |
| D.该过程发生了氧化还原反应 |
 晶体时,应采用的结晶方法为
晶体时,应采用的结晶方法为 溶液还原时,还原产物为
溶液还原时,还原产物为 ,则反应的离子方程式
,则反应的离子方程式(3)钒渣成份是
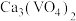 ,“浸出”过程中生成
,“浸出”过程中生成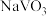 的离子方程式为
的离子方程式为(4)“转化”过程中选用
 溶液不选用
溶液不选用 溶液的可能原因为
溶液的可能原因为
(5)该流程中可循环利用的物质有
(6)研究表明
 固体(固体的组成用
固体(固体的组成用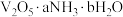 表示)热分解得到
表示)热分解得到 的过程可分为四步,每一步产生
的过程可分为四步,每一步产生 和
和 的物质的量之比依次为2∶1、3∶1、3∶2、3∶2,取
的物质的量之比依次为2∶1、3∶1、3∶2、3∶2,取 固体进行热重分析,剩余固体质量与温度关系如图,
固体进行热重分析,剩余固体质量与温度关系如图, 时剩余固体的组成可表示为:
时剩余固体的组成可表示为:
您最近一年使用:0次
23-24高三上·山东日照·期末
3 . 实验室中以活性炭为催化剂制备 并测定钴元素的含量。
并测定钴元素的含量。
已知: 是橙黄色晶体,可溶于水和稀酸、不溶于乙醇;在强碱溶液中煮沸产生
是橙黄色晶体,可溶于水和稀酸、不溶于乙醇;在强碱溶液中煮沸产生 、
、 ;
; 不易被氧化,
不易被氧化, 有较强还原性。
有较强还原性。
Ⅰ.制备晶体(装置如图1,55℃水浴加热)
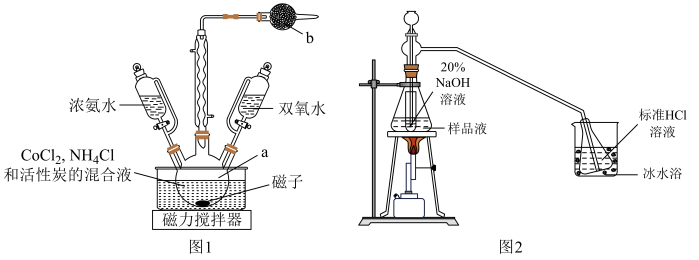
Ⅱ.测定产品 中钴元素的含量(装置如图2)
中钴元素的含量(装置如图2)
称取 样品于锥形瓶中,加水溶解。在另一锥形瓶中加入
样品于锥形瓶中,加水溶解。在另一锥形瓶中加入 标准
标准 溶液并置于冰水浴中,向漏斗中加入足量
溶液并置于冰水浴中,向漏斗中加入足量 的
的 溶液,加热,保持微沸状态一段时间后,取出插入标准
溶液,加热,保持微沸状态一段时间后,取出插入标准 溶液中的导气管,用蒸馏水冲洗导管内外,洗涤液并入装有标准
溶液中的导气管,用蒸馏水冲洗导管内外,洗涤液并入装有标准 溶液的锥形瓶中。取出锥形瓶,加入指示剂,用
溶液的锥形瓶中。取出锥形瓶,加入指示剂,用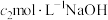 标准溶液滴定剩余的
标准溶液滴定剩余的 ,滴定终点时消耗
,滴定终点时消耗 标准溶液
标准溶液 。
。
回答下列问题:
(1) 制备
制备 的化学方程式为
的化学方程式为___________ 。
(2)仪器a的名称是___________ ;b中的试剂是___________ 。
(3)向 、
、 和活性炭混合液中先加浓氨水目的是
和活性炭混合液中先加浓氨水目的是___________ 。
(4)样品中钴元素的质量分数为___________ (用含 、
、 、
、 、
、 、
、 的代数式表示)。若缺少“蒸馏水冲洗导管内外”,会使测定结果
的代数式表示)。若缺少“蒸馏水冲洗导管内外”,会使测定结果___________ (填“偏高”“偏低”或“无影响”)。
(5)① 的空间结构为正八面体,若
的空间结构为正八面体,若 中2个
中2个 被2个
被2个 取代,能得到
取代,能得到___________ 种产物。
②钴(Ⅱ)与氯化钴和氨水以及 反应中若不加活性炭催化剂,可能有
反应中若不加活性炭催化剂,可能有 、
、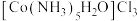 生成。现有
生成。现有 浓度为
浓度为 的
的 或
或 溶液,用
溶液,用 的
的 溶液进行滴定,消耗
溶液进行滴定,消耗 溶液
溶液 ,则该溶液中的溶质为
,则该溶液中的溶质为___________ (填化学式)。
 并测定钴元素的含量。
并测定钴元素的含量。已知:
 是橙黄色晶体,可溶于水和稀酸、不溶于乙醇;在强碱溶液中煮沸产生
是橙黄色晶体,可溶于水和稀酸、不溶于乙醇;在强碱溶液中煮沸产生 、
、 ;
; 不易被氧化,
不易被氧化, 有较强还原性。
有较强还原性。Ⅰ.制备晶体(装置如图1,55℃水浴加热)

Ⅱ.测定产品
 中钴元素的含量(装置如图2)
中钴元素的含量(装置如图2)称取
 样品于锥形瓶中,加水溶解。在另一锥形瓶中加入
样品于锥形瓶中,加水溶解。在另一锥形瓶中加入 标准
标准 溶液并置于冰水浴中,向漏斗中加入足量
溶液并置于冰水浴中,向漏斗中加入足量 的
的 溶液,加热,保持微沸状态一段时间后,取出插入标准
溶液,加热,保持微沸状态一段时间后,取出插入标准 溶液中的导气管,用蒸馏水冲洗导管内外,洗涤液并入装有标准
溶液中的导气管,用蒸馏水冲洗导管内外,洗涤液并入装有标准 溶液的锥形瓶中。取出锥形瓶,加入指示剂,用
溶液的锥形瓶中。取出锥形瓶,加入指示剂,用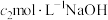 标准溶液滴定剩余的
标准溶液滴定剩余的 ,滴定终点时消耗
,滴定终点时消耗 标准溶液
标准溶液 。
。回答下列问题:
(1)
 制备
制备 的化学方程式为
的化学方程式为(2)仪器a的名称是
(3)向
 、
、 和活性炭混合液中先加浓氨水目的是
和活性炭混合液中先加浓氨水目的是(4)样品中钴元素的质量分数为
 、
、 、
、 、
、 、
、 的代数式表示)。若缺少“蒸馏水冲洗导管内外”,会使测定结果
的代数式表示)。若缺少“蒸馏水冲洗导管内外”,会使测定结果(5)①
 的空间结构为正八面体,若
的空间结构为正八面体,若 中2个
中2个 被2个
被2个 取代,能得到
取代,能得到②钴(Ⅱ)与氯化钴和氨水以及
 反应中若不加活性炭催化剂,可能有
反应中若不加活性炭催化剂,可能有 、
、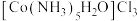 生成。现有
生成。现有 浓度为
浓度为 的
的 或
或 溶液,用
溶液,用 的
的 溶液进行滴定,消耗
溶液进行滴定,消耗 溶液
溶液 ,则该溶液中的溶质为
,则该溶液中的溶质为
您最近一年使用:0次
名校
解题方法
4 . 已知: 是重要的硫-氮二元化合物,室温下为橙黄色的固体,178~187℃熔化并分解,可用氨气与
是重要的硫-氮二元化合物,室温下为橙黄色的固体,178~187℃熔化并分解,可用氨气与 反应制得。某同学利用下图装置制取
反应制得。某同学利用下图装置制取 ,然后制取
,然后制取 。已知:
。已知: 为红棕色液体,有刺激性臭味,熔点:
为红棕色液体,有刺激性臭味,熔点: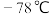 ,沸点:60℃,易水解。
,沸点:60℃,易水解。
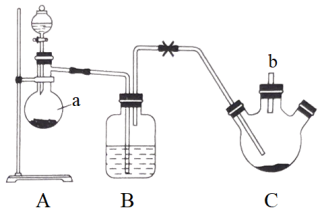
反应步骤:①反应时先向三颈烧瓶中通入干燥的氯气,使硫粉与氯气在50℃下反应生成 。
。
②待三颈烧瓶中的硫粉全部反应后,关闭B、C之间的止水夹,撤掉A、B装置。
③连接制氨气的装置,通入氨气,反应制得 。
。
试回答下列问题。
(1)仪器a的名称为_______ ,a中三氧化铬(还原产物中铬为+3价)可与浓盐酸快速反应制得氯气,写出反应的离子方程式_______ 。
(2)B装置中应选择的试剂为_______ 。制取 过程中,b导管末端应连接下图中的
过程中,b导管末端应连接下图中的_______ (填序号)。
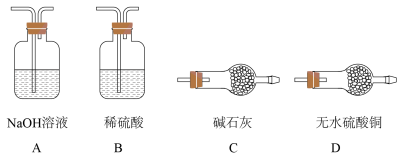
(3)向制得的 中通入
中通入 ,生成
,生成 的同时还生成一种常见固体单质和一种盐,写出反应的化学方程式
的同时还生成一种常见固体单质和一种盐,写出反应的化学方程式_______ 。所得产物分离后,检验所得盐中阳离子的具体操作步骤和现象_______ 。
(4) 在碱性条件下发生水解反应氮元素转化为氨气,用硼酸吸收,滴定氨气释放量可进一步测定
在碱性条件下发生水解反应氮元素转化为氨气,用硼酸吸收,滴定氨气释放量可进一步测定 的纯度。称取
的纯度。称取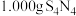 样品,加入NaOH溶液,并加热,释放出的氨气用足量
样品,加入NaOH溶液,并加热,释放出的氨气用足量 硼酸溶液吸收[反应方程式为
硼酸溶液吸收[反应方程式为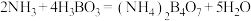 ,假定反应过程中溶液体积不变]。反应后的硼酸溶滚,以甲基红-亚甲蓝为指示剂,再用
,假定反应过程中溶液体积不变]。反应后的硼酸溶滚,以甲基红-亚甲蓝为指示剂,再用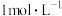 的盐酸[滴定反应方程式为
的盐酸[滴定反应方程式为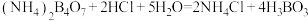 ]进行滴定,重复三次实验。实验数据记录如下表所示:
]进行滴定,重复三次实验。实验数据记录如下表所示:
则制得的 的纯度为
的纯度为_______ 。
 是重要的硫-氮二元化合物,室温下为橙黄色的固体,178~187℃熔化并分解,可用氨气与
是重要的硫-氮二元化合物,室温下为橙黄色的固体,178~187℃熔化并分解,可用氨气与 反应制得。某同学利用下图装置制取
反应制得。某同学利用下图装置制取 ,然后制取
,然后制取 。已知:
。已知: 为红棕色液体,有刺激性臭味,熔点:
为红棕色液体,有刺激性臭味,熔点: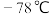 ,沸点:60℃,易水解。
,沸点:60℃,易水解。
反应步骤:①反应时先向三颈烧瓶中通入干燥的氯气,使硫粉与氯气在50℃下反应生成
 。
。②待三颈烧瓶中的硫粉全部反应后,关闭B、C之间的止水夹,撤掉A、B装置。
③连接制氨气的装置,通入氨气,反应制得
 。
。试回答下列问题。
(1)仪器a的名称为
(2)B装置中应选择的试剂为
 过程中,b导管末端应连接下图中的
过程中,b导管末端应连接下图中的
(3)向制得的
 中通入
中通入 ,生成
,生成 的同时还生成一种常见固体单质和一种盐,写出反应的化学方程式
的同时还生成一种常见固体单质和一种盐,写出反应的化学方程式(4)
 在碱性条件下发生水解反应氮元素转化为氨气,用硼酸吸收,滴定氨气释放量可进一步测定
在碱性条件下发生水解反应氮元素转化为氨气,用硼酸吸收,滴定氨气释放量可进一步测定 的纯度。称取
的纯度。称取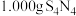 样品,加入NaOH溶液,并加热,释放出的氨气用足量
样品,加入NaOH溶液,并加热,释放出的氨气用足量 硼酸溶液吸收[反应方程式为
硼酸溶液吸收[反应方程式为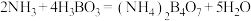 ,假定反应过程中溶液体积不变]。反应后的硼酸溶滚,以甲基红-亚甲蓝为指示剂,再用
,假定反应过程中溶液体积不变]。反应后的硼酸溶滚,以甲基红-亚甲蓝为指示剂,再用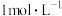 的盐酸[滴定反应方程式为
的盐酸[滴定反应方程式为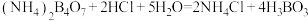 ]进行滴定,重复三次实验。实验数据记录如下表所示:
]进行滴定,重复三次实验。实验数据记录如下表所示:| 实验序号 | 初始读数 | 最终读数 |
| I | 0.10 | 20.14 |
| II | 0.50 | 24.75 |
| III | 1.00 | 20.96 |
 的纯度为
的纯度为
您最近一年使用:0次
2021-09-08更新
|
902次组卷
|
5卷引用:辽宁省朝阳市建平县实验中学2022届高三上学期第一次联考化学试题
辽宁省朝阳市建平县实验中学2022届高三上学期第一次联考化学试题福建省部分名校2021-2022学年高三上学期11月联合测评化学试题河北省石家庄市第二中学2021-2022学年高三上学期期中考试化学试题河北省衡水市2021-2022学年高三上学期三调化学试题(已下线)一轮巩固卷7-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)



