名校
1 . 乳酸亚铁晶体([CH3CH(OH)COO]2Fe·3H2O,Mr=288) 可由乳酸与FeCO3反应制得,它易溶于水,是一种很好的补铁剂。
Ⅰ.制备碳酸亚铁(装置如图所示)
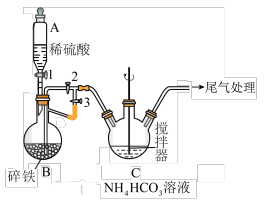
(1)仪器A的名称是______________ ;
(2)实验操作如下:关闭活塞2,打开活塞1、3,加入适量稀硫酸反应一段时间,其目的是___________________________________________________________ ;然后关闭活塞1,接下来的操作是_______________ ; 装置C中发生反应的离子方程式为______________ 。
Ⅱ.制备乳酸亚铁
向纯净的FeCO3固体中加入足量乳酸溶液,在75℃下搅拌使之充分反应。
(3)为防止乳酸亚铁变质,在上述体系中还应加入____________________________________________________________________________
(4)为证明乳酸亚铁中含有Fe2+,选择的检验试剂为_______________________________________________________________________ ;
Ⅲ. 乳酸亚铁晶体纯度的测量
经过过滤、隔绝空气低温蒸发、冷却结晶、过滤、洗涤、干燥等操作,获得乳酸亚铁晶体后
(5)两位同学分别用不同的方案进行测定:
①甲同学通过KMnO4滴定法测定样品中Fe2+的含量计算样品纯度,所得纯度总是大于100%,其原因可能是_________________________________________________________________________________________________________________
②乙同学经查阅文献后改用(NH4)4Ce(SO4)4滴定法测定样品中Fe2+的含量计算样品纯度(反应中Ce4+被还原为Ce3+),称取6.00g样品配成250.00mL溶液,取25mL,用0.1 mol•L—1(NH4)4Ce(SO4)4标准溶液滴定至终点,消耗标准液20.00mL。则产品中乳酸亚铁晶体的纯度为_______________________________________ 。
Ⅰ.制备碳酸亚铁(装置如图所示)

(1)仪器A的名称是
(2)实验操作如下:关闭活塞2,打开活塞1、3,加入适量稀硫酸反应一段时间,其目的是
Ⅱ.制备乳酸亚铁
向纯净的FeCO3固体中加入足量乳酸溶液,在75℃下搅拌使之充分反应。
(3)为防止乳酸亚铁变质,在上述体系中还应加入
(4)为证明乳酸亚铁中含有Fe2+,选择的检验试剂为
Ⅲ. 乳酸亚铁晶体纯度的测量
经过过滤、隔绝空气低温蒸发、冷却结晶、过滤、洗涤、干燥等操作,获得乳酸亚铁晶体后
(5)两位同学分别用不同的方案进行测定:
①甲同学通过KMnO4滴定法测定样品中Fe2+的含量计算样品纯度,所得纯度总是大于100%,其原因可能是
②乙同学经查阅文献后改用(NH4)4Ce(SO4)4滴定法测定样品中Fe2+的含量计算样品纯度(反应中Ce4+被还原为Ce3+),称取6.00g样品配成250.00mL溶液,取25mL,用0.1 mol•L—1(NH4)4Ce(SO4)4标准溶液滴定至终点,消耗标准液20.00mL。则产品中乳酸亚铁晶体的纯度为
您最近一年使用:0次
2019-03-07更新
|
791次组卷
|
3卷引用:【校级联考】江西省南康中学、于都中学2019届高三下学期第二次联考化学试题
【校级联考】江西省南康中学、于都中学2019届高三下学期第二次联考化学试题(已下线)《2019年高考总复习巅峰冲刺》专题10 化学实验基础应试策略黑龙江省大庆实验中学2020届高三5月综合训练(一)理综化学试题
名校
2 . 一水硫酸四氨合铜 是一种易溶于水的晶体,可作高效安全的广谱杀菌剂。回答下列问题
是一种易溶于水的晶体,可作高效安全的广谱杀菌剂。回答下列问题
Ⅰ.制备少量晶体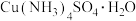 ,设计实验方案如下:
,设计实验方案如下:

(1)仪器A的名称为_____ ,对比铜和浓硫酸加热制备硫酸铜,该方案的优点是_____ 。
(2)利用溶液C制备“产物晶体”时,需用玻璃棒摩擦试管内壁的目的是_____ 。
Ⅱ.氨含量的测定。精确称取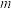 g晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入V
g晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入V 10%
10%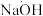 溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用
溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用

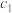
 的盐酸标准溶液完全吸收。取下接收瓶,用
的盐酸标准溶液完全吸收。取下接收瓶,用

 标准溶液滴定过剩的
标准溶液滴定过剩的 ,到终点时消耗
,到终点时消耗

 溶液。
溶液。
(3)“玻璃管2”的作用_____ ,样品中氨的质量分数的表达式_____ 。
Ⅲ.探究四氨合铜离子的性质
用所得晶体配成水溶液,取三份1 试样,分别加入0.5
试样,分别加入0.5 的水、稀硫酸、氢氧化钠溶液,实验现象记录如下:
的水、稀硫酸、氢氧化钠溶液,实验现象记录如下:
(4)上述实验现象与配位离子的解离平衡有关,请用适当的化学用语表示该配位离子的解离平衡_____ ,则加入氢氧化钠溶液后的现象为_____ 。
 是一种易溶于水的晶体,可作高效安全的广谱杀菌剂。回答下列问题
是一种易溶于水的晶体,可作高效安全的广谱杀菌剂。回答下列问题Ⅰ.制备少量晶体
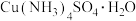 ,设计实验方案如下:
,设计实验方案如下:
(1)仪器A的名称为
(2)利用溶液C制备“产物晶体”时,需用玻璃棒摩擦试管内壁的目的是
Ⅱ.氨含量的测定。精确称取
 g晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入V
g晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入V 10%
10%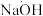 溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用
溶液,通入水蒸气,将样品液中的氨全部蒸出,并用蒸馏水冲洗导管内壁,用

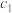
 的盐酸标准溶液完全吸收。取下接收瓶,用
的盐酸标准溶液完全吸收。取下接收瓶,用

 标准溶液滴定过剩的
标准溶液滴定过剩的 ,到终点时消耗
,到终点时消耗

 溶液。
溶液。
(3)“玻璃管2”的作用
Ⅲ.探究四氨合铜离子的性质
用所得晶体配成水溶液,取三份1
 试样,分别加入0.5
试样,分别加入0.5 的水、稀硫酸、氢氧化钠溶液,实验现象记录如下:
的水、稀硫酸、氢氧化钠溶液,实验现象记录如下:| 加入试剂 | 水 | 稀硫酸 | 氢氧化钠 |
| 现象 | 几乎无变化 | 溶液颜色变成浅蓝色,与同浓度硫酸铜颜色相当 |
您最近一年使用:0次
2023-08-16更新
|
266次组卷
|
3卷引用:江西省吉安市万安中学2023-2024学年高三上学期开学考试化学试题
江西省吉安市万安中学2023-2024学年高三上学期开学考试化学试题湖北省武汉部分重点高中2023-2024学年高三上学期8月联考化学试题(已下线)化学(九省联考考后提升卷,广西卷)-2024年1月“九省联考”真题完全解读与考后提升
解题方法
3 . 已知;S4N4是重要的硫-氮二元化合物,室温下为橙黄色的固体,178~187℃熔化并分解,可用氨气与SCl2反应制得。某同学利用如图装置制取SCl2,然后制取S4N4。已知:SCl2为红棕色液体,有刺激性臭味,熔点:-78℃,沸点:60℃,易水解。
反应步骤:①反应时先向三颈烧瓶中通入干燥的氯气,使硫粉与氯气在50℃下反应生成SCl2。
②待三颈烧瓶中的硫粉全部反应后,关闭B、C之间的止水夹,撤掉A、B装置。
③连接制氨气的装置,通入氨气,反应制得S4N4。
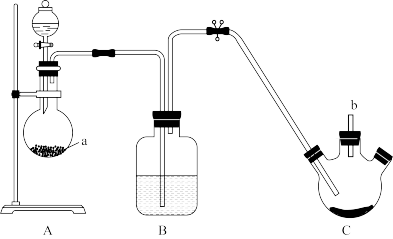
试回答下列问题。
(1)仪器a的名称为___________ ,a中次氯酸钙可与浓盐酸反应制备氯气,写出反应的化学方程式___________ 。
(2)B装置中应选择的试剂为___________ 。
(3)制取SCl2过程中,b导管末端连接装有碱石灰的干燥管,其作用是___________ 。
(4)向制得的SCl2中通入NH3,生成S4N4的同时还生成一种常见固体单质和一种盐,写出反应的化学方程式___________ 。所得产物分离后,检验所得盐中阳离子的具体操作步骤和现象___________ 。
(5)S4N4在碱性条件下发生水解反应氮元素转化为氨气,用硼酸吸收,滴定氨气释放量可进一步测定S4N4的纯度。称取5.00gS4N4;样品,加入NaOH溶液,并加热,释放出的氨气用足量100mL1.00mol·L-1硼酸溶液吸收[反应方程式为2NH3+4H3BO3=(NH4)2B4O7+5H2O,假定反应过程中溶液体积不变]。取反应后的硼酸溶液25.00mL,以甲基红-亚甲蓝为指示剂,再用1.00mol·L-1的盐酸[滴定反应方程式为(NH4)2B4O7+2HCl+5H2O =2NH4Cl+4H3BO3]进行滴定,达到滴定终点时消耗盐酸体积为20.00mL。则制得的S4N4的纯度为___________ 。
(6)下列实验操作可能使S4N4测定结果偏低的是___________ 。
A.滴定时未用盐酸标准溶液润洗滴定管
B.滴定前滴定管尖嘴处无气泡,滴定结束后产生气泡
C.读数时,滴定前平视,滴定后仰视
反应步骤:①反应时先向三颈烧瓶中通入干燥的氯气,使硫粉与氯气在50℃下反应生成SCl2。
②待三颈烧瓶中的硫粉全部反应后,关闭B、C之间的止水夹,撤掉A、B装置。
③连接制氨气的装置,通入氨气,反应制得S4N4。

试回答下列问题。
(1)仪器a的名称为
(2)B装置中应选择的试剂为
(3)制取SCl2过程中,b导管末端连接装有碱石灰的干燥管,其作用是
(4)向制得的SCl2中通入NH3,生成S4N4的同时还生成一种常见固体单质和一种盐,写出反应的化学方程式
(5)S4N4在碱性条件下发生水解反应氮元素转化为氨气,用硼酸吸收,滴定氨气释放量可进一步测定S4N4的纯度。称取5.00gS4N4;样品,加入NaOH溶液,并加热,释放出的氨气用足量100mL1.00mol·L-1硼酸溶液吸收[反应方程式为2NH3+4H3BO3=(NH4)2B4O7+5H2O,假定反应过程中溶液体积不变]。取反应后的硼酸溶液25.00mL,以甲基红-亚甲蓝为指示剂,再用1.00mol·L-1的盐酸[滴定反应方程式为(NH4)2B4O7+2HCl+5H2O =2NH4Cl+4H3BO3]进行滴定,达到滴定终点时消耗盐酸体积为20.00mL。则制得的S4N4的纯度为
(6)下列实验操作可能使S4N4测定结果偏低的是
A.滴定时未用盐酸标准溶液润洗滴定管
B.滴定前滴定管尖嘴处无气泡,滴定结束后产生气泡
C.读数时,滴定前平视,滴定后仰视
您最近一年使用:0次
解题方法
4 . POCl3遇水强烈水解: ,是一种重要的化工原料。某兴趣小组准备在实验室中进行POC13制备实验。
,是一种重要的化工原料。某兴趣小组准备在实验室中进行POC13制备实验。
(1)小组同学在如图装置中分别加入三氯化磷、氧气、二氧化硫来制备POC13,产物中还有一种遇水强烈水解的物质SOCl2,写出SOCl2水解的化学方程式:______ 。

(2)仪器乙的名称为______ 。
(3)反应温度需控制在60~65℃,应采取的加热方法为______ ,温度不能过高或过低的原因是______ 。
(4)小组同学查阅资料后,用以下方法测定POCl3含量:准确称取4.00 g POCl3样品溶于水中(杂质不参与反应),加水稀释至250.00mL;取25.00mL溶液置于锥形瓶中,滴加几滴甲基橙作指示剂,用0.60mol·L-1NaOH标准溶液滴定,当滴定至终点时,溶质为NaCl和NaH2PO4,共用去NaOH标准溶液16.00mL。已知常温时,0.1mol·L-1下列溶液的pH如下表:
①滴定终点时的现象为______ 。
②滴定中若改用酚酞为指示剂,则滴定至终点时,溶液中溶质主要为______ ;此时消耗0.60mol·L-1NaOH标准溶液的体积为______ mL。
③产品中POCl3的百分含量为______ 。
 ,是一种重要的化工原料。某兴趣小组准备在实验室中进行POC13制备实验。
,是一种重要的化工原料。某兴趣小组准备在实验室中进行POC13制备实验。(1)小组同学在如图装置中分别加入三氯化磷、氧气、二氧化硫来制备POC13,产物中还有一种遇水强烈水解的物质SOCl2,写出SOCl2水解的化学方程式:

(2)仪器乙的名称为
(3)反应温度需控制在60~65℃,应采取的加热方法为
(4)小组同学查阅资料后,用以下方法测定POCl3含量:准确称取4.00 g POCl3样品溶于水中(杂质不参与反应),加水稀释至250.00mL;取25.00mL溶液置于锥形瓶中,滴加几滴甲基橙作指示剂,用0.60mol·L-1NaOH标准溶液滴定,当滴定至终点时,溶质为NaCl和NaH2PO4,共用去NaOH标准溶液16.00mL。已知常温时,0.1mol·L-1下列溶液的pH如下表:
| 溶液 | Na3PO4 | Na2HPO4 | NaH2PO4 |
| pH | 12.67 | 9.73 | 4.66 |
②滴定中若改用酚酞为指示剂,则滴定至终点时,溶液中溶质主要为
③产品中POCl3的百分含量为
您最近一年使用:0次
解题方法
5 . 环己烯是合成赖氨酸、环己酮、苯酚等的重要原料,也常用作石油萃取剂及高辛烷值汽油稳定剂。
(一)制备环己烯的反应原理:
主反应: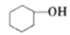

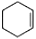 +H2O
+H2O
副反应:2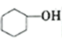

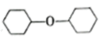 +H2O
+H2O
(二)查阅实验所涉及的反应物、催化剂、产物的各种物理性质,列表如下:
(三)实验流程

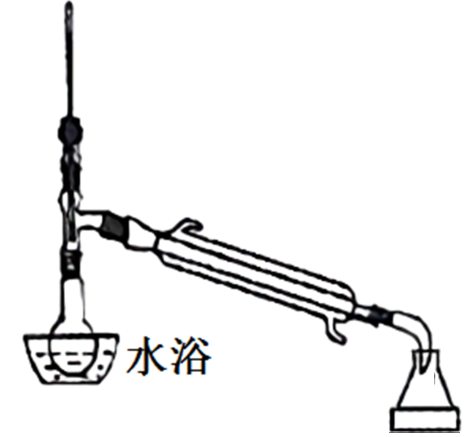
(四)制备环己烯的实验装置图如图(夹持装置及加热装置已省略):
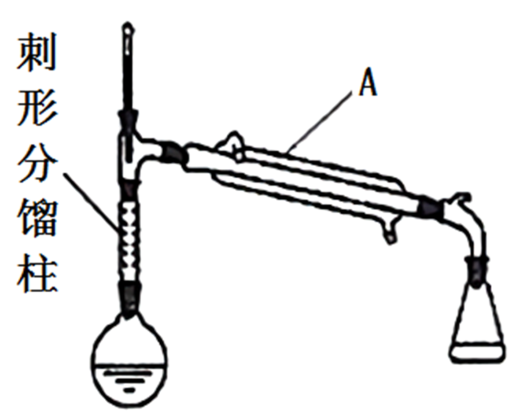
请回答:
(1)仪器A的名称是______ 。
(2)实验中不用浓硫酸,而用85% H3PO4溶液,说明理由_______ 。(写出一条即可)
(3)文献资料要求本实验的反应温度接近但又不超过90℃,根据图表数据分析其原因是_____ 。
(4)将较纯净环己烯样品按如图装置蒸馏,蒸馏时要加入生石灰,目的是____ 。
(5)在定条件下,向8.2 g环己烯样品中加入0.1 mol Br2,与环己烯充分反应后,剩余的Br2与足量KI作用生I2,用0.1 mol/L的Na2S2O3标准溶液滴定,发生反应:I2+2S2O = S4O
= S4O +2I-。终点时消耗Na2S2O3标准溶液40. 00ml (以上数据均已扣除干扰因素):
+2I-。终点时消耗Na2S2O3标准溶液40. 00ml (以上数据均已扣除干扰因素):
①滴定所用指示剂为______ , 样品中环己烯的质量分数为____ 。
②下列情况会导致测定结果偏低的是____ (填序号)。
a.在测定过程中部分环己烯挥发
b.样品中含有苯酚杂质
c.Na2S2O3标准溶液部分被氧化
d.滴定后读数时,俯视刻度线
(一)制备环己烯的反应原理:
主反应:


 +H2O
+H2O副反应:2


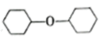 +H2O
+H2O(二)查阅实验所涉及的反应物、催化剂、产物的各种物理性质,列表如下:
| 沸点/℃ | 密度/(g· cm3) | 水中溶解性 | |
| 环己醇 | 161 | 0.962 4 | 可溶于水 |
| 环己烯 | 83 | 0.811 | 微溶于水 |
| 85%H3PO4溶液 | 1.69 | 易溶于水 | |
| 环己烯与水形成的共沸物(含水10%) | 70.8 | ||
| 环己醇与水形成的共沸物(含水80%) | 97.8 |

(四)制备环己烯的实验装置图如图(夹持装置及加热装置已省略):

请回答:
(1)仪器A的名称是
(2)实验中不用浓硫酸,而用85% H3PO4溶液,说明理由
(3)文献资料要求本实验的反应温度接近但又不超过90℃,根据图表数据分析其原因是
(4)将较纯净环己烯样品按如图装置蒸馏,蒸馏时要加入生石灰,目的是

(5)在定条件下,向8.2 g环己烯样品中加入0.1 mol Br2,与环己烯充分反应后,剩余的Br2与足量KI作用生I2,用0.1 mol/L的Na2S2O3标准溶液滴定,发生反应:I2+2S2O
 = S4O
= S4O +2I-。终点时消耗Na2S2O3标准溶液40. 00ml (以上数据均已扣除干扰因素):
+2I-。终点时消耗Na2S2O3标准溶液40. 00ml (以上数据均已扣除干扰因素):①滴定所用指示剂为
②下列情况会导致测定结果偏低的是
a.在测定过程中部分环己烯挥发
b.样品中含有苯酚杂质
c.Na2S2O3标准溶液部分被氧化
d.滴定后读数时,俯视刻度线
您最近一年使用:0次
名校
解题方法
6 . 亚氯酸钠(NaClO2)是一种应用广泛的高效氧化型漂白剂。以下是某小组模拟工业制法利用ClO2与H2O2在碱性条件下制备少量NaClO2的实验装置:
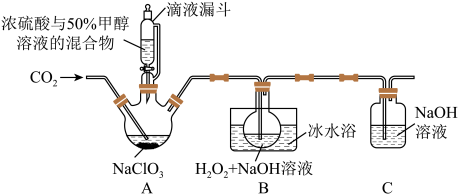
已知:(1)硫酸作酸化剂时,甲醇(CH3OH)可将NaClO3还原为ClO2。
(2)ClO2沸点为9.9℃,可溶于水,有毒,气体中ClO2浓度较高时易发生爆炸。
(3)饱和NaClO2溶液在温度低于38℃时析出晶体NaClO2•3H2O,在温度高于38℃时析出晶体NaClO2,高于60℃时分解生成NaClO3和NaCl。
回答下列问题:
(1)实验前用浓硫酸与50%甲醇溶液配制混合溶液的操作是:___________ 。
(2)实验过程中需要持续通入CO2的主要目的,一是可以起到搅拌作用,二是___________ 。
(3)装置A中,若氧化产物为CO2,则氧化剂与还原剂的物质的量之比为___________ 。
(4)装置B中生成NaClO2的化学方程式是____ 。
(5)从反应后的B溶液中制得NaClO2晶体的操作步骤是:a.___ ;b._____ ;c.用38~60℃的热水洗涤;d.在低于60oC的真空中蒸发,干燥。
(6)装置C中C1O2与NaOH溶液反应生成等物质的量的两种钠盐,其中一种为NaClO2,装置C中C1O2与NaOH溶液反应的化学方程式为______ 。
(7)NaClO2纯度测定:①称取所得NaClO2样品1.000g于烧杯中,加入适量蒸馏水过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(C1O2-的还原产物为Cl-),将所得混合液配成250mL待测溶液;②取25.00mL待测液,用0.2000mol/LNa2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,判断达到滴定终点时的现象为_____ 。重复滴定3次,测得Na2S2O3标准液平均用量为18.00mL,则该样品中NaClO2的质量分数为____________ 。

已知:(1)硫酸作酸化剂时,甲醇(CH3OH)可将NaClO3还原为ClO2。
(2)ClO2沸点为9.9℃,可溶于水,有毒,气体中ClO2浓度较高时易发生爆炸。
(3)饱和NaClO2溶液在温度低于38℃时析出晶体NaClO2•3H2O,在温度高于38℃时析出晶体NaClO2,高于60℃时分解生成NaClO3和NaCl。
回答下列问题:
(1)实验前用浓硫酸与50%甲醇溶液配制混合溶液的操作是:
(2)实验过程中需要持续通入CO2的主要目的,一是可以起到搅拌作用,二是
(3)装置A中,若氧化产物为CO2,则氧化剂与还原剂的物质的量之比为
(4)装置B中生成NaClO2的化学方程式是
(5)从反应后的B溶液中制得NaClO2晶体的操作步骤是:a.
(6)装置C中C1O2与NaOH溶液反应生成等物质的量的两种钠盐,其中一种为NaClO2,装置C中C1O2与NaOH溶液反应的化学方程式为
(7)NaClO2纯度测定:①称取所得NaClO2样品1.000g于烧杯中,加入适量蒸馏水过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(C1O2-的还原产物为Cl-),将所得混合液配成250mL待测溶液;②取25.00mL待测液,用0.2000mol/LNa2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,判断达到滴定终点时的现象为
您最近一年使用:0次
2020-05-12更新
|
263次组卷
|
3卷引用:江西省鹰潭市2020-2021学年高二上学期期末质量检测化学试题
名校
7 . 亚硝酸钠(NaNO2)是一种工业盐,实验室可用如下装置(略去部分夹持仪器)制备。

已知:①2NO+Na2O2=2NaNO2; ②3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O;③酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+;Na2O2能使酸性高锰酸钾溶液褪色。
(1)加热装置A前,先通一段时间N2,目的是_______________ 。
(2)装置A中发生反应的化学方程式为__________________________________ 。实验结束后,将B瓶中的溶液经蒸发浓缩、__________ (填操作名称)、过滤可获得CuSO4·5H2O。
(3)仪器C的名称为______________ ,其中盛放的药品为 ____________ (填名称)。
(4)充分反应后,检验装置D中产物的方法是:取产物少许置于试管中,________________ ,则产物是NaNO2(注明试剂、现象)。
(5)为测定亚硝酸钠的含量,称取4.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:

①第一组实验数据出现异常,造成这种异常的原因可能是_________ (填代号)。
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶洗净后未干燥
c.滴定终点时仰视读数
②根据表中数据,计算所得固体中亚硝酸钠的质量分数__________ 。

已知:①2NO+Na2O2=2NaNO2; ②3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O;③酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+;Na2O2能使酸性高锰酸钾溶液褪色。
(1)加热装置A前,先通一段时间N2,目的是
(2)装置A中发生反应的化学方程式为
(3)仪器C的名称为
(4)充分反应后,检验装置D中产物的方法是:取产物少许置于试管中,
(5)为测定亚硝酸钠的含量,称取4.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:

①第一组实验数据出现异常,造成这种异常的原因可能是
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶洗净后未干燥
c.滴定终点时仰视读数
②根据表中数据,计算所得固体中亚硝酸钠的质量分数
您最近一年使用:0次
2017-10-07更新
|
705次组卷
|
5卷引用:江西省横峰中学、铅山一中、德兴一中2018届高三上学期第一次月考化学试题



