名校
1 . 下列物质性质与用途对应的离子方程式书写正确的是
A.H2O2氧化海带灰酸性浸出液提取碘: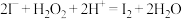 |
B.Na2O2与水反应用作潜水艇氧气来源: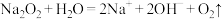 |
C.绿矾处理含 的酸性废水: 的酸性废水: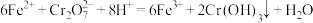 |
D.向NaHSO4溶液中加入足量Ba(OH)2溶液: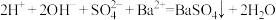 |
您最近一年使用:0次
解题方法
2 . 海带中含有碘元素。从海带中提取碘的部分过程如图所示,其中操作X表示

| A.萃取分液 | B.升华 | C.蒸发结晶 | D.趁热过滤 |
您最近一年使用:0次
解题方法
3 . 下列说法正确的是
| A.燃煤中加入石灰,可减少酸雨和温室效应 |
| B.酸性的降水称为酸雨,酸雨都是由硫氧化物造成的。 |
| C.84消毒液与洁厕灵混合使用,效果更好 |
| D.海带提取碘的过程中,将碘的四氯化碳溶液蒸馏,可获得碘单质。 |
您最近一年使用:0次
名校
解题方法
4 . Ⅰ.海带中含有丰富的碘,从海带中提取碘,某学习小组设计并进行以下实验:__________ (填操作名称),此过程使用玻璃棒,玻璃棒的作用是______________ 。
(2)步骤④反应的离子方程式为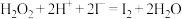 。该离子反应的氧化剂是
。该离子反应的氧化剂是____________ ,还原剂是__________ 。
(3)向步骤④得到的含碘水溶液中滴加淀粉溶液,溶液呈现________ 色,说明有碘单质产生。
Ⅱ.碘被称为“智力元素”。以前食盐中常加入KI作为加碘剂,但空气中氧气的作用容易引起碘的损失, 被氧气氧化成碘单质
被氧气氧化成碘单质 ,同时得到强碱性物质。
,同时得到强碱性物质。
(4)写出潮湿环境下KI与氧气反应的化学方程式:______________ 。
Ⅲ.现在的食盐里改添加性质稳定的 ,以满足人们需要。几种粒子之间有如下所示关系:
,以满足人们需要。几种粒子之间有如下所示关系:__________ (填序号)。
(2)步骤④反应的离子方程式为
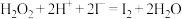 。该离子反应的氧化剂是
。该离子反应的氧化剂是(3)向步骤④得到的含碘水溶液中滴加淀粉溶液,溶液呈现
Ⅱ.碘被称为“智力元素”。以前食盐中常加入KI作为加碘剂,但空气中氧气的作用容易引起碘的损失,
 被氧气氧化成碘单质
被氧气氧化成碘单质 ,同时得到强碱性物质。
,同时得到强碱性物质。(4)写出潮湿环境下KI与氧气反应的化学方程式:
Ⅲ.现在的食盐里改添加性质稳定的
 ,以满足人们需要。几种粒子之间有如下所示关系:
,以满足人们需要。几种粒子之间有如下所示关系:
您最近一年使用:0次
2024-10-31更新
|
71次组卷
|
2卷引用:广东省江门市培英高级中学2024-2025学年高一上学期期中考试 化学试题
解题方法
5 . 海带中含有碘元素,从海带中提取碘的实验过程如图所示:

| A.海带中碘元素以I2形式存在 |
| B.操作①可除去海带中的有机物 |
| C.操作③为过滤,操作⑥为萃取 |
| D.操作⑤用到的玻璃仪器有普通漏斗 |
您最近一年使用:0次
2024-09-19更新
|
135次组卷
|
2卷引用:广东省深圳市2025届高三上学期9月联考化学试题
解题方法
6 . 用滴定法测定海带中碘元素含量,主要步骤包括:称量、灰化、过滤、氧化、配制含碘待测液(250 mL)、滴定等。下列仪器使用不正确的是
|
|
| A.称量 | B.灰化 |
|
|
| C.过滤 | D.配制待测液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
7 . “科技兴国,高质量发展”一直是我国建设现代化国家的重要战略方针。下列说法不正确的是
| A.“中国芯”的主要成分是高纯硅 |
| B.“海水中提取碘单质”的过程中不涉及氧化还原反应 |
| C.二氧化碳可用于人工合成淀粉,二氧化碳固体属于分子晶体 |
| D.“神舟十六号”推进器使用的氧化剂是N2O4,其中N是第ⅤA族元素 |
您最近一年使用:0次
2024-08-28更新
|
97次组卷
|
2卷引用:广东省深圳市南山区2023-2024学年高三上学期期末考试化学试题
名校
8 . 碘在科研与生活中有重要作用。
Ⅰ.实验室按如下实验流程提取海带中的碘。___________ (从下列图中选择,写出名称)。___________ 。
(3)海带灰中含有的其他可溶性无机盐,是在___________ (从以上流程中选填实验操作名称)中实现与碘分离。
Ⅱ.测定反应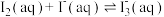 的平衡常数K
的平衡常数K
常温下,取2个碘量瓶分别加入下表中的药品,振荡半小时,均有少量固体不溶。取一定体积的上层清液,加入淀粉作指示剂,用c1 mol L-1 Na2S2O3溶液进行滴定(发生反应
L-1 Na2S2O3溶液进行滴定(发生反应 ),测定
),测定 和
和 的总浓度,进而可以测得K。
的总浓度,进而可以测得K。
(注:在本实验中,认为碘在水中和KI溶液中达到饱和时,它们的碘分子浓度c(I2)相等)
(4)Na2S2O3溶液也可以滴定 的原因是
的原因是___________ (用平衡移动原理回答);滴定终点的实验现象为___________ 。
(5)实验I中,c( )=
)=___________ mol/L(用含c1、c2、c3或c4的式子表示,下同),反应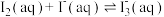 的平衡常数K=
的平衡常数K=___________ 。
(6)若所加的碘偏少,导致实验I中碘量瓶振荡半小时后无固体剩余(不饱和),而实验Ⅱ的碘量瓶中仍有固体不溶,则测得的K将___________ (填“偏大”、“偏小”或“无影响”)。
Ⅰ.实验室按如下实验流程提取海带中的碘。


(3)海带灰中含有的其他可溶性无机盐,是在
Ⅱ.测定反应
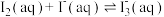 的平衡常数K
的平衡常数K常温下,取2个碘量瓶分别加入下表中的药品,振荡半小时,均有少量固体不溶。取一定体积的上层清液,加入淀粉作指示剂,用c1 mol
 L-1 Na2S2O3溶液进行滴定(发生反应
L-1 Na2S2O3溶液进行滴定(发生反应 ),测定
),测定 和
和 的总浓度,进而可以测得K。
的总浓度,进而可以测得K。(注:在本实验中,认为碘在水中和KI溶液中达到饱和时,它们的碘分子浓度c(I2)相等)
| 碘量瓶 (实验Ⅰ) | 碘量瓶 (实验Ⅱ) | |
| 药品 | 0.5 g研细的碘,100 mL c2 mol L-1 KI L-1 KI | 0.5 g研细的碘,100 mL H2O |
| I2和I3-的总浓度 | c3 mol L-1 L-1 | c4 mol L-1 L-1 |
 的原因是
的原因是(5)实验I中,c(
 )=
)=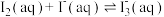 的平衡常数K=
的平衡常数K=(6)若所加的碘偏少,导致实验I中碘量瓶振荡半小时后无固体剩余(不饱和),而实验Ⅱ的碘量瓶中仍有固体不溶,则测得的K将
您最近一年使用:0次
2024-04-24更新
|
286次组卷
|
2卷引用:广东省广州市五校(省实、广雅、执信、二中、六中)2023-2024学年高二上学期期末联考化学试题
解题方法
9 . 碘是生物必需的一种微量元素,海带、海藻等食物含碘量最为丰富.某小组通过实验提取并测定干海带中碘的含量.回答下列问题:
Ⅰ.从海带中提取碘.该小组同学按如图实验流程进行实验:______ (填仪器名称)。______ (用离子方程式表示)。
Ⅱ.滴定法测海带中碘的含量。
用 滴定
滴定 的水溶液,淀粉溶液作指示剂。原理为:
的水溶液,淀粉溶液作指示剂。原理为: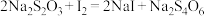 ,
,
(3)用酸式滴定管量取 的水溶液时常需要排出气泡,操作是
的水溶液时常需要排出气泡,操作是__________ 。
(4)小组同学进行了实验测定,在滴定终点附近,反复变回蓝色,一直测不到终点。
猜想1:碘离子被______ 氧化;
猜想2:碘离子被步骤iii中过量的 氧化;
氧化;
②验证猜想
③查阅资料 小组同学认为可能是反应速率不同造成的, 氧化
氧化 的速率
的速率______ (填“快于”或“慢于”) 还原
还原 的速率,导致待测液反复变为蓝色。
的速率,导致待测液反复变为蓝色。
④优化设计 鉴于反应终点无法到达的问题,请提出合理的修正方案____________ 。
⑤完成实验 小组同学修正方案后,取5.000 g干海带进行测定,消耗15.75 mL
 溶液,则干海带中碘的含量为
溶液,则干海带中碘的含量为______ mg/g(保留2位有效数字)。
Ⅰ.从海带中提取碘.该小组同学按如图实验流程进行实验:

Ⅱ.滴定法测海带中碘的含量。
用
 滴定
滴定 的水溶液,淀粉溶液作指示剂。原理为:
的水溶液,淀粉溶液作指示剂。原理为: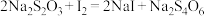 ,
,(3)用酸式滴定管量取
 的水溶液时常需要排出气泡,操作是
的水溶液时常需要排出气泡,操作是(4)小组同学进行了实验测定,在滴定终点附近,反复变回蓝色,一直测不到终点。

猜想1:碘离子被
猜想2:碘离子被步骤iii中过量的
 氧化;
氧化;②验证猜想
| 序号 | 实验操作 | 实验现象 | 结论 |
| 1 | 取少量原海带浸出液,加入硫酸酸化,再滴加几滴淀粉溶液,鼓入空气 | 待测液始终保持无色 | 猜想1不成立 |
| 2 | 将2mL KI溶液、2滴 KI溶液、2滴  溶液、2滴淀粉溶液和1滴 溶液、2滴淀粉溶液和1滴  溶液混合配制待测液,用 溶液混合配制待测液,用 溶液滴定 溶液滴定 | 猜想2不成立 |
 氧化
氧化 的速率
的速率 还原
还原 的速率,导致待测液反复变为蓝色。
的速率,导致待测液反复变为蓝色。④优化设计 鉴于反应终点无法到达的问题,请提出合理的修正方案
⑤完成实验 小组同学修正方案后,取5.000 g干海带进行测定,消耗15.75 mL

 溶液,则干海带中碘的含量为
溶液,则干海带中碘的含量为
您最近一年使用:0次
2024-03-22更新
|
858次组卷
|
3卷引用:广东省佛山市2024届高三教学质量检测(一)化学试题
名校
解题方法
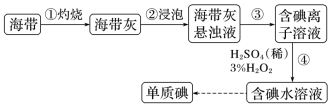
10 . 海洋中蕴含着丰富的化学元素,是人类资源的宝库。
I.某学校兴趣小组在实验室按如下实验流程提取海带中的碘。

(1)海带灼烧的目的是___________ 。海带灰中含有的其他可溶性无机盐,是在___________ (从以上流程中选填实验操作名称)中实现与碘分离。上述实验流程中不需要用到的仪器是___________ (从下列图中选择,写出名称)。

(2)“氧化”时加入3mol·L-1H2SO4和3%H2O2溶液,发生反应的离子方程式为___________ 。
(3)加碘食盐中的碘以KIO3形式存在,证明食盐中存在IO ,必须使用的物质是
,必须使用的物质是___________ (填序号)。
①pH试纸 ②蓝色石蕊试纸 ③碘化钾淀粉试纸 ④蒸馏水 ⑤食醋 ⑥醇
Ⅱ.某学校兴趣小组从海水晒盐后的盐卤(含MgCl2、NaCl、KCl、MgSO4等)中模拟工业生产来提取镁,主要过程如图甲:
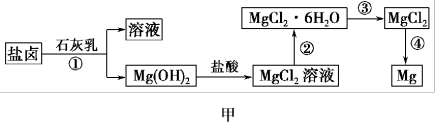
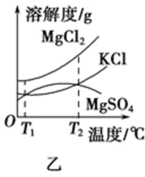
(4)图乙是盐卤中某些物质的溶解度曲线,将盐卤加热到T2℃以上,根据溶解度曲线,首先从盐卤中分离出来的晶体是___________ 。步骤③的具体操作为___________ 。
(5)写出步骤④制备金属镁的化学方程式:___________ 。该过程得到的镁蒸气需要在特定的循环中冷却,可选用___________ (填字母)作冷却剂。
A.Ar B.CO2 C.空气 D.O2 E.水蒸气
I.某学校兴趣小组在实验室按如下实验流程提取海带中的碘。

(1)海带灼烧的目的是

(2)“氧化”时加入3mol·L-1H2SO4和3%H2O2溶液,发生反应的离子方程式为
(3)加碘食盐中的碘以KIO3形式存在,证明食盐中存在IO
 ,必须使用的物质是
,必须使用的物质是①pH试纸 ②蓝色石蕊试纸 ③碘化钾淀粉试纸 ④蒸馏水 ⑤食醋 ⑥醇
Ⅱ.某学校兴趣小组从海水晒盐后的盐卤(含MgCl2、NaCl、KCl、MgSO4等)中模拟工业生产来提取镁,主要过程如图甲:

(4)图乙是盐卤中某些物质的溶解度曲线,将盐卤加热到T2℃以上,根据溶解度曲线,首先从盐卤中分离出来的晶体是

(5)写出步骤④制备金属镁的化学方程式:
A.Ar B.CO2 C.空气 D.O2 E.水蒸气
您最近一年使用:0次