2016届内蒙古赤峰市高三上学期期末考试化学试卷
内蒙古
高三
期末
2017-07-27
329次
整体难度:
适中
考查范围:
认识化学科学、有机化学基础、化学实验基础、物质结构与性质、化学反应原理、常见无机物及其应用
一、单选题 添加题型下试题
| A.甘油加水作护肤剂 |
| B.用明矾净化水 |
| C.烹鱼时加入少量的料酒和食醋可减少腥味,增加香味 |
| D.烧菜用过的铁锅,经放置常出现红棕色斑迹 |
| A.13.8gNO2与足量水反应,转移电子数为0.2NA |
| B.标准状况下,22.4L溴苯中含有氢原子数为5NA |
| C.500mL 2 mol/LNH4NO3溶液中,含有NH4+数为NA |
| D.用惰性电极电解足量CuSO4溶液,生成22.4L气体时转移电子数为4NA |
【知识点】 化学计量

| A.M的分子式为C11H12O3 |
| B.能使溴的四氯化碳溶液褪色 |
| C.一定条件下,M能生成高分子化合物 |
| D.能发生加成反应不能发生取代反应 |
| A.乙醇能够使酸性KMnO4溶液和酸性K2Cr2O7溶液褪色均被氧化成乙酸 |
| B.向酸性高锰酸钾中加入草酸溶液,随着反应的进行,反应速率逐渐减小 |
| C.向某溶液中滴加BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该溶液中存在SO42-或SO32- |
| D.实验室提纯混有少里氯化钠的硝酸钾,通常采用重结晶的方法 |
【知识点】 化学实验基础
| A.水电离的c(H+)=1×10-3mol/L的溶液中:K+、Na+、SiO32-、SO42- |
| B.能使石蕊呈蓝色的溶液中:Na+、Fe3+、SO42-、Cl- |
C. 的溶液中:Ba2+、ClO-、Cl-、NO3- 的溶液中:Ba2+、ClO-、Cl-、NO3- |
| D.能与Al 反应放出H2的溶液中:Fe2+、K+、SO42-、Cl- |
【知识点】 离子共存
| A.原子半径由小到大的顺序为Y<Z<X<W |
| B.X的简单氧化物的热稳定性比W的强 |
| C.化合物YX、ZX2、WX3中化学键的类型相同 |
| D.W的最高价氧化物对应水化物的酸性比Z的弱 |
【知识点】 元素周期表 元素周期律
| A.25℃时,FeS、ZnS、CuS的溶解度依次增大 |
| B.ZnS饱和溶液这加入少量Na2S固体,平衡后溶液中c(Zn2+)·c(S2-)=Ksp,c(Zn2+)=c(S2-) |
| C.除去工业废水中的Cu2+,可用FeS作为沉淀剂 |
| D.某溶液中含有Fe2+、Cu2+和Zn2+,浓度均为0.010mol/L。向该溶液中逐滴加入0.010mol/L的Na2S溶液时,Fe2+最先沉淀出来 |
【知识点】 化学平衡

| A.利用I、II装置制取气体(K2关闭、K1打开),可以收集H2等气体,但不能收集O2、NO气体 |
| B.利用II装置作简单改进(但不改变瓶口朝向)后,可以收集O2、NO等气体,但不能收集NO2气体 |
| C.利用I、Ⅲ装置可以比较H2SO4、H2CO3和H2SiO3的酸性强弱 |
| D.利用I、Ⅲ装置既能验证氧化性:Ca(ClO)2>Cl2>Br2,又能保护环境 |
【知识点】 化学实验基础
| A.可用纤维素的水解产物制取乙醇 |
| B.己烷(C6H14)有四种同分异构体 |
| C.乙烯、聚氯乙烯和苯分子中均含有碳碳双键 |
| D.糖类、油脂和蛋白质均可发生水解反应 |
【知识点】 烃的衍生物
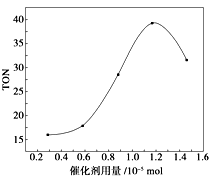
| A.由甲醇和CO2直接合成碳酸二甲酯,可以利用价廉易得的甲醇把影响环境的温室气体CO2转化为资源,在资源循环利用和环境保护方面都具有重要意义 |
| B.在反应体系中添加合适的吸水剂,将提高该反应的TON |
| C.当催化剂用量为1.2×10-5mol时,该反应的TON 达到最高点 |
| D.当催化剂用量高于1.2×10-5mol时,随着催化剂用量的增加,甲醇的平衡转化率逐渐降低 |
【知识点】 化学平衡的移动及其影响因素 化学平衡图像分析
| A.NF3是氧化剂,H2O是还原剂 |
| B.还原剂与氧化剂的物质的量之比为2∶1 |
| C.若生成0.2 mol HNO3,则转移0.2 mol 电子 |
| D.NF3在潮湿的空气中泄漏会产生红棕色气体 |
【知识点】 氧化还原反应的应用 氧化还原反应有关计算 氧化还原反应的规律解读
 Na2S4+3NaBr,下列说法正确的是
Na2S4+3NaBr,下列说法正确的是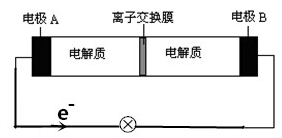
| A.放电时,钠离子从右到左通过离子交换膜 |
| B.放电时,负极反应为3NaBr-2e-=NaBr3+2Na+ |
| C.充电时,A极应与直流电源负极相连接 |
| D.放电时,当有0.1molNa+通过离子交换膜时,B极上有0.3molNaBr产生 |
【知识点】 化学电源
| A.氢气的燃烧热:ΔH=-241.8 kJ·mol-1 |
| B.相同条件下,充分燃烧1 mol H2(g)与1 mol S(g)的混合物比充分燃烧1 mol H2S(g)放热多20.1 kJ |
| C.由①②知,水的热稳定性小于硫化氢 |
| D.②中若生成固态硫,ΔH将增大 |

下列说法不正确的是
| A.步骤④中煮沸的作用是为了除去残留的氯气 |
| B.步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、250mL容量瓶 |
| C.铁矿石中铁的百分含量为56% |
| D.该铁矿石中若含氧为24% ,则铁的氧化物的化学式为Fe2O3·3FeO |
【知识点】 化学实验基础
二、解答题 添加题型下试题
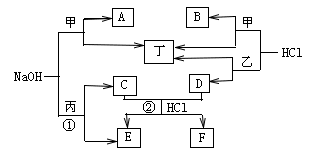
请回答:
(1)组成丙的元一素在元素周期表中的位置为
(2)C的电子式为
(3)将A、B的水溶液混合,反应的离子方程式为
(4)将B 的稀溶液加水稀释,在下图中画出溶液pH 随加水体积的变化曲线
(5)工业上冶炼金属甲的化学方程式为
(6)将等物质的量的A和NaOH混合溶于水,该溶液中各离子的物质的量浓度由大到小的顺序为
(7)检验F中阳离子的方法为
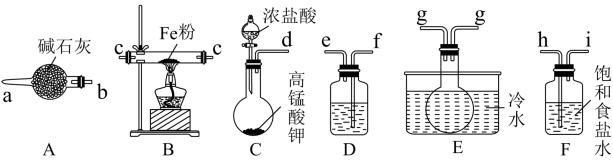
请回答:
(1)按气流方向各装置依次连接的合理顺序为
(2)连接好各装置进行实验,实验步骤如下:检查装置气密性后,装入药品,
①加热Fe粉反应一段时间 ②打开分液漏斗活塞通一段时间气体
③关闭分液漏斗活塞 ④停止加热,充分冷却
(3)装置A的作用为
(4)装置C中反应的化学方程式为
(5)装置D中盛有的试剂为
(6)从实验安全考虑,整套装置存在一处明显不足,请指出
 2CO2(g)+S(l) △H1
2CO2(g)+S(l) △H1(1)已知:反应Ⅱ:2CO2(g)
 2CO(g)+O2(g) △H2=+566.0kJmol-1
2CO(g)+O2(g) △H2=+566.0kJmol-1反应Ⅲ:S(l)+O2(g)
 SO2(g) △H3= -296.0kJmol-1则△H1=
SO2(g) △H3= -296.0kJmol-1则△H1=(2)T℃时,将0.100 mol CO(g)和0.120 mol SO2(g)充入2L恒容密闭容器中,发生反应I,各物质的物质的量随时间变化如下表所示。

①下列事实能说明该反应达到化学平衡状态的是
| A.容器内压强不再改变 |
| B.每消耗2 mol CO2,同时生成2mol CO |
| C.气体密度不再改变 |
| D.v正( SO2)=2v逆(CO2) |
③T℃时,反应I的平衡常数K=
④T℃时,将0.100 mol CO(g)和0.120 mol SO2(g)充入容积为2L的恒压密闭容器中,反应达到平衡时,SO2的转化率与原平衡(恒容)相比
(3)L(L1、L2),X可分别代表压强或温度。下图表示t一定时,反应Ⅱ中CO(g)的体积分数随x的变化关系。2CO(g)+SO2(g)
 2CO2(g)+S(l) △H1<0
2CO2(g)+S(l) △H1<0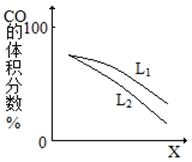
①X代表的物理量为
②判断L1、L2的大小关系,并简述理由:
(1)热还原法
加热条件下,用液态肼(N2H4)还原新制的Cu(OH)2制备Cu2O,同时放出N2。该反应的化学方程式为
(2)电解法 以氢氧燃料电池为电源,用电解法制备Cu2O的装置如图。
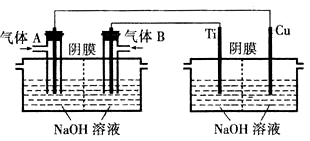
①A的化学式为
②燃料电池中,OH-的移动方向为
③电解一段时间后,欲使阴极室溶液恢复原来组成,应向其中补充一定量
④制备过程中,可循环利用的物质为
(3)干法还原法
利用反应Cu +CuO
 Cu2O制备Cu2O。将反应后的均匀固体混合物(含有三种成分)等分为两份,一份与足量H2充分反应后,固体质量减少6.4g;另一份恰好溶于500mL稀硝酸,生成标准状况下4.48LNO,该稀硝酸的物质的量浓度为
Cu2O制备Cu2O。将反应后的均匀固体混合物(含有三种成分)等分为两份,一份与足量H2充分反应后,固体质量减少6.4g;另一份恰好溶于500mL稀硝酸,生成标准状况下4.48LNO,该稀硝酸的物质的量浓度为【知识点】 电解原理的应用
三、填空题 添加题型下试题
(2)CH4中共用电子对偏向C,SiH4中硅元素为+4价,则C、Si、H的电负性由大到小的顺序为
(3)Fe3C晶体中碳元素为-3价,则其中基态铁离子的电子排布式为
(4)甲醇(CH3OH)分子内的O-C-H键角
(5)BF3和NF3都是四个原子的分子,BF3分子的立体构型是平面三角形,而NF3分子的立体构型是三角锥形的原因是
(6)测定大气中PM2.5的浓度方法之一是β-射线吸收法,β-射线吸收法可用85Kr。Kr晶体为面心立方晶体,若晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则
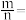
【知识点】 元素周期表 元素周期律
四、解答题 添加题型下试题
已知:I.R—COOH
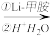 R—CHO;
R—CHO;Ⅱ.经红外光谱检测研究确认,有机物M含有2个“C-O-C”结构。且lmolM与足量的银氨溶液反应能生成4molAg。

(1)有机物B中含有的官能团名称是
(2)有机物B在X溶液作用下可生成乙二醇,则X为
(3)有机物C分子苯环上有两个对位的取代基,写出有机物C的结构简式
(4)①有机物D中不能发生的反应类型是
A.取代反应 b.消去反应 c加成反应 d氧化反应
②有机物Y与D互为同分异构体,写出符合下列条件的Y的结构简式
i.含有苯环,苯环上的一卤代物有3种同分异构体
ⅱ.能与新制的氢氧化铜悬浊液反应产生砖红色沉淀
ⅲ.1molY最多能与2molNaOH溶液反应
(5)写出由有机物B与有机物D合成M的化学方程式
试卷分析
试卷题型(共 20题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 物理变化与化学变化 | |
| 2 | 0.85 | 化学计量 | |
| 3 | 0.65 | 有机物的推断 有机合成综合考查 多官能团有机物的结构与性质 有机推断综合考查 | |
| 4 | 0.64 | 化学实验基础 | |
| 5 | 0.4 | 离子共存 | |
| 6 | 0.64 | 元素周期表 元素周期律 | |
| 7 | 0.64 | 化学平衡 | |
| 8 | 0.85 | 化学实验基础 | |
| 9 | 0.85 | 烃的衍生物 | |
| 10 | 0.65 | 化学平衡的移动及其影响因素 化学平衡图像分析 | |
| 11 | 0.85 | 氧化还原反应的应用 氧化还原反应有关计算 氧化还原反应的规律 | |
| 12 | 0.4 | 化学电源 | |
| 13 | 0.65 | 化学能与物质稳定性之间的关系 盖斯定律与热化学方程式 | |
| 14 | 0.94 | 化学实验基础 | |
| 二、解答题 | |||
| 15 | 0.65 | 无机综合推断 铁的其他化合物 元素周期律、元素周期表的推断 根据物质性质进行元素种类推断 | 无机推断题 |
| 16 | 0.65 | 氯气的实验室制法 铁与非金属单质反应 物质制备的探究 综合实验设计与评价 | 实验探究题 |
| 17 | 0.85 | 化学平衡图像分析 化学平衡常数的概念及表达方式 化学平衡常数的有关计算 | 原理综合题 |
| 18 | 0.65 | 电解原理的应用 | 实验探究题 |
| 20 | 0.65 | 有机物的合成 根据题给物质选择合适合成路线 有机合成综合考查 信息给予的有机合成 | 有机推断题 |
| 三、填空题 | |||
| 19 | 0.4 | 元素周期表 元素周期律 | |



