2016届山东省武城二中高三下学期第一次月考理综化学试卷
山东
高三
阶段练习
2017-07-27
310次
整体难度:
适中
考查范围:
认识化学科学、常见无机物及其应用、化学实验基础、化学与STSE、物质结构与性质、有机化学基础、化学反应原理
2016届山东省武城二中高三下学期第一次月考理综化学试卷
山东
高三
阶段练习
2017-07-27
310次
整体难度:
适中
考查范围:
认识化学科学、常见无机物及其应用、化学实验基础、化学与STSE、物质结构与性质、有机化学基础、化学反应原理
一、单选题 添加题型下试题
单选题
|
适中(0.64)
1. 下列说法正确的是
| A.与水反应可生成酸的氧化物都是酸性氧化物 |
| B.既能与酸反应又能与碱反应的物质一定是两性氧化物或两性氢氧化物 |
| C.晶体的熔化、水的汽化和液化、KMnO4溶液的酸化以及煤的气化和液化均属物理变化 |
| D.有单质参加的反应或有单质生成的反应不一定是氧化还原反应。 |
【知识点】 物质的分类
您最近一年使用:0次
单选题
|
适中(0.64)
2. 下列叙述I和II均正确并有因果关系的是
| 选项 | 叙述I | 叙述II |
| A | 用酸度计测定SO2和CO2饱和溶液的pH,前者pH小 | 结论:说明H2SO3酸性强于H2CO3 |
| B | SiO2是酸性氧化物 | SiO2不与任何酸溶液反应 |
| C | 配制SnCl2溶液时,先将SnCl2溶于适量的稀盐酸中,再用蒸馏水稀释,保存时再在试剂瓶中加入少量的锡粒 | 抑制Sn2+水解,并防止Sn2+被氧化为Sn4+ |
| D | 浓硝酸具有强氧化性 | 应保存在棕色玻璃试剂瓶中 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2016-03-09更新
|
191次组卷
|
4卷引用:2016届山东省寿光现代中学高三下学期开学检测化学试卷
单选题
|
适中(0.64)
3. 根据表中八种短周期元素的有关信息判断,下列说法错误的是


| A.元素④气态氢化物的稳定性大于元素⑤气态氢化物的稳定性 |
| B.元素②气态氢化物的沸点小于元素⑤气态氢化物的沸点 |
| C.元素②⑥形成的化合物具有两性 |
| D.元素④的最高价氧化物的水化物比元素⑤的最高价氧化物的水化物酸性强 |
【知识点】 元素周期表 元素周期律
您最近一年使用:0次
2016-12-09更新
|
257次组卷
|
2卷引用:2016届山东省青岛市高三上学期期末考试化学试卷
单选题
|
适中(0.64)
4. 下列有关说法正确的是
| A.2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物种类数相同 |
| B.乙烷、苯、裂化汽油溶液均不能使酸性高锰酸钾溶液褪色 |
| C.苯的密度比水小,但由苯反应制得的溴苯、硝基苯、环己烷的密度都比水大 |
| D.乙酸乙酯在碱性条件下的水解反应称为皂化反应 |
您最近一年使用:0次
单选题
|
适中(0.64)
5. 下列实验中能达到实验目的的是


| A.用装置甲氧化废液中的溴化氢 | B.乙量取100.00mL溶液 |
| C.丙将萃取液中的苯与碘进行分离 | D.丁灼烧熔融碳酸钠固体 |
【知识点】 化学实验基础
您最近一年使用:0次
2016-12-09更新
|
78次组卷
|
3卷引用:2016届山东省寿光现代中学高三下学期开学检测化学试卷
单选题
|
适中(0.65)
名校
6. 乙烯催化氧化成乙醛可设计成如下图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO。下列有关说法正确的是


| A.a电极发生还原反应 |
| B.放电时,每转移2mol电子,理论上需要消耗28g乙烯 |
| C.b极反应式为:O2+4e-+2H2O=4OH- |
| D.电子移动方向:电极a→磷酸溶液→电极b |
【知识点】 原电池
您最近一年使用:0次
2016-05-21更新
|
690次组卷
|
9卷引用:2016届山东省寿光现代中学高三下学期开学检测化学试卷
单选题
|
适中(0.64)
名校
7. 下列说法中正确的是
| A.常温下,pH均等于4的硫酸溶液与醋酸溶液,两种溶液中c(SO42-)与c(CH3COO-)之比为1:2 |
| B.常温下,向pH=4.0的醋酸溶液中加入水稀释后,溶液中c(H+)和c(OH-)都将变小 |
| C.常温下,0.1mol/L NaHA溶液的PH=5,溶液:c(HA-)>c(H+)>c(H2A)>c(A2-) |
| D.0.1mol·L-1的(NH4)2Fe(SO4)2溶液中:c(NH4+)=c(SO42-)>c(Fe2+)>c(H+) |
您最近一年使用:0次
2016-12-09更新
|
214次组卷
|
5卷引用:2016届山东省寿光现代中学高三下学期开学检测化学试卷
二、填空题 添加题型下试题
填空题
|
较难(0.4)
8. 在日常生活中,为了达到更好的清洁效果,经常有人会将洁厕液(含有盐酸)与84消毒液混合使用,从而会发生引发中毒的事故。
(1)两种日化产品主要成分中都含有氯元素,该元素在元素周期表中位置是_____________ 。
(2)84消毒液的主要成分是次氯酸钠,写出次氯酸钠的电子式:_______________ 。
(3)常温下,0.1mol/L的NaClO溶液的PH=9.7,原因__________________ 。常温下HClO的电离平衡常数为________________ 。洁厕液与84消毒液混合后会生成有毒的氯气。写出该反应的离子方程式______________ 。
(4)高铁酸钾是一种高效多功能水处理剂,工业上常采用NaClO氧化法生产,反应原理为:
①在碱性条件下,利用NaClO氧化硝酸铁,制得Na2FeO4,该反应的离子反应方程式为___________ 。
②Na2FeO4与KOH反应生成K2FeO4:Na2FeO4+2KOH=K2FeO4+2NaOH
K2FeO4在水溶液中易水解:4FeO42-+10H2O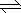 4Fe(OH)3+8OH-+3O2,在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
4Fe(OH)3+8OH-+3O2,在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用_____________ 溶液(填序号)
a.水 b.NH4Cl、异丙醇 c.Fe(NO3)3、异丙醇 d.CH3COONa、异丙醇
(1)两种日化产品主要成分中都含有氯元素,该元素在元素周期表中位置是
(2)84消毒液的主要成分是次氯酸钠,写出次氯酸钠的电子式:
(3)常温下,0.1mol/L的NaClO溶液的PH=9.7,原因
(4)高铁酸钾是一种高效多功能水处理剂,工业上常采用NaClO氧化法生产,反应原理为:
①在碱性条件下,利用NaClO氧化硝酸铁,制得Na2FeO4,该反应的离子反应方程式为
②Na2FeO4与KOH反应生成K2FeO4:Na2FeO4+2KOH=K2FeO4+2NaOH
K2FeO4在水溶液中易水解:4FeO42-+10H2O
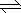 4Fe(OH)3+8OH-+3O2,在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
4Fe(OH)3+8OH-+3O2,在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用a.水 b.NH4Cl、异丙醇 c.Fe(NO3)3、异丙醇 d.CH3COONa、异丙醇
您最近一年使用:0次
三、解答题 添加题型下试题
解答题-实验探究题
|
较难(0.4)
9. 硫酸亚铁是一种重要的化工产品,在工业上有重要的用途。学生探究烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备绿矾(FeSO4·7H2O式量为278),并进一步计算产品的纯度。工艺流程如下所示:
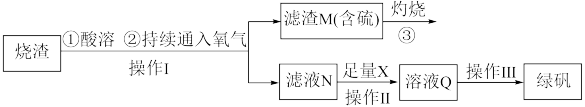
(1)烧渣在进行酸溶时用到的酸为___________ 。
(2)过程在灼烧时产生的气体通入下列溶液中,溶液不会褪色的是_____ -
(3)滤液N中加入X发生反应的离子方程式为____________ 。检验溶液Q中含有的金属阳离子的实验方法是______________ 。
(4)操作Ⅲ的操作步骤为蒸发浓缩、____________ 、过滤、洗涤、干燥。
(5)测定绿矾产品中Fe2+含量的实验步骤:
a.称取6.0 g产品,溶解,在250 mL容量瓶中定容;
b.量取25.00 mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01 mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积为40.00 mL。(滴定时发生反应的离子方程式为:5Fe2++ +8H+=5Fe3++Mn2++4H2O)。
+8H+=5Fe3++Mn2++4H2O)。
①计算上述产品中FeSO4·7H2O的质量分数为_________ ;
②若在a步操作中,进行定容时仰视刻度线定容,则会使测得的产品中FeSO4·7H2O[的质量分数______ 。(填“偏大”“偏小”或“无影响”)。

(1)烧渣在进行酸溶时用到的酸为
(2)过程在灼烧时产生的气体通入下列溶液中,溶液不会褪色的是
| A.品红溶液 | B.紫色石蕊溶液 | C.酸性KMnO4溶液 | D.红色的酚酞试液 |
(4)操作Ⅲ的操作步骤为蒸发浓缩、
(5)测定绿矾产品中Fe2+含量的实验步骤:
a.称取6.0 g产品,溶解,在250 mL容量瓶中定容;
b.量取25.00 mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01 mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积为40.00 mL。(滴定时发生反应的离子方程式为:5Fe2++
 +8H+=5Fe3++Mn2++4H2O)。
+8H+=5Fe3++Mn2++4H2O)。①计算上述产品中FeSO4·7H2O的质量分数为
②若在a步操作中,进行定容时仰视刻度线定容,则会使测得的产品中FeSO4·7H2O[的质量分数
您最近一年使用:0次
四、填空题 添加题型下试题
填空题
|
较难(0.4)
10. 蕴藏在海底的大量“可燃冰”,其开发利用是当前解决能源危机的重要课题。用甲烷制水煤气(CO、H2),再合成甲醇可以代替日益供应紧张的燃油。下面是产生水煤气的几种方法:

① CH4(g)+H2O (g)=CO (g)+3H2(g) △H1=+206.2kJ·mol-1
② CH4(g)+ O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
③ CH4 (g)+2H2O (g)=CO2 (g)+4H2(g) △H3=+165.0 kJ·mol-1
(1)CH4(g)与CO2 (g)反应生成CO(g)和H2(g)的热化学方程式为______________ 。
(2)从原料、能源利用的角度,分析作为合成甲醇更适宜的是反应_____________ 。(填序号)
(3)也可将CH4设计成燃料电池,来解决能源问题,如图装置所示。持续通入甲烷,在标准状况下,消耗甲烷VL。
①0<V≤33.6L时,负极电极反应为___________ 。
②33.6L<V≤67.2L时,电池总反应方程式为______________ 。
③V=44.8L时,溶液中离子浓度大小关系为________________ 。
(4)工业合成氨时,合成塔中每产生1molNH3,放出46.1kJ的热量。某小组研究在上述温度下该反应过程中的能量变化。他们分别在体积均为VL的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
下列叙述正确的是___________ (填字母序号)。
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>73.76kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.平衡时,容器中N2的转化率:①<②
e.两容器达到平衡时所用时间t1>t2
(5)下图是在反应器中将N2和H2按物质的量之比为1:3充入后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。

①上图中M、N、Q点平衡常数K的大小关系是_____________ 。
②M点对应的H2转化率是____________ 。

① CH4(g)+H2O (g)=CO (g)+3H2(g) △H1=+206.2kJ·mol-1
② CH4(g)+
 O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1
O2(g)=CO(g)+2H2(g) △H2=-35.4 kJ·mol-1③ CH4 (g)+2H2O (g)=CO2 (g)+4H2(g) △H3=+165.0 kJ·mol-1
(1)CH4(g)与CO2 (g)反应生成CO(g)和H2(g)的热化学方程式为
(2)从原料、能源利用的角度,分析作为合成甲醇更适宜的是反应
(3)也可将CH4设计成燃料电池,来解决能源问题,如图装置所示。持续通入甲烷,在标准状况下,消耗甲烷VL。
①0<V≤33.6L时,负极电极反应为
②33.6L<V≤67.2L时,电池总反应方程式为
③V=44.8L时,溶液中离子浓度大小关系为
(4)工业合成氨时,合成塔中每产生1molNH3,放出46.1kJ的热量。某小组研究在上述温度下该反应过程中的能量变化。他们分别在体积均为VL的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
| 容器 编号 | 起始时各物质物质的量/mol | 达到平衡的时间 | 达平衡时体系能量的变化/kJ | ||
| N2 | H2 | NH3 | |||
| ① | 1 | 4 | 0 | t1 min | 放出热量:36.88kJ |
| ② | 2 | 8 | 0 | t2 min | 放出热量:Q |
下列叙述正确的是
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>73.76kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.平衡时,容器中N2的转化率:①<②
e.两容器达到平衡时所用时间t1>t2
(5)下图是在反应器中将N2和H2按物质的量之比为1:3充入后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。

①上图中M、N、Q点平衡常数K的大小关系是
②M点对应的H2转化率是
您最近一年使用:0次
五、解答题 添加题型下试题
解答题-有机推断题
|
较难(0.4)
解题方法
11. 氯贝特( )是临床上一种降脂抗血栓药物,它的一条合成路线如下:
)是临床上一种降脂抗血栓药物,它的一条合成路线如下:

提示:Ⅰ.图中部分反应条件及部分反应物、生成物已略去。
Ⅱ.
Ⅲ.
(1)氯贝特的分子式为____________ ;含有的官能团名称为_______________________ 。
(2)若8.8 g A与足量NaHCO3溶液反应生成2.24 L CO2(标准状况),且B的核磁共振氢谱有两个峰,则A的结构简式为____________________________ 。
(3)要实现反应①所示的转化,加入下列物质不能达到目的的是_______ (填选项字母)。
a.Na b.NaOH c.NaHCO3 d.CH3COONa
(4)反应②的反应类型为___________ ,其产物甲有多种同分异构体,同时满足以下条件的所有甲的同分异构体有______ 种(不考虑立体异构)。①1,3,5-三取代苯;②属于酯类且既能与FeCl3溶液显紫色,又能发生银镜反应;③1 mol该同分异构体最多能与3 mol NaOH反应。
(5)写出B与足量NaOH溶液反应的化学方程式_______________________ 。
 )是临床上一种降脂抗血栓药物,它的一条合成路线如下:
)是临床上一种降脂抗血栓药物,它的一条合成路线如下:
提示:Ⅰ.图中部分反应条件及部分反应物、生成物已略去。
Ⅱ.

Ⅲ.

(1)氯贝特的分子式为
(2)若8.8 g A与足量NaHCO3溶液反应生成2.24 L CO2(标准状况),且B的核磁共振氢谱有两个峰,则A的结构简式为
(3)要实现反应①所示的转化,加入下列物质不能达到目的的是
a.Na b.NaOH c.NaHCO3 d.CH3COONa
(4)反应②的反应类型为
(5)写出B与足量NaOH溶液反应的化学方程式
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:认识化学科学、常见无机物及其应用、化学实验基础、化学与STSE、物质结构与性质、有机化学基础、化学反应原理
试卷题型(共 11题)
题型
数量
单选题
7
填空题
2
解答题
2
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.64 | 物质的分类 | |
| 2 | 0.64 | 碳族元素及其化合物 仪器使用与实验安全 化学与材料的发展 | |
| 3 | 0.64 | 元素周期表 元素周期律 | |
| 4 | 0.64 | 烃 有机物的结构特点 | |
| 5 | 0.64 | 化学实验基础 | |
| 6 | 0.65 | 原电池 | |
| 7 | 0.64 | 弱电解质的电离 盐类的水解 | |
| 二、填空题 | |||
| 8 | 0.4 | 卤素及其化合物 化学平衡 盐类的水解 | |
| 10 | 0.4 | 化学反应热的计算 化学平衡 化学电源 | |
| 三、解答题 | |||
| 9 | 0.4 | 有关铁及其化合物转化的流程题型 酸碱中和滴定原理的应用 物质分离、提纯综合应用 常见无机物的制备 | 实验探究题 |
| 11 | 0.4 | 同分异构体的数目的确定 有机合成综合考查 多官能团有机物的结构与性质 有机推断综合考查 | 有机推断题 |



