在气体分析中,常用CuCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:2CuCl+2CO+2H2O=Cu2Cl2•2CO•2H2O。回答下列问题:
(1)Cu在元素周期表中属于______ (选填“s”、“p”、“d”或“ds”)区元素。
(2)C、N、O三种原子中的第一电离能最大的是____________ 。NO3- 离子的空间构型是______ 。
(3)CO与N2互称等电子体。下表为CO和N2的有关信息。
根据表中数据,说明CO比N2活泼的原因是________________________ 。
(4)Cu2Cl2•2CO•2H2O是一种配合物,其结构如图所示:
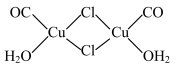
①该配合物中氯原子的杂化方式为_________________________ 。
②该配合物中,CO作配体时配位原子是C而不是O的原因是______________________ 。
③1molCu2Cl2•2CO•2H2O含有的______________ 个σ键。
(1)Cu在元素周期表中属于
(2)C、N、O三种原子中的第一电离能最大的是
(3)CO与N2互称等电子体。下表为CO和N2的有关信息。
| 键的类型 | A-B(单键) | A=B(双键) | A≡B(叁键) | |
| 键能(kJ/mol) | CO | 351 | 803 | 1071 |
| N2 | 159 | 418 | 946 | |
根据表中数据,说明CO比N2活泼的原因是
(4)Cu2Cl2•2CO•2H2O是一种配合物,其结构如图所示:

①该配合物中氯原子的杂化方式为
②该配合物中,CO作配体时配位原子是C而不是O的原因是
③1molCu2Cl2•2CO•2H2O含有的
更新时间:2020-06-05 15:47:08
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】铁及其化合物在生产生活及科学研究方面应用非常广泛。回答下列问题:
(1)Fe原子的核外电子排布式为_________ 。
(2)含锰奥氏体钢是一种特殊的铁合金,主要由Fe和Mn组成,其中锰能增加钢铁的强度和硬度,提高耐冲击性能和耐磨性能。第三电离能I3(Fe)____ I3(Mn)(填“大于”或“小于”),原因___ 。
(3)工业电解熔融的FeO、Fe2O3冶炼高纯铁。FeO与Fe2O3相比,_____ 熔点高,其主要原因是_______ 。
(4)FeCl3可与KSCN溶液发生显色反应。SCN-的三种元素中电负性最大的是_______ 。
(5)液态环戊二烯中存在的微粒间相互作用有____
A 范德华力 B 氢键 C 键 D π键
键 D π键
环戊二烯分子中碳原子的杂化轨道类型是_____
配合物中配体提供电子对的方式包括孤对电子、π电子等。二茂铁的分子结构如图所示,其中铁的配位数是____ 。

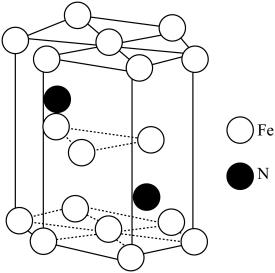
(6)Fe(CO)3与NH3在一定条件下可合成一种具有磁性的氮化铁。该磁性氮化铁的晶胞结构如图所示。六棱柱底边边长为acm,高为ccm,阿伏加 德罗常数的值为NA,该磁性氮化铁的密度为____ (列出计算式)g·cm-3。
(1)Fe原子的核外电子排布式为
(2)含锰奥氏体钢是一种特殊的铁合金,主要由Fe和Mn组成,其中锰能增加钢铁的强度和硬度,提高耐冲击性能和耐磨性能。第三电离能I3(Fe)
(3)工业电解熔融的FeO、Fe2O3冶炼高纯铁。FeO与Fe2O3相比,
(4)FeCl3可与KSCN溶液发生显色反应。SCN-的三种元素中电负性最大的是
(5)液态环戊二烯中存在的微粒间相互作用有
A 范德华力 B 氢键 C
 键 D π键
键 D π键环戊二烯分子中碳原子的杂化轨道类型是
配合物中配体提供电子对的方式包括孤对电子、π电子等。二茂铁的分子结构如图所示,其中铁的配位数是

(6)Fe(CO)3与NH3在一定条件下可合成一种具有磁性的氮化铁。该磁性氮化铁的晶胞结构如图所示。六棱柱底边边长为acm,高为ccm,阿伏加 德罗常数的值为NA,该磁性氮化铁的密度为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】据世界权威刊物《自然》最近报道,我国科学家选择碲化锆(ZrTe2)和砷化镉(Cd3As2)为材料验证了三维量子霍尔效应,并发现了金属-绝缘体的转换。回答下列问题:
(1)锌原子的价电子排布图:____________________________________________
(2)硫和碲位于同主族,H2S的分解温度高于H2Te,其主要原因是________________
(3)Cd2+与NH3等配体形成配离子。1 mol [Cd(NH3)4]2+含___________ mol σ键。该配离子中三种元素的电负性大小关系是:_______________________
(4)砷与卤素形成多种卤化物。AsCl3、AsF3、AsBr3的熔点由高到低的排序为________
(5)锆晶胞如图1所示,这种堆积方式称为______________________ ,镉晶胞如图2所示。已知:NA是阿伏加 德罗常数的值,晶体密度为d g·cm3。在该晶胞中两个镉原子最近核间距为______ nm(用含NA、d的代数式表示),镉晶胞中原子空间利用率为________ (用含π的代数式表示)。

(1)锌原子的价电子排布图:
(2)硫和碲位于同主族,H2S的分解温度高于H2Te,其主要原因是
(3)Cd2+与NH3等配体形成配离子。1 mol [Cd(NH3)4]2+含
(4)砷与卤素形成多种卤化物。AsCl3、AsF3、AsBr3的熔点由高到低的排序为
(5)锆晶胞如图1所示,这种堆积方式称为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】核安全与放射性污染防治已引起世界核大国的广泛重视。在爆炸的核电站周围含有放射性物质碘-131和铯- 137。碘-131一旦被人体吸入,可能会引发甲状腺等疾病,回答下列问题:
(1)Cs(铯)的价电子的电子排布式为6s1,与铯同主族的前四周期(包括第四周期)的三种金属元素X、Y、Z的电离能如下表:
上述三种元素X、Y、Z的元素符号分别为_________ ,基态Z原子的核外电子排布式为______ ,X形成的单质晶体中含有的化学键类型是_________________ 。
(2)F与I同主族,BeF2与H2O都是由三个原子构成的共价化合物分子,二者分子中的中心原子Be和O的杂化方式分别为______ 、______ ,BeF2分子的立体构型是____________ ,H2O分子的立体构型是________________ 。
(3)与碘同主族的氯具有很强的活泼性,能形成大量的含氯化合物。BC13分子中B—C1键的键角为__________________ 。
(4)131I2晶体的晶胞结构如图甲所示,该晶胞中含有____ 个131I2分子;KI的晶胞结构如图乙所示,每个K+紧邻______ 个I-。

(5)KI晶体的密度为ρg • cm 3,K和I的摩尔质量分别为MK g • mol-1和MIg • mol-1,原子半径分别为rKpm和rI pm,阿伏伽德罗常数值为NA,则KI晶胞中原子的体积占晶胞体积的百分率为_____________ 。
(1)Cs(铯)的价电子的电子排布式为6s1,与铯同主族的前四周期(包括第四周期)的三种金属元素X、Y、Z的电离能如下表:
| 元素代号 | X | Y | Z |
| 第一电离能(kJ·mol-1) | 520 | 496 | 419 |
(2)F与I同主族,BeF2与H2O都是由三个原子构成的共价化合物分子,二者分子中的中心原子Be和O的杂化方式分别为
(3)与碘同主族的氯具有很强的活泼性,能形成大量的含氯化合物。BC13分子中B—C1键的键角为
(4)131I2晶体的晶胞结构如图甲所示,该晶胞中含有

(5)KI晶体的密度为ρg • cm 3,K和I的摩尔质量分别为MK g • mol-1和MIg • mol-1,原子半径分别为rKpm和rI pm,阿伏伽德罗常数值为NA,则KI晶胞中原子的体积占晶胞体积的百分率为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】铬是不锈钢的合金元素之一,目前被广泛应用于冶金、化工等领域。
(1)基态Cr原子价层电子的电子排布式为_______ 。
(2)金属铬的第二电离能(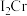 )和锰的第二电离能(
)和锰的第二电离能(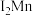 )分别为1590.6kJ/mol、1509.0kJ/mol,
)分别为1590.6kJ/mol、1509.0kJ/mol,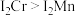 的原因是
的原因是_______ 。
(3) 的熔点(83℃)比
的熔点(83℃)比 的熔点(1100℃)低得多,这是因为
的熔点(1100℃)低得多,这是因为_______ 。
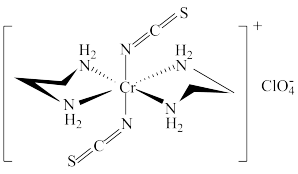
(4)Cr的一种配合物结构如图所示,该配合物阳离子中Cr的配位数为_______ ,阴离子 的空间构型为
的空间构型为_______ 。
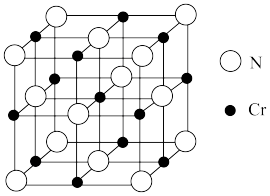
(5)氮化铬晶体的晶胞结构如图所示,若N与Cr核间距离为a pm( ),则氮化铬的密度为
),则氮化铬的密度为_______ g·cm-3。
(1)基态Cr原子价层电子的电子排布式为
(2)金属铬的第二电离能(
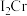 )和锰的第二电离能(
)和锰的第二电离能(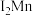 )分别为1590.6kJ/mol、1509.0kJ/mol,
)分别为1590.6kJ/mol、1509.0kJ/mol,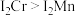 的原因是
的原因是(3)
 的熔点(83℃)比
的熔点(83℃)比 的熔点(1100℃)低得多,这是因为
的熔点(1100℃)低得多,这是因为(4)Cr的一种配合物结构如图所示,该配合物阳离子中Cr的配位数为
 的空间构型为
的空间构型为
(5)氮化铬晶体的晶胞结构如图所示,若N与Cr核间距离为a pm(
 ),则氮化铬的密度为
),则氮化铬的密度为
您最近一年使用:0次
【推荐2】中国科学院化学研究所有机固体院重点实验室合成了适用于非卤溶剂加工的“巨分子受体”,对于推动聚合物太阳电池受体光伏材料的发展具有重要意义。目前可做太阳电池材料的有单晶硅、多晶硅、非晶硅、GaAs、GaAlAs、InP、CdS、CdTe、CuInSe等。
(1) 在元素周期表中的位置为
在元素周期表中的位置为_______ ,其基态原子有_______ 种不同运动状态的电子。
(2)Te位于元素周期表第五周期第ⅥA族,其基态原子的价层电子轨道表示式为_______ ,其核外电子占据的最高能级的电子云轮廓图为_______ 。
(3)第一电子亲和能 是指基态的气态原子得到一个电子形成气态
是指基态的气态原子得到一个电子形成气态 价离子时所放出的热量。元素的电子亲和能越大,表示原子得到电子的倾向越大,电负性一般也越大。则
价离子时所放出的热量。元素的电子亲和能越大,表示原子得到电子的倾向越大,电负性一般也越大。则
_______ (填“ ”或“
”或“ ”)
”)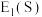 。
。
(4) 和
和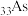 (与
(与 同主族)两种元素中第一电离能较大的是
同主族)两种元素中第一电离能较大的是_______ (填元素符号),试解释其原因:_______ 。
(5)根据对角线规则可知, 与铝在性质上具有相似性。已知
与铝在性质上具有相似性。已知 ,
, 与
与 溶液反应的化学方程式为
溶液反应的化学方程式为_______ 。
(1)
 在元素周期表中的位置为
在元素周期表中的位置为(2)Te位于元素周期表第五周期第ⅥA族,其基态原子的价层电子轨道表示式为
(3)第一电子亲和能
 是指基态的气态原子得到一个电子形成气态
是指基态的气态原子得到一个电子形成气态 价离子时所放出的热量。元素的电子亲和能越大,表示原子得到电子的倾向越大,电负性一般也越大。则
价离子时所放出的热量。元素的电子亲和能越大,表示原子得到电子的倾向越大,电负性一般也越大。则
 ”或“
”或“ ”)
”)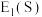 。
。(4)
 和
和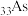 (与
(与 同主族)两种元素中第一电离能较大的是
同主族)两种元素中第一电离能较大的是(5)根据对角线规则可知,
 与铝在性质上具有相似性。已知
与铝在性质上具有相似性。已知 ,
, 与
与 溶液反应的化学方程式为
溶液反应的化学方程式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】离子液体被认为是21世纪理想的绿色溶剂,是指室温或者接近室温时呈液态,而本身由阴、阳离子构成的化合物。氯代1-丁基-3-甲基咪唑离子液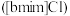 可以与
可以与 混合形成离子液体;
混合形成离子液体; 也可以转化成其他离子液体,下图是
也可以转化成其他离子液体,下图是 与
与 离子交换反应合成离子液体
离子交换反应合成离子液体 的流程:
的流程:

(1)请画出基态Ga原子的价电子排布图_____ ;同周期元素中基态原子未成对电子数与硼(B)原子相同的有_____ (填元素符号)。
(2)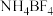 中N原子的杂化方式为
中N原子的杂化方式为_____ ,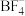 的空间构型为
的空间构型为_____ , 中几种元素电负性由大到小的顺序为
中几种元素电负性由大到小的顺序为_____ 。
(3)已知分子中的大 键可以用
键可以用 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表大
键的原子数,n代表大 键中的电子数,则
键中的电子数,则 中大
中大 键可以表示为
键可以表示为_____ 。
(4) 熔点为
熔点为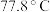 ,则
,则 的晶体类型为
的晶体类型为_____ , 和
和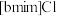 混合形成离子液体的过程中会存在以下转化:
混合形成离子液体的过程中会存在以下转化: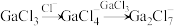 ,请画出
,请画出 的结构式
的结构式_____ 。
(5)某种 的晶胞结构如图所示,O2−以六方最密方式堆积,
的晶胞结构如图所示,O2−以六方最密方式堆积, 在其八面体空隙中(注:未全部标出,如:
在其八面体空隙中(注:未全部标出,如: 在1、2、3、4、5、6构成的八面体体心)。
在1、2、3、4、5、6构成的八面体体心)。
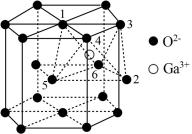
①该晶胞中O2−的配位数为_____ 。
②已知氧离子半径为acm,晶胞的高为bcm,NA代表阿伏加德罗常数的值,该晶体的密度为_____ g·cm−3(用含 和NA的代数式表示)。
和NA的代数式表示)。
 可以与
可以与 混合形成离子液体;
混合形成离子液体; 也可以转化成其他离子液体,下图是
也可以转化成其他离子液体,下图是 与
与 离子交换反应合成离子液体
离子交换反应合成离子液体 的流程:
的流程:
(1)请画出基态Ga原子的价电子排布图
(2)
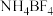 中N原子的杂化方式为
中N原子的杂化方式为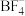 的空间构型为
的空间构型为 中几种元素电负性由大到小的顺序为
中几种元素电负性由大到小的顺序为(3)已知分子中的大
 键可以用
键可以用 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表大
键的原子数,n代表大 键中的电子数,则
键中的电子数,则 中大
中大 键可以表示为
键可以表示为(4)
 熔点为
熔点为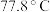 ,则
,则 的晶体类型为
的晶体类型为 和
和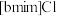 混合形成离子液体的过程中会存在以下转化:
混合形成离子液体的过程中会存在以下转化: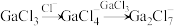 ,请画出
,请画出 的结构式
的结构式(5)某种
 的晶胞结构如图所示,O2−以六方最密方式堆积,
的晶胞结构如图所示,O2−以六方最密方式堆积, 在其八面体空隙中(注:未全部标出,如:
在其八面体空隙中(注:未全部标出,如: 在1、2、3、4、5、6构成的八面体体心)。
在1、2、3、4、5、6构成的八面体体心)。
①该晶胞中O2−的配位数为
②已知氧离子半径为acm,晶胞的高为bcm,NA代表阿伏加德罗常数的值,该晶体的密度为
 和NA的代数式表示)。
和NA的代数式表示)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】硼、碳、氮、硅和硒等非金属元素在材料科学领域有广泛的应用前景。请回答下列问题:
(1)基态硒原子的电子排布式为[Ar]_________ ,基态氮原子能量最高的电子的电子云轮廓图形状为_______ 。
(2)NO2+是一种芳环硝化中间体,其中氮原子的杂化轨道类型为_____ ,与NO2+互为等电子体的化合物分子是______ (任写一种,填化学式)。
(3)元素C、N、O分别于氢元素形成的化合物中A-A键(A代表C、N、O原子)的键能如下表所示:
上表三种氢化物中A-A键的键能依次降低的主要原因是________ 。
(4)SeO32-的空间构型为________ ,H2SeO4酸性比H2SeO3强的原因是_______ 。
(5)硒化锌(ZnSe)抛光材料在光学方面有广泛应用,其晶胞如图所示。
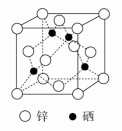
①锌原子的配位数为________ 。
②已知:该晶胞参数为a pm,NA代表阿伏伽德罗常数,M代表硒化锌的摩尔质量。则该晶胞的密度ρ=______ g·cm-3。(用代数式表示)
(1)基态硒原子的电子排布式为[Ar]
(2)NO2+是一种芳环硝化中间体,其中氮原子的杂化轨道类型为
(3)元素C、N、O分别于氢元素形成的化合物中A-A键(A代表C、N、O原子)的键能如下表所示:
| 氢化物 | H3C-CH3 | H2N-NH2 | HO-OH |
| 键能/kJ·mol-1 | 346 | 247 | 207 |
上表三种氢化物中A-A键的键能依次降低的主要原因是
(4)SeO32-的空间构型为
(5)硒化锌(ZnSe)抛光材料在光学方面有广泛应用,其晶胞如图所示。

①锌原子的配位数为
②已知:该晶胞参数为a pm,NA代表阿伏伽德罗常数,M代表硒化锌的摩尔质量。则该晶胞的密度ρ=
您最近一年使用:0次
【推荐2】物质结构的多样性使人类使用的材料精彩纷呈,请回答下列问题。
(1)氧化锆(ZrO2)材料具有高硬度,高强度,高韧性,极高的耐磨性及耐化学腐蚀性,氧化锆陶瓷在许多领域获得广泛应用。锆是与钛同族的第五周期元素,则锆原子的价电子排布式为____ 。
(2)同主族元素所形成的物质具有性质相似的特点,H2O的熔沸点均比H2S高,其原因是____ 。
(3)Mn和Fe的部分电离能数据如表:
气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是____ 。
(4)电镀厂排放的废水中常含有剧毒的CN-,可在TiO2的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下将CNO-继续氧化成N2和CO2。请回答:
①H、C、N、O四种元素的电负性由小到大的顺序为____ 。
②与CNO-互为等电子体的微粒的化学式为___ (写出一种即可)。
(5)硒化锌是一种重要的半导体材料,其晶胞结构如图所示(Se位于晶胞的顶点和面心),已知该晶胞中硒原子的配位数为____ ;若该晶胞密度为ρg•cm-3,硒化锌的摩尔质量为Mg•mol-1。NA代表阿伏加德罗常数,则晶胞参数a为____ pm(写出表达式即可)。

(1)氧化锆(ZrO2)材料具有高硬度,高强度,高韧性,极高的耐磨性及耐化学腐蚀性,氧化锆陶瓷在许多领域获得广泛应用。锆是与钛同族的第五周期元素,则锆原子的价电子排布式为
(2)同主族元素所形成的物质具有性质相似的特点,H2O的熔沸点均比H2S高,其原因是
(3)Mn和Fe的部分电离能数据如表:
| 元素 | Mn | Fe | |
| 电离能(kJ·mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是
(4)电镀厂排放的废水中常含有剧毒的CN-,可在TiO2的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下将CNO-继续氧化成N2和CO2。请回答:
①H、C、N、O四种元素的电负性由小到大的顺序为
②与CNO-互为等电子体的微粒的化学式为
(5)硒化锌是一种重要的半导体材料,其晶胞结构如图所示(Se位于晶胞的顶点和面心),已知该晶胞中硒原子的配位数为

您最近一年使用:0次
【推荐3】光刻技术需要利用深紫激光,我国是唯一掌握通过非线性光学晶体变频来获得深紫外激光技术的国家。目前唯一实用化的晶体是氟代硼铍酸钾晶体KBBF(KBe2BO3F2),实验室可用 BeO、KBF4和B2O3在700 ℃左右灼烧获得氟代硼铍酸钾晶体(晶胞如图所示,其中 K原子已经给出,氧原子略去),并放出BF3气体。回答下列问题:
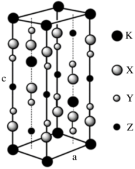
(1)基态钾原子的核外电子排布式为___________ ,能量最高的电子的电子云轮廓图形状为___________ 。
(2)BF3的空间构型为___________ ,与其互为等电子体的阴离子为___________ (填一种即可)。
(3)指出图中代表硼原子的字母为___________ ,该KBBF晶体的晶胞参数分别为a pm和c pm,α=β=γ=90°,则晶体密度为___________ g·cm-3(M代表 KBBF 的摩尔质量,NA表示阿伏加德罗常数的值,列出计算式)。

(1)基态钾原子的核外电子排布式为
(2)BF3的空间构型为
(3)指出图中代表硼原子的字母为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】Cu2SnS3是P型半导体材料,所含元素资源丰富,价格低廉,非常适用于薄膜太阳能电池,由CuCl2、SnCl2·2H2O、硫脲(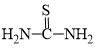 )等为原料制备。
)等为原料制备。
(1)基态Cu原子核外电子排布式为________ 。
(2)硫脲(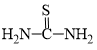 )是一种有机化合物,分子中氮、碳的杂化类型分别为
)是一种有机化合物,分子中氮、碳的杂化类型分别为________ 、________ 。
(3)[Cu(NH3)2]+不稳定,遇到空气被氧化成深蓝色的[Cu(NH3)4]2+,这个性质可用于气体净化,除去气体中的痕量O2:4[Cu(NH3)2]++O2+8NH3+2H2O=4[Cu(NH3)4]2++4OH-
①[Cu(NH3)4]2+配位数为________ ,含有σ键的数目为________ 个。
②NH3的空间结构为________ 。
(4)比较下列锡的卤化物的熔点和沸点,分析其变化规律及原因:______
(5)Cu2SnS3属于立方晶体,如下图所示,其晶胞参数为a=0.5428 nm,阿伏加德罗常数为NA,S原子填充在Cux(Sn1-x)构成的正四面体空隙中,则晶胞中正四面体的空隙填充率为________ ,则Cu2SnS3密度为________ g·cm-3(列出计算式)。例如图中原子1的坐标为( ,
, ,1),则原子2的坐标为
,1),则原子2的坐标为________ 。(M(Cu2SnS3)=341.7 g·mol-1)。

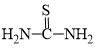 )等为原料制备。
)等为原料制备。(1)基态Cu原子核外电子排布式为
(2)硫脲(
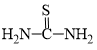 )是一种有机化合物,分子中氮、碳的杂化类型分别为
)是一种有机化合物,分子中氮、碳的杂化类型分别为(3)[Cu(NH3)2]+不稳定,遇到空气被氧化成深蓝色的[Cu(NH3)4]2+,这个性质可用于气体净化,除去气体中的痕量O2:4[Cu(NH3)2]++O2+8NH3+2H2O=4[Cu(NH3)4]2++4OH-
①[Cu(NH3)4]2+配位数为
②NH3的空间结构为
(4)比较下列锡的卤化物的熔点和沸点,分析其变化规律及原因:
| 锡的卤化物 | SnF4 | SnCl4 | SnBr4 | SnI4 |
| 熔点/℃ | 442 | -34.07 | 29.1 | 143 |
| 沸点/℃ | 705 | 114.15 | 205 | 364.36 |
| 溶解性 | 与水反应 | 溶于乙醇、苯 | 溶于乙醇 | 溶于乙醇、苯 |
(5)Cu2SnS3属于立方晶体,如下图所示,其晶胞参数为a=0.5428 nm,阿伏加德罗常数为NA,S原子填充在Cux(Sn1-x)构成的正四面体空隙中,则晶胞中正四面体的空隙填充率为
 ,
, ,1),则原子2的坐标为
,1),则原子2的坐标为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】Al、Fe、Cu 是重要的材料元素,在生产生活中有着广泛的应用。回答下列问题:
(1)基态Fe2+的核外电子排布式为_________________
(2)氯化铝熔点为194℃,而氧化铝熔点为2050℃,二者熔点相差很大的原因是____________________ 。
(3)已知Al 的第一电离能为578kJ/mol、第二电离能为1817 kJ/mol、第三电离能为2745 kJ/mol、第四电离能为11575 kJ/mol。请解释其第二电离能增幅较大的原因_____________ 。
(4)甲醇重整制氢反应中,铜基催化剂如CuO/SiO2具有重整温度低、催化选择性高的优点。Cu、Si、O元素电负性由大到小的顺序是__________________ ;SiO2中Si原子采取______________ 杂化。
(5)一种铜的溴化物晶胞结构如图所示:
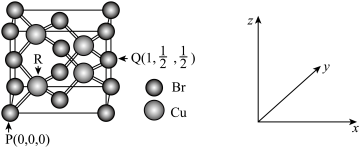
该晶胞中铜的配位数是______________ ,由图中P点和Q点的原子坐标参数可确定R点的原子坐标参数为______________ ;已知晶胞参数为apm,其密度为_______ g/cm3。(列出计算式即可)
(1)基态Fe2+的核外电子排布式为
(2)氯化铝熔点为194℃,而氧化铝熔点为2050℃,二者熔点相差很大的原因是
(3)已知Al 的第一电离能为578kJ/mol、第二电离能为1817 kJ/mol、第三电离能为2745 kJ/mol、第四电离能为11575 kJ/mol。请解释其第二电离能增幅较大的原因
(4)甲醇重整制氢反应中,铜基催化剂如CuO/SiO2具有重整温度低、催化选择性高的优点。Cu、Si、O元素电负性由大到小的顺序是
(5)一种铜的溴化物晶胞结构如图所示:

该晶胞中铜的配位数是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层电子数相同。回答下列问题:
(1)单质M的晶体类型为___________ ,晶体中原子间通过___________ 作用形成面心立方密堆积。
(2)元素Y是___________ (填元素符号),其基态原子的核外电子排布式为___________ ,其同周期元素中,第一电离能最大的是___________ (写元素符号),元素Y与碳原子构成的化合物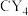 的立体构型为
的立体构型为___________ 。
(3)M与Y形成的一种化合物的立方晶胞如图所示。
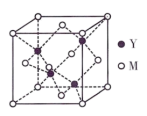
①该化合物的化学式为___________ 。
②该化合物难溶于水但易溶于氨水,其原因是___________ 。此化合物的氨水溶液遇到空气则被氧化为深蓝色,则该深蓝色溶液中阳离子的化学式为___________ 。
(1)单质M的晶体类型为
(2)元素Y是
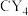 的立体构型为
的立体构型为(3)M与Y形成的一种化合物的立方晶胞如图所示。

①该化合物的化学式为
②该化合物难溶于水但易溶于氨水,其原因是
您最近一年使用:0次



