中国科学院化学研究所有机固体院重点实验室合成了适用于非卤溶剂加工的“巨分子受体”,对于推动聚合物太阳电池受体光伏材料的发展具有重要意义。目前可做太阳电池材料的有单晶硅、多晶硅、非晶硅、GaAs、GaAlAs、InP、CdS、CdTe、CuInSe等。
(1) 在元素周期表中的位置为
在元素周期表中的位置为_______ ,其基态原子有_______ 种不同运动状态的电子。
(2)Te位于元素周期表第五周期第ⅥA族,其基态原子的价层电子轨道表示式为_______ ,其核外电子占据的最高能级的电子云轮廓图为_______ 。
(3)第一电子亲和能 是指基态的气态原子得到一个电子形成气态
是指基态的气态原子得到一个电子形成气态 价离子时所放出的热量。元素的电子亲和能越大,表示原子得到电子的倾向越大,电负性一般也越大。则
价离子时所放出的热量。元素的电子亲和能越大,表示原子得到电子的倾向越大,电负性一般也越大。则
_______ (填“ ”或“
”或“ ”)
”)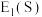 。
。
(4) 和
和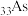 (与
(与 同主族)两种元素中第一电离能较大的是
同主族)两种元素中第一电离能较大的是_______ (填元素符号),试解释其原因:_______ 。
(5)根据对角线规则可知, 与铝在性质上具有相似性。已知
与铝在性质上具有相似性。已知 ,
, 与
与 溶液反应的化学方程式为
溶液反应的化学方程式为_______ 。
(1)
 在元素周期表中的位置为
在元素周期表中的位置为(2)Te位于元素周期表第五周期第ⅥA族,其基态原子的价层电子轨道表示式为
(3)第一电子亲和能
 是指基态的气态原子得到一个电子形成气态
是指基态的气态原子得到一个电子形成气态 价离子时所放出的热量。元素的电子亲和能越大,表示原子得到电子的倾向越大,电负性一般也越大。则
价离子时所放出的热量。元素的电子亲和能越大,表示原子得到电子的倾向越大,电负性一般也越大。则
 ”或“
”或“ ”)
”)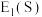 。
。(4)
 和
和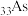 (与
(与 同主族)两种元素中第一电离能较大的是
同主族)两种元素中第一电离能较大的是(5)根据对角线规则可知,
 与铝在性质上具有相似性。已知
与铝在性质上具有相似性。已知 ,
, 与
与 溶液反应的化学方程式为
溶液反应的化学方程式为
更新时间:2024-04-13 09:02:53
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】化学的特征之一是从微观的层面认识物质。通过结合元素周期表与周期律,建立“位置一结构一性质”思维模型,我们可以更好地认识物质世界。
(一)X、Y、Z、M、W、Q、R是分布在周期表中三个短周期的主族元素,已知其原子半径及主要化合价如下:
(1)X在周期表中的位置是_______ ;Y、Q各自形成的简单离子中,半径较大的是_______ (填离子符号)。W和R按原子个数比1:4构成的阳离子中所含的化学键类型为_______ 。
(2)M与Z相比,非金属性较强的是_______ (填元素名称),两元素最高价氧化物的水化物中,酸性较强的是_______ (填化学式)。
(二)周期表中位于斜对角线(左上与右下)的两种元素性质十分相似,称为对角线法则。如锂与镁、铍与铝等,其单质或化合物的性质可参照对角线法则进行认识。
(3)锂在空气中燃烧主要产物的电子式是_______ 。
(4)下列关于铍的判断正确的是( )
A.氧化铍的化学式为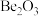 B.
B. 易溶于水
易溶于水
C. 是离子化合物 D.
是离子化合物 D.  具有两性
具有两性
(5) 和
和 可用试剂
可用试剂_______ 鉴别。
(一)X、Y、Z、M、W、Q、R是分布在周期表中三个短周期的主族元素,已知其原子半径及主要化合价如下:
| 元素代号 | X | Y(铝) | Z | M | W | Q | R |
| 原子半径/nm | 0.186 | 0.143 | 0.102 | 0.099 | 0.070 | 0.074 | 0.037 |
| 主要化合价 | +1 | +3 | +6,-2 | +7,-1 | +5,-3 | -2 | +1 |
(2)M与Z相比,非金属性较强的是
(二)周期表中位于斜对角线(左上与右下)的两种元素性质十分相似,称为对角线法则。如锂与镁、铍与铝等,其单质或化合物的性质可参照对角线法则进行认识。
(3)锂在空气中燃烧主要产物的电子式是
(4)下列关于铍的判断正确的是
A.氧化铍的化学式为
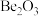 B.
B. 易溶于水
易溶于水C.
 是离子化合物 D.
是离子化合物 D.  具有两性
具有两性(5)
 和
和 可用试剂
可用试剂
您最近半年使用:0次
【推荐2】回答下列问题:
(1)Mn位于元素周期表中第四周期_______ 族。
(2)比较离子半径:F-_______ O2-(填“大于”“等于”或“小于)。
(3)Li+与H-具有相同的电子构型,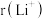 小于
小于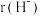 ,原因是
,原因是_______ 。
(4)在周期表中,与Li的化学性质最相似的邻族元素是_______ 。
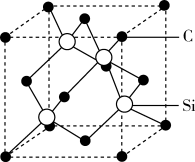
(5)金刚砂(SiC)的硬度为9.5,其晶胞结构如图所示,则金刚砂晶体类型为_______ ;在SiC中,每个C原子周围最近的C原子数目为_______ ;若晶胞的边长为a pm,阿伏加德罗常数为 ,则金刚砂的密度表达式为
,则金刚砂的密度表达式为_______ 。
(1)Mn位于元素周期表中第四周期
(2)比较离子半径:F-
(3)Li+与H-具有相同的电子构型,
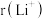 小于
小于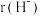 ,原因是
,原因是(4)在周期表中,与Li的化学性质最相似的邻族元素是
(5)金刚砂(SiC)的硬度为9.5,其晶胞结构如图所示,则金刚砂晶体类型为
 ,则金刚砂的密度表达式为
,则金刚砂的密度表达式为
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】如表为长式周期表的一部分,其中的编号代表对应的元素。
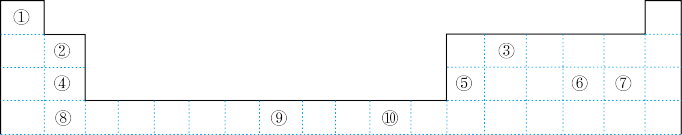
请回答下列问题:
(1)表中属于d区的元素是_______ (填编号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为_______ 。
(3)④⑤⑥⑦四种元素的第一电离能由大到小的顺序是_______ (用元素符号表示)。
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的未成对电子数为_______ ;该元素与元素①形成的分子X的立体构型为_______ ,与⑧在同一周期的元素中的未成对电子数目最多的元素的价电子排布式是_______ 。
(5)某些不同族元素的性质也有一定的相似性,如表中元素⑤与元素②的氢氧化物有相似的性质,请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:_______ 。

请回答下列问题:
(1)表中属于d区的元素是
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为
(3)④⑤⑥⑦四种元素的第一电离能由大到小的顺序是
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的未成对电子数为
(5)某些不同族元素的性质也有一定的相似性,如表中元素⑤与元素②的氢氧化物有相似的性质,请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】镓 、铟
、铟 都是典型的稀有分散元素。回答下列问题:
都是典型的稀有分散元素。回答下列问题:
(1)基态 原子的核外价电子排布式为
原子的核外价电子排布式为_____ ,最高能级电子的电子云形状为_____ 。
(2)一种含镓药物的合成方法如图所示: 原子的杂化方式为
原子的杂化方式为_____ , 化合物
化合物 中含有的
中含有的 键的物质的量为
键的物质的量为_____ 。化合物Ⅰ中所含元素的电负性由大到小的顺序为_____ (用元素符号表示)。
②化合物Ⅱ中 的配位数为
的配位数为_____ ,
_____ 。
(3)一种由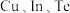 组成的晶体属四方晶系,晶胞棱边夹角均为
组成的晶体属四方晶系,晶胞棱边夹角均为 ,其晶胞结构如图。
,其晶胞结构如图。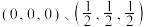 。则C点原子的分数坐标为
。则C点原子的分数坐标为_____ 。
② 表示阿伏加德罗常数的值,该晶体的密度为
表示阿伏加德罗常数的值,该晶体的密度为_____ (用含 的代数式表示)
的代数式表示) 。
。
 、铟
、铟 都是典型的稀有分散元素。回答下列问题:
都是典型的稀有分散元素。回答下列问题:(1)基态
 原子的核外价电子排布式为
原子的核外价电子排布式为(2)一种含镓药物的合成方法如图所示:

 原子的杂化方式为
原子的杂化方式为 化合物
化合物 中含有的
中含有的 键的物质的量为
键的物质的量为②化合物Ⅱ中
 的配位数为
的配位数为
(3)一种由
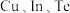 组成的晶体属四方晶系,晶胞棱边夹角均为
组成的晶体属四方晶系,晶胞棱边夹角均为 ,其晶胞结构如图。
,其晶胞结构如图。
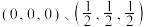 。则C点原子的分数坐标为
。则C点原子的分数坐标为②
 表示阿伏加德罗常数的值,该晶体的密度为
表示阿伏加德罗常数的值,该晶体的密度为 的代数式表示)
的代数式表示) 。
。
您最近半年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐2】下表为周期表的一部分,其中的编号代表对应的元素。请回答下列问题:

(1)写出元素⑨的基态原子的核外电子排布式为_______ ,元素⑩的价电子轨道表示式为_______ 。
(2)表中所给元素中,原子半径最大的是_______ (填元素符号),元素⑥、⑦形成的简单离子半径更小的是_______ (填离子符号)。
(3)元素③、元素⑤与元素①形成的简单分子更稳定的是_______ (填分子式)。
(4)下列关于元素③、④分别与①形成的简单化合物的叙述正确的是_______(填序号)。
(5)元素④、⑤的第一电离更大的是_______ (填元素符号)。
(6)元素②与元素⑦形成的分子的空间结构为_______ 。

(1)写出元素⑨的基态原子的核外电子排布式为
(2)表中所给元素中,原子半径最大的是
(3)元素③、元素⑤与元素①形成的简单分子更稳定的是
(4)下列关于元素③、④分别与①形成的简单化合物的叙述正确的是_______(填序号)。
| A.中心原子的价层电子对数相同 |
| B.中心原子的杂化方式不同 |
| C.分子的VSEPR模型相同,空间结构也相同 |
| D.④与①形成的分子的键角比③与①形成的分子的键角更大 |
(5)元素④、⑤的第一电离更大的是
(6)元素②与元素⑦形成的分子的空间结构为
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】C、Si、Ge、Sn都是IVA族元素,该族元素单质及其化合物在材料、医药等方面有重要应用。
请回答下列问题:
(1)Ge的原子核外电子排布式为___________ 。
(2)C、Si、Sn三种元素的单质中,能够形成金属晶体的是___________ 。
(3)CO可以和很多金属形成配合物,如 ,Ni与CO之间的键型为
,Ni与CO之间的键型为___________ 。
(4)碳氧键的红外伸缩振动频率与键的强度成正比,已知 中碳氧键的伸缩振动频率为
中碳氧键的伸缩振动频率为 ,CO分子中碳氧键的伸缩振动频率为
,CO分子中碳氧键的伸缩振动频率为 ,则
,则 中碳氧键的强度比CO分子中碳氧键的强度___________(填字母)。
中碳氧键的强度比CO分子中碳氧键的强度___________(填字母)。
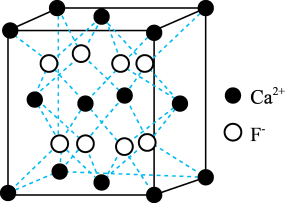
(5)萤石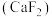 晶体的晶胞如图所示,已知立方体边长为a cm,阿伏加德罗常数的值为
晶体的晶胞如图所示,已知立方体边长为a cm,阿伏加德罗常数的值为 ,则
,则 晶体的密度为
晶体的密度为___________  (列出计算式)。
(列出计算式)。
(6)实验室合成一种由碳和氮两种元素形成的化合物,该化合物具有空间网状结构,其中每个碳原子与4个氮原子形成共价键,每个氮原子与3个碳原子形成共价键。
①该化合物的化学式为:___________ 。
②预测该化合物熔点应___________ 金刚石(填“高于”或“低于”)。
请回答下列问题:
(1)Ge的原子核外电子排布式为
(2)C、Si、Sn三种元素的单质中,能够形成金属晶体的是
(3)CO可以和很多金属形成配合物,如
 ,Ni与CO之间的键型为
,Ni与CO之间的键型为(4)碳氧键的红外伸缩振动频率与键的强度成正比,已知
 中碳氧键的伸缩振动频率为
中碳氧键的伸缩振动频率为 ,CO分子中碳氧键的伸缩振动频率为
,CO分子中碳氧键的伸缩振动频率为 ,则
,则 中碳氧键的强度比CO分子中碳氧键的强度___________(填字母)。
中碳氧键的强度比CO分子中碳氧键的强度___________(填字母)。| A.强 | B.弱 | C.相等 | D.无法判断 |
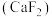 晶体的晶胞如图所示,已知立方体边长为a cm,阿伏加德罗常数的值为
晶体的晶胞如图所示,已知立方体边长为a cm,阿伏加德罗常数的值为 ,则
,则 晶体的密度为
晶体的密度为 (列出计算式)。
(列出计算式)。
(6)实验室合成一种由碳和氮两种元素形成的化合物,该化合物具有空间网状结构,其中每个碳原子与4个氮原子形成共价键,每个氮原子与3个碳原子形成共价键。
①该化合物的化学式为:
②预测该化合物熔点应
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】硼和氮的单质及一些化合物在工农业生产等领域有重要应用。回答下列问题:
(1)N原子核外有__________ 种不同运动状态的电子。基态N原子中,能量最高的电子所占据的原子轨道的电子排布式为:__________
(2)经测定发现N2O5固体由NO2+和NO3-两种离子组成,该固体中N 原子杂化类型分别为__________ ;与NO2+互为等电子体的微粒有_______________ (写出一种)。
(3)铵盐大多不稳定。NH4F、NH4I中,较易分解的是___________ ,原因是_____________________
(4)第二周期中,第一电离能介于B元素和N元素间的元素有__________ 种。
(5)氮化镓是第三代半导体材料,其晶体结构和单晶硅相似,晶胞结构如图所示:

①原子坐标参数是表示晶胞内部各原子的相对位置,其中原子坐标参数A为(0,0,0 );B为(1/2,1/2,0) ;C为(1,0,1)。则D原子的坐标参数为____________________ 。
②已知氮化镓晶胞的边长为anm,其密度为dg/cm3。则阿伏伽德罗常数NA=__________ ( 用a、d表示)
(1)N原子核外有
(2)经测定发现N2O5固体由NO2+和NO3-两种离子组成,该固体中N 原子杂化类型分别为
(3)铵盐大多不稳定。NH4F、NH4I中,较易分解的是
(4)第二周期中,第一电离能介于B元素和N元素间的元素有
(5)氮化镓是第三代半导体材料,其晶体结构和单晶硅相似,晶胞结构如图所示:

①原子坐标参数是表示晶胞内部各原子的相对位置,其中原子坐标参数A为(0,0,0 );B为(1/2,1/2,0) ;C为(1,0,1)。则D原子的坐标参数为
②已知氮化镓晶胞的边长为anm,其密度为dg/cm3。则阿伏伽德罗常数NA=
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】揭示土壤的成分从矿物开始。橄榄石属于镁铁质矿物的一种,主要成分是铁或镁的硅酸盐,同时含有锰、镍、钴等元素,晶体呈现粒状,属于岛状硅酸盐。回答下列问题:
(1)基态Co原子的核外电子占据的3d能级上的成对电子是_______ 个。
(2)Mn和Fe的各级电离能如下。
Mn与Fe相比,I1和I2较小,而I3较大,其原因是_______ 。
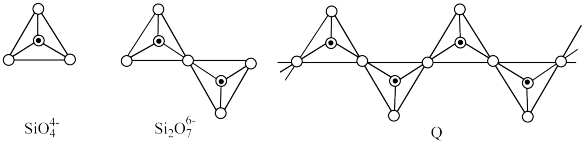
(3)在硅酸盐中,原硅酸根离子和多硅酸根离子结构如图所示(图中 表示氧原子,
表示氧原子, 表示Si-O),若多硅酸根离子Q中硅原子数为n,则该离子符号为
表示Si-O),若多硅酸根离子Q中硅原子数为n,则该离子符号为_______ ,在此结构中每个Si原子与_______ 个O原子相连,这几个O原子形成的空间结构是_______ 。
(4)下图是某橄榄石的晶胞结构,用NA表示阿伏加德罗常数的值。

①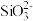 中Si原子的杂化类型是
中Si原子的杂化类型是_______ 。
②该晶体的化学式为_______ 。Mg原子周围最近的Fe原子有_______ 个。
③该晶体的密度是_______ g·cm-3(用含a、b、NA的代数式表示)。
(1)基态Co原子的核外电子占据的3d能级上的成对电子是
(2)Mn和Fe的各级电离能如下。
| 电离能/(kJ ·mol-1) | I1 | I2 | I3 | I4 | I5 |
| Mn | 717.3 | 1509.0 | 3 248 | 4940 | 6990 |
| Fe | 762. 5 | 1561.9 | 2957 | 5 290 | 7240 |
(3)在硅酸盐中,原硅酸根离子和多硅酸根离子结构如图所示(图中
 表示氧原子,
表示氧原子, 表示Si-O),若多硅酸根离子Q中硅原子数为n,则该离子符号为
表示Si-O),若多硅酸根离子Q中硅原子数为n,则该离子符号为
(4)下图是某橄榄石的晶胞结构,用NA表示阿伏加德罗常数的值。

①
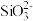 中Si原子的杂化类型是
中Si原子的杂化类型是②该晶体的化学式为
③该晶体的密度是
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】从明矾[KAl(SO4)2·12H2O]制备Al、K2SO4和H2SO4的过程如下图所示:
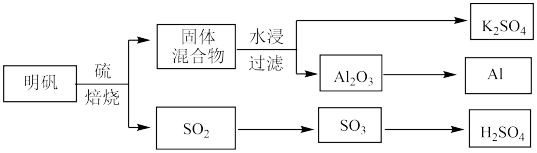
(1) S的基态原子核外有______ 个未成对电子;Cl 的基态原子核外电子排布式为________ 。
(2)用“>”或“<”填空:
(3) SO2分子构型为__________ ;SO3中硫原子采用杂化方式为__________ ;写出与SO3互为等电子体的一种离子:______________ 。
(4) Al单质为面心立方晶体,其晶胞参数a=0.405 nm,则Al的密度ρ=____ g·cm -3(只需列出计算式,不必计算出结果)。

(1) S的基态原子核外有
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| O | Cl- | KCl | H2SO4 |
(3) SO2分子构型为
(4) Al单质为面心立方晶体,其晶胞参数a=0.405 nm,则Al的密度ρ=
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)基态氧原子的价层电子排布图为___________ ,基态硒原子的核外电子排布式为___________ 。单质硒的熔点为221℃,其晶体类型是___________ 。
(2)H2O、H2S、H2Se的稳定性由强到弱的顺序是___________ ,H2O的沸点高于H2Se的沸点(-42℃),其原因是___________ 。
(3)H+可与H2O形成 ,
, 中H-O-H键角比H2O中H-O-H键角大,原因是
中H-O-H键角比H2O中H-O-H键角大,原因是___ 。
(4)很多含巯基(—SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物I可与氧化汞生成化合物II。

①下列说法正确的有___ (填字母序号)。
A.在1中C-C-C键角接近109°28' B.在II中O元素的电负性最大
C.在III中S原子均采取sp2杂化 D.在IV中硫氧键的键能均相等
②化合物III也是一种汞解毒剂,汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。比较水溶性的大小关系;化合物I___ 化合物III(填“<、>或=”)。
③化合物IV(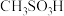 )是一种强酸,写出其电离方程式
)是一种强酸,写出其电离方程式___ 。
(1)基态氧原子的价层电子排布图为
(2)H2O、H2S、H2Se的稳定性由强到弱的顺序是
(3)H+可与H2O形成
 ,
, 中H-O-H键角比H2O中H-O-H键角大,原因是
中H-O-H键角比H2O中H-O-H键角大,原因是(4)很多含巯基(—SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物I可与氧化汞生成化合物II。

①下列说法正确的有
A.在1中C-C-C键角接近109°28' B.在II中O元素的电负性最大
C.在III中S原子均采取sp2杂化 D.在IV中硫氧键的键能均相等
②化合物III也是一种汞解毒剂,汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。比较水溶性的大小关系;化合物I
③化合物IV(
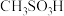 )是一种强酸,写出其电离方程式
)是一种强酸,写出其电离方程式
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】硒( )是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(
)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光( )效应以来,
)效应以来, 在发光材料、生物医学等领域引起广泛关注。一种含
在发光材料、生物医学等领域引起广泛关注。一种含 的新型
的新型 分子
分子 的合成路线如下:
的合成路线如下: 与S同族,基态硒原子价电子排布式为
与S同族,基态硒原子价电子排布式为_______ 。
(2) 的沸点低于
的沸点低于 ,其原因是
,其原因是_______ 。
(3)关于I~III三种反应物,下列说法正确的有_______ 。
A.I中仅有 键
键
B.I中的 键为非极性共价键
键为非极性共价键
C.II易溶于水
D.II中原子的杂化轨道类型只有 与
与
E.I~III含有的元素中,O电负性最大
(4)IV中具有孤对电子的原子有_______ 。
(5)硒的两种含氧酸的酸性强弱为
_______  (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠( )可减轻重金属铊引起的中毒。
)可减轻重金属铊引起的中毒。 的立体构型为
的立体构型为_______ 。
 )是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(
)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光( )效应以来,
)效应以来, 在发光材料、生物医学等领域引起广泛关注。一种含
在发光材料、生物医学等领域引起广泛关注。一种含 的新型
的新型 分子
分子 的合成路线如下:
的合成路线如下: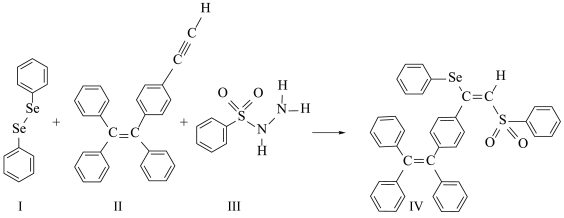
 与S同族,基态硒原子价电子排布式为
与S同族,基态硒原子价电子排布式为(2)
 的沸点低于
的沸点低于 ,其原因是
,其原因是(3)关于I~III三种反应物,下列说法正确的有
A.I中仅有
 键
键B.I中的
 键为非极性共价键
键为非极性共价键C.II易溶于水
D.II中原子的杂化轨道类型只有
 与
与
E.I~III含有的元素中,O电负性最大
(4)IV中具有孤对电子的原子有
(5)硒的两种含氧酸的酸性强弱为

 (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠( )可减轻重金属铊引起的中毒。
)可减轻重金属铊引起的中毒。 的立体构型为
的立体构型为
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】葡萄糖酸锌 用于治疗缺锌引起的营养不良、厌食症、儿童生长发育迟缓等,可用葡萄糖酸钙和硫酸锌反应制得。
用于治疗缺锌引起的营养不良、厌食症、儿童生长发育迟缓等,可用葡萄糖酸钙和硫酸锌反应制得。
(1) 位于周期表的
位于周期表的___________ (填“s”“p”“d”“f”或“ds”)区;元素氮和氧在周期表中相邻,第一电离能N___________ O(填“>”或者“<”)。
(2)葡萄糖酸 分子中所含元素的电负性由大到小的顺序为
分子中所含元素的电负性由大到小的顺序为___________ (填元素符号),该分子中碳原子杂化类型为___________ 。
(3) 中
中 的空间结构为
的空间结构为___________ (用文字描述)。
(4) 晶体中部分O原子被N原子替代后可以改善半导体性能,
晶体中部分O原子被N原子替代后可以改善半导体性能,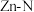 键与
键与 键相比,
键相比, 键离子键成分的百分数较大,原因是
键离子键成分的百分数较大,原因是___________ 。
(5) 的立方晶胞如图所示,
的立方晶胞如图所示, 原子填充于O原子形成的
原子填充于O原子形成的___________ (填多面体名称)空隙中,若晶胞的密度为 阿伏加德罗常数的值用
阿伏加德罗常数的值用 表示,则晶胞的棱长为
表示,则晶胞的棱长为___________  (用代数式表示)。
(用代数式表示)。

 用于治疗缺锌引起的营养不良、厌食症、儿童生长发育迟缓等,可用葡萄糖酸钙和硫酸锌反应制得。
用于治疗缺锌引起的营养不良、厌食症、儿童生长发育迟缓等,可用葡萄糖酸钙和硫酸锌反应制得。(1)
 位于周期表的
位于周期表的(2)葡萄糖酸
 分子中所含元素的电负性由大到小的顺序为
分子中所含元素的电负性由大到小的顺序为(3)
 中
中 的空间结构为
的空间结构为(4)
 晶体中部分O原子被N原子替代后可以改善半导体性能,
晶体中部分O原子被N原子替代后可以改善半导体性能, 键与
键与 键相比,
键相比, 键离子键成分的百分数较大,原因是
键离子键成分的百分数较大,原因是(5)
 的立方晶胞如图所示,
的立方晶胞如图所示, 原子填充于O原子形成的
原子填充于O原子形成的 阿伏加德罗常数的值用
阿伏加德罗常数的值用 表示,则晶胞的棱长为
表示,则晶胞的棱长为 (用代数式表示)。
(用代数式表示)。
您最近半年使用:0次



