下表为周期表的一部分,其中的编号代表对应的元素。请回答下列问题:

(1)写出元素⑨的基态原子的核外电子排布式为_______ ,元素⑩的价电子轨道表示式为_______ 。
(2)表中所给元素中,原子半径最大的是_______ (填元素符号),元素⑥、⑦形成的简单离子半径更小的是_______ (填离子符号)。
(3)元素③、元素⑤与元素①形成的简单分子更稳定的是_______ (填分子式)。
(4)下列关于元素③、④分别与①形成的简单化合物的叙述正确的是_______(填序号)。
(5)元素④、⑤的第一电离更大的是_______ (填元素符号)。
(6)元素②与元素⑦形成的分子的空间结构为_______ 。

(1)写出元素⑨的基态原子的核外电子排布式为
(2)表中所给元素中,原子半径最大的是
(3)元素③、元素⑤与元素①形成的简单分子更稳定的是
(4)下列关于元素③、④分别与①形成的简单化合物的叙述正确的是_______(填序号)。
| A.中心原子的价层电子对数相同 |
| B.中心原子的杂化方式不同 |
| C.分子的VSEPR模型相同,空间结构也相同 |
| D.④与①形成的分子的键角比③与①形成的分子的键角更大 |
(5)元素④、⑤的第一电离更大的是
(6)元素②与元素⑦形成的分子的空间结构为
更新时间:2024-03-01 14:23:35
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】下表列出了A~R9种元素在周期表中的位置:
请回答下列问题。
(1)这9种元素中化学性质最不活泼的是_______ ,金属性最强的是_______ 。(以上两个空均填元素符号)
(2)D元素的最高价氧化物对应的水化物与A和G的最高价氧化物对应的水化物反应的离子方程式是_______ ,_______ 。
(3)A、B、C三种元素按离子半径由大到小的顺序排列为_______ (用离子符号表示)。
(4)F元素简单氢化物的化学式是_______ ,该氢化物含有的化学键类型为_______ ,该氢化物在常温下与B发生反应的化学方程式是_______ 。
(5)H元素与A元素形成化合物的电子式是_______ ,高温灼烧该化合物时,火焰呈_______ 色。
| 周期 | 族 | |||||||
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H | ||||||
(1)这9种元素中化学性质最不活泼的是
(2)D元素的最高价氧化物对应的水化物与A和G的最高价氧化物对应的水化物反应的离子方程式是
(3)A、B、C三种元素按离子半径由大到小的顺序排列为
(4)F元素简单氢化物的化学式是
(5)H元素与A元素形成化合物的电子式是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】短周期主族元素X、Y、Z、M、W的原子序数依次递增,X的简单阴离子与He原子具有相同的电子层结构,Y基态原子未成对电子数在所处周期中最多,M是地壳中含量最多的金属元素,W原子最外层电子数是K层电子数的3倍,Z、W同主族。
(1)下列说法正确的是______ 。
A.原子半径: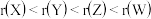
B.X、Y、Z三种元素只能形成共价化合物
C.W的简单气态氢化物的热稳定性比Z的强
D.M的单质能溶于W的最高氧化物对应水化物的稀溶液
(2)X、Y、Z、M、W五种元素中:
①电负性最小的元素是______  填元素的符号,下同
填元素的符号,下同 ,第一电离能最大的元素是
,第一电离能最大的元素是______ 。
②Z原子的电子排布图 轨道表示式
轨道表示式 为
为______ ,W的电子排布式为______ 。
③如图可以表示Y单质分子中电子云重叠方式的是______ 。
A. B.
B.  C.
C.  D.
D. 
1mol Y单质分子中含有 键的数目为
键的数目为______ 。
④Y的简单气态氢化物极易溶于水,其原因是______ ;一种含碳元素的阴离子R与Y的简单气态氢化物互为等电子体,写出R的电子式:______ 。
⑤向W的简单气态氢化物的水溶液中通入Z的单质,有W的单质析出,可以验证Z 的非金属性强于W,该反应的离子方程式为______ 。
(3)向含有M简单离子的溶液中加入过量NaOH溶液,可生成 。
。
①不考虑空间构型 要标出配位键,M要用元素符号表示
要标出配位键,M要用元素符号表示 ,
, 的结构可用示意图表示为
的结构可用示意图表示为______ 。
② 的空间构型为
的空间构型为______ ,其M原子轨道的杂化类型为______ 。
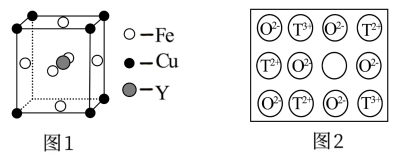
(4)铁、铜和Y元素可生成晶胞结构图1 所示的化合物,该化合物的化学式为______ 。
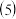 天然的和绝大部分人工制备的晶体都存在各种缺陷。如某过渡元素T的基态原子中的未成对电子数恰好等于最外层电子数;而其3d能级上的电子数等于最外层电子数的4倍。这种T的氧化物的晶胞结构就存在缺陷
天然的和绝大部分人工制备的晶体都存在各种缺陷。如某过渡元素T的基态原子中的未成对电子数恰好等于最外层电子数;而其3d能级上的电子数等于最外层电子数的4倍。这种T的氧化物的晶胞结构就存在缺陷 如图2所示
如图2所示 。
。
①基态 的外围电子排布式为
的外围电子排布式为______ ;若该T的氧化物晶体中每有1个 空缺,则应有
空缺,则应有______ 个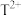 倍
倍 所取代,才能使晶体仍呈电中性。
所取代,才能使晶体仍呈电中性。
②若某T的氧化物晶体样品中 与
与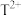 的离子数之比为1:11,则该晶体的化学式为
的离子数之比为1:11,则该晶体的化学式为______ 。
(1)下列说法正确的是
A.原子半径:
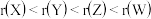
B.X、Y、Z三种元素只能形成共价化合物
C.W的简单气态氢化物的热稳定性比Z的强
D.M的单质能溶于W的最高氧化物对应水化物的稀溶液
(2)X、Y、Z、M、W五种元素中:
①电负性最小的元素是
 填元素的符号,下同
填元素的符号,下同 ,第一电离能最大的元素是
,第一电离能最大的元素是②Z原子的电子排布图
 轨道表示式
轨道表示式 为
为③如图可以表示Y单质分子中电子云重叠方式的是
A.
 B.
B.  C.
C.  D.
D. 
1mol Y单质分子中含有
 键的数目为
键的数目为④Y的简单气态氢化物极易溶于水,其原因是
⑤向W的简单气态氢化物的水溶液中通入Z的单质,有W的单质析出,可以验证Z 的非金属性强于W,该反应的离子方程式为
(3)向含有M简单离子的溶液中加入过量NaOH溶液,可生成
 。
。①不考虑空间构型
 要标出配位键,M要用元素符号表示
要标出配位键,M要用元素符号表示 ,
, 的结构可用示意图表示为
的结构可用示意图表示为②
 的空间构型为
的空间构型为(4)铁、铜和Y元素可生成晶胞结构图1 所示的化合物,该化合物的化学式为

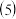 天然的和绝大部分人工制备的晶体都存在各种缺陷。如某过渡元素T的基态原子中的未成对电子数恰好等于最外层电子数;而其3d能级上的电子数等于最外层电子数的4倍。这种T的氧化物的晶胞结构就存在缺陷
天然的和绝大部分人工制备的晶体都存在各种缺陷。如某过渡元素T的基态原子中的未成对电子数恰好等于最外层电子数;而其3d能级上的电子数等于最外层电子数的4倍。这种T的氧化物的晶胞结构就存在缺陷 如图2所示
如图2所示 。
。①基态
 的外围电子排布式为
的外围电子排布式为 空缺,则应有
空缺,则应有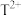 倍
倍 所取代,才能使晶体仍呈电中性。
所取代,才能使晶体仍呈电中性。②若某T的氧化物晶体样品中
 与
与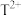 的离子数之比为1:11,则该晶体的化学式为
的离子数之比为1:11,则该晶体的化学式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】X、Y、Z、W、R是短周期元素,原子序数依次增大。X原子核外各层电子数之比为1:2,Y原子和Z原子的核外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。请回答下列问题:
(1)元素X的最高价氧化物的电子式为________ ;元素Y、Z、W的原子半径由大到小顺序为________ 。
(2)单质铜和元素Y的最高价氧化物对应水化物的浓溶液发生反应的化学方程式为____________ 。
(3)元素W位于周期表的第_____ 周期第________ 族,其非金属性比R弱,用原子结构的知识解释原因:__________ 。元素W和R的气态氢化物的稳定性关系为:________ (写出化学式)。
(4)R的一种氧化物能使品红溶液褪色,工业上用Y的气态氢化物的水溶液作该氧化物的吸收剂,写出吸收剂与足量该氧化物反应的化学方程式:____________ 。
(5)Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1:3,则该反应的化学方程式为____________ 。
(1)元素X的最高价氧化物的电子式为
(2)单质铜和元素Y的最高价氧化物对应水化物的浓溶液发生反应的化学方程式为
(3)元素W位于周期表的第
(4)R的一种氧化物能使品红溶液褪色,工业上用Y的气态氢化物的水溶液作该氧化物的吸收剂,写出吸收剂与足量该氧化物反应的化学方程式:
(5)Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1:3,则该反应的化学方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐1】有四种短周期元素,它们的结构或性质等信息如表所述。
请根据表中信息填写:
(1)A原子的核外电子排布式:_______ 。
(2)B元素在周期表中的位置:_______ ;离子半径:B_______ (填“大于”或“小于”)A。
(3)C原子的核外电子轨道表示式是_______ ,其原子核外有_______ 个未成对电子,能量最高的电子为_______ 轨道上的电子,其电子云形状呈_______ 形。
(4)D原子的核外电子排布式为_______ ,D-的结构示意图是_______ 。
| 元素 | 结构或性质 |
| A | A是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是快中子反应堆的导热剂 |
| B | B与A同周期,其最高价氧化物的水化物呈两性 |
| C | 元素的气态氢化物极易溶于水,其单质可用作制冷剂 |
| D | D是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
(1)A原子的核外电子排布式:
(2)B元素在周期表中的位置:
(3)C原子的核外电子轨道表示式是
(4)D原子的核外电子排布式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐2】元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2,元素Y基态原子的3p轨道上有4个电子。元素Z的原子最外层电子数是其内层的3倍。
(1)基态X原子核外共有___________ 种运动状态不同的电子,其价电子排布式为___________ 。
(2)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是___________ 。
(3)写出一种由第三周期元素组成的与YZ 互为等电子体的分子的电子式:
互为等电子体的分子的电子式:___________ 。
(4)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为___________ 。
(1)基态X原子核外共有
(2)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是
(3)写出一种由第三周期元素组成的与YZ
 互为等电子体的分子的电子式:
互为等电子体的分子的电子式:(4)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为
您最近一年使用:0次
【推荐3】铜是人类最早使用的金属之一。能形成多种化合物,易形成配位化合物。回答下列问题:
(1)Cu位于周期表第四周期第___ 族。写出其基态原子的电子排布式_____ 。
(2)元素Ni和Cu如相邻
①Ni和Cu相比,基态原子中未成对电子___ .(填“多”“少”或“相等”)。
②第二电离能Cu比Ni高,原因是_____ 。
(3)Cu可以和EDA(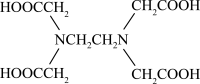 )形成配合物,其中碳原子的杂化方式是
)形成配合物,其中碳原子的杂化方式是____ ,其中C、N、O的电负性由大到小的顺序是_____ 。
(4)CuSO4受热分解的方程式为2CuSO4===Cu2O+SO2↑+SO3↑+O2↑。
①SO2的空间构型为_____ ,O2中σ和 键的个数比是
键的个数比是______ 。
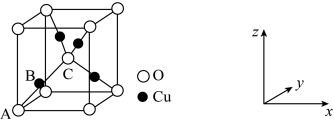
②氧化亚铜的晶胞结如图所示,其中A原子坐标是(0,0,0),C原子坐标是( ,
, ,
, ),则B原子坐标是
),则B原子坐标是____ 。若最近的Cu+与O2-的核距是anm,用NA表示阿伏加 德罗常数的值,则氧化亚铜的密度是_____ g·cm—3
(1)Cu位于周期表第四周期第
(2)元素Ni和Cu如相邻
①Ni和Cu相比,基态原子中未成对电子
②第二电离能Cu比Ni高,原因是
(3)Cu可以和EDA(
 )形成配合物,其中碳原子的杂化方式是
)形成配合物,其中碳原子的杂化方式是(4)CuSO4受热分解的方程式为2CuSO4===Cu2O+SO2↑+SO3↑+O2↑。
①SO2的空间构型为
 键的个数比是
键的个数比是②氧化亚铜的晶胞结如图所示,其中A原子坐标是(0,0,0),C原子坐标是(
 ,
, ,
, ),则B原子坐标是
),则B原子坐标是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】铂(Pt)及其化合物用途广泛。
(1)在元素周期表中,Pt与Fe相隔一个纵行、一个横行,但与铁元素同处_____ 族。基态铂原子有2个未成对电子,且在能量不同的原子轨道上运动,其价电子排布式为____________ 。
(2)二氯二吡啶合铂是由Pt2+、Cl-和吡啶结合形成的铂配合物,有顺式和反式两种同分异构体。科学研究表明,顺式分子具有抗癌活性。
①吡啶分子是大体积平面配体,其结构简式如图所示。每个吡啶分子中含有的σ键数目为________ 。
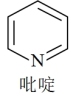
②二氯二吡啶合铂中存在的微粒间作用力有________ (填序号)。
a.离子键b.氢键c.范德华力d.金属键e.非极性键
③反式二氯二吡啶合铂分子是非极性分子,画出其结构式:_____ 。
(3)某研究小组将平面型的铂配合物分子进行层状堆砌,使每个分子中的铂原子在某一方向上排列成行,构成能导电的“分子金属”,其结构如图所示。
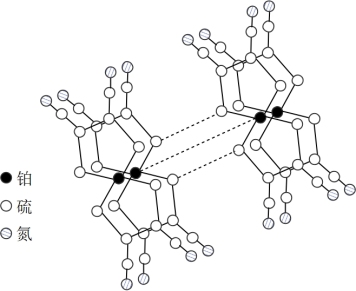
①硫和氮中,第一电离能较大的是______ 。
②“分子金属”可以导电,是因为______ 能沿着其中的金属原子链流动。
③“分子金属”中,铂原子是否以sp3的方式杂化?简述理由:______ 。
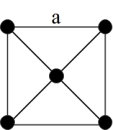
(4)金属铂晶体中,铂原子的配位数为12,其立方晶胞沿x、y或z轴的投影图如图所示。若金属铂的密度为dg·cm-3,则晶胞参数a=_________________ nm(列计算式)。
(1)在元素周期表中,Pt与Fe相隔一个纵行、一个横行,但与铁元素同处
(2)二氯二吡啶合铂是由Pt2+、Cl-和吡啶结合形成的铂配合物,有顺式和反式两种同分异构体。科学研究表明,顺式分子具有抗癌活性。
①吡啶分子是大体积平面配体,其结构简式如图所示。每个吡啶分子中含有的σ键数目为

②二氯二吡啶合铂中存在的微粒间作用力有
a.离子键b.氢键c.范德华力d.金属键e.非极性键
③反式二氯二吡啶合铂分子是非极性分子,画出其结构式:
(3)某研究小组将平面型的铂配合物分子进行层状堆砌,使每个分子中的铂原子在某一方向上排列成行,构成能导电的“分子金属”,其结构如图所示。

①硫和氮中,第一电离能较大的是
②“分子金属”可以导电,是因为
③“分子金属”中,铂原子是否以sp3的方式杂化?简述理由:
(4)金属铂晶体中,铂原子的配位数为12,其立方晶胞沿x、y或z轴的投影图如图所示。若金属铂的密度为dg·cm-3,则晶胞参数a=

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】现有六种元素,其中A、B、C、D、E为短周期主族元素,F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
(1)某同学根据上述信息,推断A基态原子的核外电子排布为该同学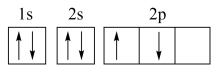 所画的电子排布图违背了
所画的电子排布图违背了___________ 。
(2)B元素的电负性____________ (填“大于”“小于”或“等于”)C元素的电负性。
(3)D元素第二次电离能飞跃数据将发生在失去第____________ 个电子时。
(4)E基态原子中能量最高的电子,其电子云在空间有____________ 个伸展方向。
(5)基态F2+和F3+中未成对电子数之比为___________ 。
(6)和元素F为同一周期的第VIIB元素G能形成G2+,气态G2+再失去1个电子比气态F2+再失去1个电子难,对此你的解释是___________ 。
| A元素形成的物质种类繁多,其形成的一种固体单质工业上常用作切割工具 |
| B元素原子的核外p电子数比s电子数少1 |
| C元素基态原子p轨道有两个未成对电子 |
| D原子的第一至第四电离能分别是:I1=738kJ·mol-1;I2=1451kJ·mol-1;I3=7733kJ·mol-1;I4=10540kJ·mol-1 |
| E原子核外所有p轨道全满或半满 |
| F基态原子中未成对电子数和该元素所在的周期数相等 |
 所画的电子排布图违背了
所画的电子排布图违背了(2)B元素的电负性_
(3)D元素第二次电离能飞跃数据将发生在失去第_
(4)E基态原子中能量最高的电子,其电子云在空间有_
(5)基态F2+和F3+中未成对电子数之比为
(6)和元素F为同一周期的第VIIB元素G能形成G2+,气态G2+再失去1个电子比气态F2+再失去1个电子难,对此你的解释是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】第ⅢA和第ⅤA元素可形成多种化合物。请回答:
(1)基态B原子核外电子占据的最高能级符号是___________ ,基态As原子的价层电子排布式是___________ 。
(2)①固体储氢材料氨硼烷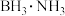 ,其结构和乙烷相似,下列有关说法正确的是
,其结构和乙烷相似,下列有关说法正确的是______ 。
A.氨硼烷中B原子的杂化方式为
B.相同条件下在水中的溶解度:氨硼烷>乙烷
C.元素B、N的第一电离能均高于相邻元素 形成的化合物中配位键的强度:
形成的化合物中配位键的强度:
________ 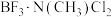 (填“>”、“<”或“=”),理由是
(填“>”、“<”或“=”),理由是________ 。
(3)一种含Ga化合物晶胞如图甲,三个晶胞围成一个六棱柱,如图乙,该化合物的化学式为___________ ,每个N原子周围距离最近的N原子数目为________ 。
(1)基态B原子核外电子占据的最高能级符号是
(2)①固体储氢材料氨硼烷
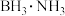 ,其结构和乙烷相似,下列有关说法正确的是
,其结构和乙烷相似,下列有关说法正确的是A.氨硼烷中B原子的杂化方式为

B.相同条件下在水中的溶解度:氨硼烷>乙烷
C.元素B、N的第一电离能均高于相邻元素
D. 是硼原子能量最低的激发态
是硼原子能量最低的激发态
 形成的化合物中配位键的强度:
形成的化合物中配位键的强度:
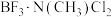 (填“>”、“<”或“=”),理由是
(填“>”、“<”或“=”),理由是(3)一种含Ga化合物晶胞如图甲,三个晶胞围成一个六棱柱,如图乙,该化合物的化学式为
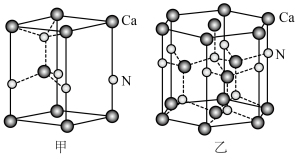
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】回答下列问题:
(1)对具有下列价电子排布的Ni或As进行光谱实验,用光谱仪一定能摄取到原子发射光谱的是____ (填字母)。
(2)Fe成为阳离子时首先失去____ 轨道电子,Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式为____ 。
(3)羟基磷灰石[Ca(PO4)3OH]是牙齿中的重要矿物质,其中羟基(—OH)中氧原子的杂化方式为___ ,PO 的空间构型为
的空间构型为____ ,该化合物所含元素电负性最大的是____ 。
(4)向胆矾溶液中滴加氨水至过量,最终得到深蓝色的透明溶液,再加入乙醇后析出深蓝色晶体,写出生成深蓝色透明溶液的离子方程式___ 。
(5)H2O与CH3CH2OH可以任意比例互溶,原因是____ 、____ (回答两点)。
(6)抗坏血酸的分子结构如图所示,分子中碳原子的轨道杂化类型为____ ,分子中有____ 个手性碳原子。
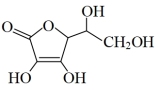
(1)对具有下列价电子排布的Ni或As进行光谱实验,用光谱仪一定能摄取到原子发射光谱的是
| A.Ni:3d10 | B.As:4s24p 4p 4p 4p 4p |
C.As: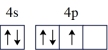 | D.Ni: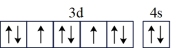 |
(3)羟基磷灰石[Ca(PO4)3OH]是牙齿中的重要矿物质,其中羟基(—OH)中氧原子的杂化方式为
 的空间构型为
的空间构型为(4)向胆矾溶液中滴加氨水至过量,最终得到深蓝色的透明溶液,再加入乙醇后析出深蓝色晶体,写出生成深蓝色透明溶液的离子方程式
(5)H2O与CH3CH2OH可以任意比例互溶,原因是
(6)抗坏血酸的分子结构如图所示,分子中碳原子的轨道杂化类型为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
(1)基态Fe2+的简化电子排布式为___________ 。
(2)实验室可用KSCN、苯酚(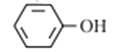 )来检验Fe3+ 。N、O、S三种元素的第一电离能由大到小的顺序为
)来检验Fe3+ 。N、O、S三种元素的第一电离能由大到小的顺序为 ___________ (用元素符号表示),苯酚中碳原子的杂化轨道类型为___________ 。
(3)FeCl3的熔点为306 ℃,沸点为315 ℃。FeCl3的晶体类型是___________ 。FeSO4常作净水剂和补铁剂,SO 的立体构型是
的立体构型是___________ 。
(4)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1 mol Fe(CO)5分子中含___________ molσ键,与CO互为等电子体的离子是 ___________ (填化学式,写一种)。
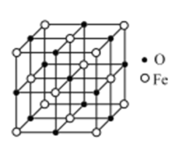
(5)氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为ρg/cm3 ,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为___________ ;Fe2+与O2-最短核间为 ___________ pm(列出表达式即可)。
(1)基态Fe2+的简化电子排布式为
(2)实验室可用KSCN、苯酚(
 )来检验Fe3+ 。N、O、S三种元素的第一电离能由大到小的顺序为
)来检验Fe3+ 。N、O、S三种元素的第一电离能由大到小的顺序为 (3)FeCl3的熔点为306 ℃,沸点为315 ℃。FeCl3的晶体类型是
 的立体构型是
的立体构型是(4)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1 mol Fe(CO)5分子中含
(5)氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为ρg/cm3 ,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】我国科学家最近开发了柔性热电材料β—硒化银(β—Ag2Se),其功能与半导体材料硫化铋(Bi2Te3)媲美。氧、硫、硒、碲位于同主族,原子序数依次增大。请回答下列问题:
(1)基态硒原子的价层电子排布式为_______ 。铋与砷位于同主族,基态铋原子有_______ 个未成对电子。
(2)简单气态氢化物H2O、H2S、H2Se、H2Te中,稳定性依次减弱,其主要原因是_______ ,其沸点最低的是_______ (填化学式)。
(3)我国科学家利用亚硒酸盐和硫酸盐追踪固氮酶取得新进展。SeO 的空间构型是
的空间构型是_______ ,TeO 中Te的杂化类型是
中Te的杂化类型是_______ 。
(4)三氧化硒(SeO3)的熔点为165℃,在126℃时升华。SeO3的晶体类型是_______ 。
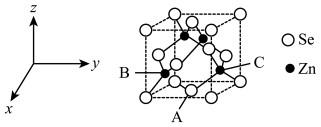
(5)半导体材料硒化锌的晶胞如图所示。以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。在ZnSe晶胞坐标系中,A点硒原子坐标为 ,B点锌原子坐标为
,B点锌原子坐标为 ,则C点锌原子坐标为
,则C点锌原子坐标为_______ 。已知面心上硒与顶点硒之间距离为anm, 代表阿伏加德罗常数的值。硒化锌晶体密度为
代表阿伏加德罗常数的值。硒化锌晶体密度为_______ g·cm-3。
(1)基态硒原子的价层电子排布式为
(2)简单气态氢化物H2O、H2S、H2Se、H2Te中,稳定性依次减弱,其主要原因是
(3)我国科学家利用亚硒酸盐和硫酸盐追踪固氮酶取得新进展。SeO
 的空间构型是
的空间构型是 中Te的杂化类型是
中Te的杂化类型是(4)三氧化硒(SeO3)的熔点为165℃,在126℃时升华。SeO3的晶体类型是
(5)半导体材料硒化锌的晶胞如图所示。以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。在ZnSe晶胞坐标系中,A点硒原子坐标为
 ,B点锌原子坐标为
,B点锌原子坐标为 ,则C点锌原子坐标为
,则C点锌原子坐标为 代表阿伏加德罗常数的值。硒化锌晶体密度为
代表阿伏加德罗常数的值。硒化锌晶体密度为
您最近一年使用:0次



