我国科学家最近开发了柔性热电材料β—硒化银(β—Ag2Se),其功能与半导体材料硫化铋(Bi2Te3)媲美。氧、硫、硒、碲位于同主族,原子序数依次增大。请回答下列问题:
(1)基态硒原子的价层电子排布式为_______ 。铋与砷位于同主族,基态铋原子有_______ 个未成对电子。
(2)简单气态氢化物H2O、H2S、H2Se、H2Te中,稳定性依次减弱,其主要原因是_______ ,其沸点最低的是_______ (填化学式)。
(3)我国科学家利用亚硒酸盐和硫酸盐追踪固氮酶取得新进展。SeO 的空间构型是
的空间构型是_______ ,TeO 中Te的杂化类型是
中Te的杂化类型是_______ 。
(4)三氧化硒(SeO3)的熔点为165℃,在126℃时升华。SeO3的晶体类型是_______ 。
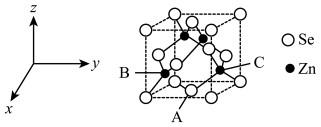
(5)半导体材料硒化锌的晶胞如图所示。以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。在ZnSe晶胞坐标系中,A点硒原子坐标为 ,B点锌原子坐标为
,B点锌原子坐标为 ,则C点锌原子坐标为
,则C点锌原子坐标为_______ 。已知面心上硒与顶点硒之间距离为anm, 代表阿伏加德罗常数的值。硒化锌晶体密度为
代表阿伏加德罗常数的值。硒化锌晶体密度为_______ g·cm-3。
(1)基态硒原子的价层电子排布式为
(2)简单气态氢化物H2O、H2S、H2Se、H2Te中,稳定性依次减弱,其主要原因是
(3)我国科学家利用亚硒酸盐和硫酸盐追踪固氮酶取得新进展。SeO
 的空间构型是
的空间构型是 中Te的杂化类型是
中Te的杂化类型是(4)三氧化硒(SeO3)的熔点为165℃,在126℃时升华。SeO3的晶体类型是
(5)半导体材料硒化锌的晶胞如图所示。以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。在ZnSe晶胞坐标系中,A点硒原子坐标为
 ,B点锌原子坐标为
,B点锌原子坐标为 ,则C点锌原子坐标为
,则C点锌原子坐标为 代表阿伏加德罗常数的值。硒化锌晶体密度为
代表阿伏加德罗常数的值。硒化锌晶体密度为
21-22高三下·山东·开学考试 查看更多[2]
更新时间:2022-02-20 08:46:10
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】ⅤA族元素有的是金属元素,有的是非金属元素,应用非常广泛。回答下列问题:
(1)基态P原子的价层电子排布式为_______ 。
(2)氮原子与碳原子形成六元环状结构,再通过相互连接形成层状“类石墨”晶体结构,有良好的光催化性能。如图是这种石墨相共价化合物的单层结构。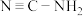 )为原料在不断加热条件下制得,其中双氰胺和三聚氰胺分别是加热至203℃和234℃时得到的中间产物,三聚氰胺的分子式为
)为原料在不断加热条件下制得,其中双氰胺和三聚氰胺分别是加热至203℃和234℃时得到的中间产物,三聚氰胺的分子式为_______ 。
②这种化合物中的氮原子与碳原子杂化方式是______ ,结构图空框中是晶体的末尾含氢 官能团,该官能团的结构简式为_______ 。
③下列有关这种化合物说法不正确 的是______ 。
A.两种结构相似的完美共价晶体熔点:氮化碳<氮化硅
B.激发态 原子可能的电子排布式为:
原子可能的电子排布式为: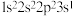
C.这种化合物每个六元环含有2个碳原子和2个氮原子
D.已知苯胺的碱性比氨弱,所以氨基氰的碱性也比氨弱
(3)立方氮化硼(CBN)晶体的极端条件性能稳定,是理想的第三代半导体材料,其结构如图所示。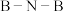 的键角为
的键角为______ 。
② 原子分数坐标为
原子分数坐标为 ,则原子
,则原子 的坐标为
的坐标为______ 。
(1)基态P原子的价层电子排布式为
(2)氮原子与碳原子形成六元环状结构,再通过相互连接形成层状“类石墨”晶体结构,有良好的光催化性能。如图是这种石墨相共价化合物的单层结构。

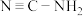 )为原料在不断加热条件下制得,其中双氰胺和三聚氰胺分别是加热至203℃和234℃时得到的中间产物,三聚氰胺的分子式为
)为原料在不断加热条件下制得,其中双氰胺和三聚氰胺分别是加热至203℃和234℃时得到的中间产物,三聚氰胺的分子式为②这种化合物中的氮原子与碳原子杂化方式是
③下列有关这种化合物说法
A.两种结构相似的完美共价晶体熔点:氮化碳<氮化硅
B.激发态
 原子可能的电子排布式为:
原子可能的电子排布式为: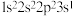
C.这种化合物每个六元环含有2个碳原子和2个氮原子
D.已知苯胺的碱性比氨弱,所以氨基氰的碱性也比氨弱
(3)立方氮化硼(CBN)晶体的极端条件性能稳定,是理想的第三代半导体材料,其结构如图所示。

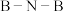 的键角为
的键角为②
 原子分数坐标为
原子分数坐标为 ,则原子
,则原子 的坐标为
的坐标为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】现有X、Y、Z、W、R五种前四周期的元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
(1)R元素位于元素周期表的_______ 区。已知该元素的+3价离子比+2价离子稳定,请简述其原因:___________ 。
(2)W的基态原子含有______ 个原子轨道,其中电子所占据的最高能级的原子轨道呈_______ 形。
(3)X、Y、Z、W的最高价氧化物对应水化物的酸性由强到弱的顺序为______________ (用化学式表示)。
(4)YW3的电子式为__________ 。该物质遇水会发生水解反应,生成HYO2,同时产生白雾,写出该反应的化学方程式:_________________________ 。
| X元素是形成化合物种类最多的元素 |
| Y元素基态原子的核外p电子比s电子多3个 |
| Z元素最高正价与最低负价的代数和为4 |
| W元素主族序数与周期数的差为4 |
| R元素位于元素周期表中的第八列 |
(2)W的基态原子含有
(3)X、Y、Z、W的最高价氧化物对应水化物的酸性由强到弱的顺序为
(4)YW3的电子式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】耐HF腐蚀的催化剂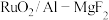 ,可应用于氟化工行业中的氯循环(如图)。
,可应用于氟化工行业中的氯循环(如图)。
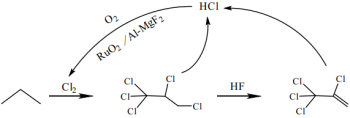
(1)Ru的价电子排布式为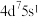 ,该元素位于第
,该元素位于第_______ 周期_______ 族。
(2)上述转化过程中涉及的有机反应类型有_______ 。
(3)可通过液化分离出HCl中大多数的HF,从结构角度解释两者沸点差异的原因_______ 。
(4) 、
、 、
、 的晶体结构如图(
的晶体结构如图( 和
和 中实线部分为晶胞)
中实线部分为晶胞)

① 晶胞中有
晶胞中有_______ 个Ru,O在晶胞的位置为_______ 。
②已知 与载体晶体结构(堆积方式、晶胞参数)越相似,催化效果越好。
与载体晶体结构(堆积方式、晶胞参数)越相似,催化效果越好。 载体中掺杂
载体中掺杂 的原因是
的原因是_______ 。
 ,可应用于氟化工行业中的氯循环(如图)。
,可应用于氟化工行业中的氯循环(如图)。
(1)Ru的价电子排布式为
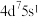 ,该元素位于第
,该元素位于第(2)上述转化过程中涉及的有机反应类型有
(3)可通过液化分离出HCl中大多数的HF,从结构角度解释两者沸点差异的原因
(4)
 、
、 、
、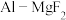 的晶体结构如图(
的晶体结构如图( 和
和 中实线部分为晶胞)
中实线部分为晶胞)
①
 晶胞中有
晶胞中有②已知
 与载体晶体结构(堆积方式、晶胞参数)越相似,催化效果越好。
与载体晶体结构(堆积方式、晶胞参数)越相似,催化效果越好。 载体中掺杂
载体中掺杂 的原因是
的原因是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】新型半导体材料GaN、SiC主要应用于功率半导体、射频和光电器件领域。
(1)N、Si、Ga三种元素的基态原子中,第一电离能由大到小的顺序是______ ,其中未成对电子数最少原子的外围电子排布式为______ ,该元素位于周期表的______ 区。
(2)制备GaN的工艺中用到GaCl3。GaCl3分子的空间构型为______ ,其中Ga的杂化方式为______ ;GaCl3的熔点为77.9℃,GaN的熔点为1700℃,二者熔点差异的原因是______ 。
(3)GaN的一种六方晶胞如图所示,晶胞参数为anm、cnm。晶体中N原子的配位数为______ ;晶体密度ρ=______ g·cm-3(设阿伏加德罗常数的值为NA,用含a、c、NA的代数式表示)。
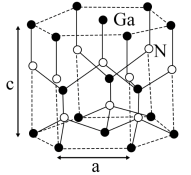
(1)N、Si、Ga三种元素的基态原子中,第一电离能由大到小的顺序是
(2)制备GaN的工艺中用到GaCl3。GaCl3分子的空间构型为
(3)GaN的一种六方晶胞如图所示,晶胞参数为anm、cnm。晶体中N原子的配位数为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】A、B、C、D四种元素,A最高能级电子排布式为2p3,B元素的电负性是所有元素中最大的,其单质只能做氧化剂,C是第三周期元素,其第一到第五电离能(kJ·mol-1)数据依次为578、1817、2745、11575、14830,D原子核外有14种不同的运动状态的电子,请回答下列问题:
(1)DB4分子中心原子杂化轨道类型为___________ ,AB3的分子构型为___________ ;CB3的熔点是1040℃,不溶于有机溶剂,则该晶体的晶体类型为___________ 。
(2)A、B两元素形成的常见气态氢化物的沸点A<B,其最主要的原因是___________ 。
(3)A与铜元素形成的某种化合物的晶胞结构如图所示,若该晶体的密度为ρg·cm-3,该晶体的晶胞参数a=___________ pm(设阿伏加德罗常数的值为NA)。

(1)DB4分子中心原子杂化轨道类型为
(2)A、B两元素形成的常见气态氢化物的沸点A<B,其最主要的原因是
(3)A与铜元素形成的某种化合物的晶胞结构如图所示,若该晶体的密度为ρg·cm-3,该晶体的晶胞参数a=

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】铁和硒(Se)都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用,回答下列问题:
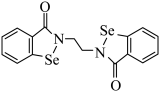
(1)乙烷硒啉(Ethaselen)是一种抗癌新药,其结构简式如图:_______ 种;
②酸性比较:
_______  (填“>”、“<”或“=”),
(填“>”、“<”或“=”), 的空间构型为
的空间构型为_______ 。
(2)检验 可用配合物
可用配合物 ,该配合物中,中心离子为
,该配合物中,中心离子为_______ ,配位体为_______ ,配位数为_______ 。
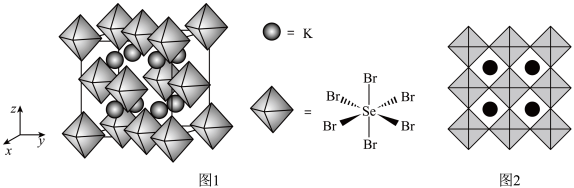
(3)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。_______ 。
②设X的式量为Mr,晶体密度为 ,则X晶胞中相邻K之间的最短距离为
,则X晶胞中相邻K之间的最短距离为_______ pm(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(1)乙烷硒啉(Ethaselen)是一种抗癌新药,其结构简式如图:
②酸性比较:

 (填“>”、“<”或“=”),
(填“>”、“<”或“=”), 的空间构型为
的空间构型为(2)检验
 可用配合物
可用配合物 ,该配合物中,中心离子为
,该配合物中,中心离子为(3)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。
②设X的式量为Mr,晶体密度为
 ,则X晶胞中相邻K之间的最短距离为
,则X晶胞中相邻K之间的最短距离为 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】短周期p区元素共有13种,除铝外全部是非金属元素。
(1)基态氮原子的价层电子排布图为_________ ;短周期p区元素中,第一电离能最小的元素与电负性最大的元素组成的化合物是_________ (填化学式)
(2)卤素与硼、氮、磷可形成BF3、NCl3和PBr3,下列有关三种分子的叙述正确的是_________
A.化学键类型相同 B.空间构型相同
C.中心原子的杂化轨道类型相同 D.中心原子的价层电子对数相同
(3)CS2是一种溶剂,它能溶解硫磺。写出一种与CS2具有相同空间构型和键合形式的分子或离子_________ 。CO能与Ni形成正四面体型的配合物Ni(CO)4,3.42gNi(CO)4中含有_________ molσ键
(4)CCl4与水互不相溶,SiCl4与CCl4分子结构相似,但SiCl4遇水易发生水解反应,导致二者性质不同的原因是____________________________________ 。
(5)铝的几种卤化物的熔点如下:
AlBr3的晶体类型是_________ ,AlI3晶体中存在的作用力有_________ 。
(6)氮化铝晶体为原子晶体,是一种新型无机非金属材料,其晶体密度为a g∙cm−3,晶胞如图所示。

①铝原子的配位数为_________ 。
②设NA为阿伏伽德罗常数的值。氮化铝晶胞中,铝原子和氮原子之间最短的核间距为_________ nm。
(1)基态氮原子的价层电子排布图为
(2)卤素与硼、氮、磷可形成BF3、NCl3和PBr3,下列有关三种分子的叙述正确的是
A.化学键类型相同 B.空间构型相同
C.中心原子的杂化轨道类型相同 D.中心原子的价层电子对数相同
(3)CS2是一种溶剂,它能溶解硫磺。写出一种与CS2具有相同空间构型和键合形式的分子或离子
(4)CCl4与水互不相溶,SiCl4与CCl4分子结构相似,但SiCl4遇水易发生水解反应,导致二者性质不同的原因是
(5)铝的几种卤化物的熔点如下:
| 卤化铝 | AlF3 | AlCl3 | AlBr3 | AlI3 |
| 熔点/℃ | 1040 | 190 | 97.5 | 191 |
AlBr3的晶体类型是
(6)氮化铝晶体为原子晶体,是一种新型无机非金属材料,其晶体密度为a g∙cm−3,晶胞如图所示。

①铝原子的配位数为
②设NA为阿伏伽德罗常数的值。氮化铝晶胞中,铝原子和氮原子之间最短的核间距为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】据近期《科学》杂志报道,我国科学家将钾40原子与钠23、钾40分子混合,并制备了基态中的不同超精细能级状态,首次观测到超低温下原子分子间的碰撞共振。回答下列问题:
(1)基态K原子的电子排布式为___________ 。基态钠原子电子云有_________ 个伸展方向,原子核外有_________ 种不同的电子运动状态。
(2)第一电离能:K_________ Na(填“>”“<”或“=”),理由是_________ 。
(3)钠、钾都能与氢气反应生成金属氢化物,NaH、KH是两种常见的供氢剂。晶体熔点:NaH_______ KH(填“>”“<”或“=”),理由是______________________________ 。
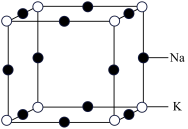
(4)钠、钾组成合金M,M的晶胞如图所示。M中钠、钾原子个数比为_______________ 。
(5)NaAlH4是有机合成的常用还原剂,其晶胞结构如图所示。NA是阿伏伽德罗常数的值。
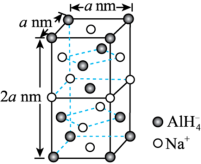
①AlH4的空间构型是_______________ ,铝原子的杂化类型是_______________ 。
②NaAlH4晶体密度为_______________ g·cm3(用含a和NA的代数式表示)。
(1)基态K原子的电子排布式为
(2)第一电离能:K
(3)钠、钾都能与氢气反应生成金属氢化物,NaH、KH是两种常见的供氢剂。晶体熔点:NaH
(4)钠、钾组成合金M,M的晶胞如图所示。M中钠、钾原子个数比为

(5)NaAlH4是有机合成的常用还原剂,其晶胞结构如图所示。NA是阿伏伽德罗常数的值。

①AlH4的空间构型是
②NaAlH4晶体密度为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子数相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2,其中C的常见化合价为+3,+2价。回答下列问题:
(1)C3+的电子排布式为___________ ,其单质的晶体中,原子间以___________ (填化学键类型)相互结合
(2)四种元素中第一电离能最小的是____ (填元素名称),电负性最大的元素的核外电子排布图为:____
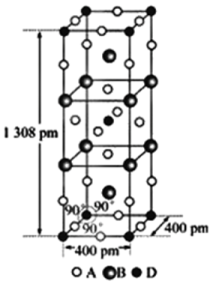
(3)A、B和D三种元素组成的一个化合物的晶胞如图所示。该化合物的化学式为___ ;D的配位数为___ ;
(1)C3+的电子排布式为
(2)四种元素中第一电离能最小的是
(3)A、B和D三种元素组成的一个化合物的晶胞如图所示。该化合物的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】钾、碘、铁元素对人体的健康起到至关重要的作用,回答下列问题:
(1)基态K原子核外有______ 种不同运动状态的电子,有_____ 种不同形状的电子云,价电子排布式是__________________ 。
(2)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253K,沸点为376K,其固体属于____ 晶体。
(3)赤铁盐(K3[Fe(CN)6])主要用于制药、电镀等工业,其煅烧分解生成KCN、(CN)2等物质。
①(CN)2中存在碳碳键,则分子中含有___ 个σ键,___ 个π键。
②KCN与盐酸作用产生HCN,则HCN中心原子C的杂化轨道类型__________________ 。
(4)KIO3晶体是一种性能良好的非线型光学材料,具有钙钛矿型的立体结构。
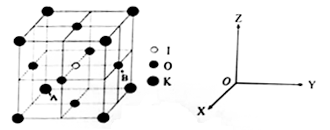
①已知A离子坐标参数为(0,0,0),则B离子的坐标参数________________ 。
②若KIO3晶胞参数为a纳米(nm)、阿伏伽德罗常数为NA,则该晶体密度为_____ g·cm-3(列出计算式即可)。
③若碘原子处在各顶点位置,则钾离子和氧原子在晶胞中的位置分别是_______ 、___________ 。
(1)基态K原子核外有
(2)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253K,沸点为376K,其固体属于
(3)赤铁盐(K3[Fe(CN)6])主要用于制药、电镀等工业,其煅烧分解生成KCN、(CN)2等物质。
①(CN)2中存在碳碳键,则分子中含有
②KCN与盐酸作用产生HCN,则HCN中心原子C的杂化轨道类型
(4)KIO3晶体是一种性能良好的非线型光学材料,具有钙钛矿型的立体结构。

①已知A离子坐标参数为(0,0,0),则B离子的坐标参数
②若KIO3晶胞参数为a纳米(nm)、阿伏伽德罗常数为NA,则该晶体密度为
③若碘原子处在各顶点位置,则钾离子和氧原子在晶胞中的位置分别是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】金属K和C60能够发生反应产生一系列金属球碳盐KxC60,部分金属球碳盐具有超导性,是球碳族化合物的研究热点之一。
(1)金属K中含有的化学键是___________ 键。
(2)C60晶体中分子密堆积,其晶胞结构如图所示。C60晶体属于___________ 晶体,每个C60分子周围等距离且紧邻的C60有___________ 个。 位于立方体晶胞的顶点和面心,K+位于晶胞的体心和棱心,另外晶胞内还有8个K+。
位于立方体晶胞的顶点和面心,K+位于晶胞的体心和棱心,另外晶胞内还有8个K+。___________ 。
② KxC60的熔点高于C60,原因是___________ 。
(1)金属K中含有的化学键是
(2)C60晶体中分子密堆积,其晶胞结构如图所示。C60晶体属于

 位于立方体晶胞的顶点和面心,K+位于晶胞的体心和棱心,另外晶胞内还有8个K+。
位于立方体晶胞的顶点和面心,K+位于晶胞的体心和棱心,另外晶胞内还有8个K+。
② KxC60的熔点高于C60,原因是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】碳及其化合物广泛存在于自然界中,回答下列问题:
(1)碳在形成化合物时,其键型以共价键为主,原因是___________________________ 。
(2)C2H2分子的电子式为_______ ,C原子的杂化轨道类型是_______ 。
(3)CO 能与金属Fe、Ni 分别形成Fe(CO) 5、Ni(CO) 4,Fe(CO) 5 中Fe 元素的原子核外电子排布为________________ ,Ni(CO) 4 是无色液体,沸点42.1℃,熔点﹣19.3℃,难溶于水,易溶于有机溶剂推测Ni(CO) 4是_________ (填“分子、原子、金属或离子”)晶体。
(4)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如下图所示:
①在石墨烯晶体中,每个C原子连接____ 个六元环,每个六元环占有____ 个C原子。
②在金刚石晶胞中,每个晶胞平均占有_____ 个C原子,若距离最近的两碳原子的距离为L cm,晶胞边长为a cm,根据硬球接触模型,则L=______ a,用a及NA的代数式表示金刚石晶胞的密度______________________________ g/mL。
(1)碳在形成化合物时,其键型以共价键为主,原因是
(2)C2H2分子的电子式为
(3)CO 能与金属Fe、Ni 分别形成Fe(CO) 5、Ni(CO) 4,Fe(CO) 5 中Fe 元素的原子核外电子排布为
(4)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如下图所示:

①在石墨烯晶体中,每个C原子连接
②在金刚石晶胞中,每个晶胞平均占有
您最近一年使用:0次



