揭示土壤的成分从矿物开始。橄榄石属于镁铁质矿物的一种,主要成分是铁或镁的硅酸盐,同时含有锰、镍、钴等元素,晶体呈现粒状,属于岛状硅酸盐。回答下列问题:
(1)基态Co原子的核外电子占据的3d能级上的成对电子是_______ 个。
(2)Mn和Fe的各级电离能如下。
Mn与Fe相比,I1和I2较小,而I3较大,其原因是_______ 。
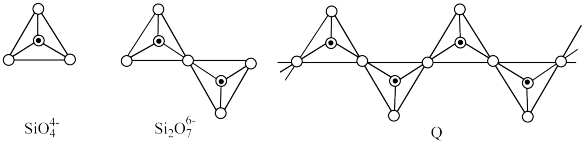
(3)在硅酸盐中,原硅酸根离子和多硅酸根离子结构如图所示(图中 表示氧原子,
表示氧原子, 表示Si-O),若多硅酸根离子Q中硅原子数为n,则该离子符号为
表示Si-O),若多硅酸根离子Q中硅原子数为n,则该离子符号为_______ ,在此结构中每个Si原子与_______ 个O原子相连,这几个O原子形成的空间结构是_______ 。
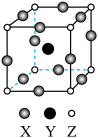
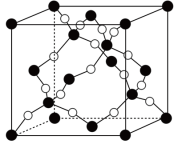
(4)下图是某橄榄石的晶胞结构,用NA表示阿伏加德罗常数的值。

① 中Si原子的杂化类型是
中Si原子的杂化类型是_______ 。
②该晶体的化学式为_______ 。Mg原子周围最近的Fe原子有_______ 个。
③该晶体的密度是_______ g·cm-3(用含a、b、NA的代数式表示)。
(1)基态Co原子的核外电子占据的3d能级上的成对电子是
(2)Mn和Fe的各级电离能如下。
| 电离能/(kJ ·mol-1) | I1 | I2 | I3 | I4 | I5 |
| Mn | 717.3 | 1509.0 | 3 248 | 4940 | 6990 |
| Fe | 762. 5 | 1561.9 | 2957 | 5 290 | 7240 |
(3)在硅酸盐中,原硅酸根离子和多硅酸根离子结构如图所示(图中
 表示氧原子,
表示氧原子, 表示Si-O),若多硅酸根离子Q中硅原子数为n,则该离子符号为
表示Si-O),若多硅酸根离子Q中硅原子数为n,则该离子符号为
(4)下图是某橄榄石的晶胞结构,用NA表示阿伏加德罗常数的值。

①
 中Si原子的杂化类型是
中Si原子的杂化类型是②该晶体的化学式为
③该晶体的密度是
更新时间:2022-07-25 20:17:05
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】
硒化锌是一种透明色半导体,也可作为红外光学材料,熔点是1 520 ℃。
(1)基态锌原子的价电子排布式是________ 。
(2)根据元素周期律,电负性Se________ S,第一电离能Se________ As(填“>”或“<”)。
(3)H2S分子的电子式:________ ,H2Se分子构型是_______ ,
其中硒原子的杂化轨道类型是________ 。
(4)H2O的沸点高于H2Se的沸点(-42 ℃),其原因是________ 。
(5)晶体Zn为六方最密堆积,其配位数是________ 。
(6)ZnSe晶胞如图,假设阿伏伽德罗常数的值为NA,则144 g ZnSe晶体中的晶胞数是________ 。
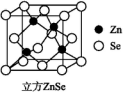
硒化锌是一种透明色半导体,也可作为红外光学材料,熔点是1 520 ℃。
(1)基态锌原子的价电子排布式是
(2)根据元素周期律,电负性Se
(3)H2S分子的电子式:
其中硒原子的杂化轨道类型是
(4)H2O的沸点高于H2Se的沸点(-42 ℃),其原因是
(5)晶体Zn为六方最密堆积,其配位数是
(6)ZnSe晶胞如图,假设阿伏伽德罗常数的值为NA,则144 g ZnSe晶体中的晶胞数是

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】磷酸氯喹在细胞水平上能有效抑制新型冠状病毒(SARS-CoV-2)的感染。磷酸氯喹的结构如图所示,据此回答下列问题。_____ 。
(2)C、N、O三种元素电负性从大到小的顺序为_____ ;第一电离能I1(P)_____ I1(Cl)(填“>”或“<”)。
(3)钴的一种化合物的晶胞结构如图所示,已知A点的原子坐标参数为(0,0,0),B点为( ,0,
,0, ),则C点的原子坐标参数为
),则C点的原子坐标参数为_____ 。_____ (用化学式表示)。_____ 。

(2)C、N、O三种元素电负性从大到小的顺序为
(3)钴的一种化合物的晶胞结构如图所示,已知A点的原子坐标参数为(0,0,0),B点为(
 ,0,
,0, ),则C点的原子坐标参数为
),则C点的原子坐标参数为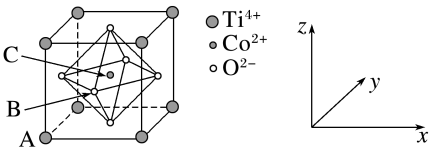

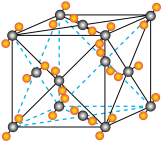
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
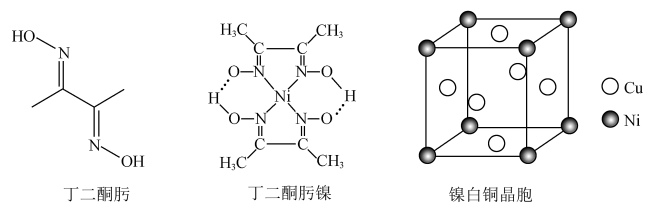
【推荐1】东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)硫酸镍溶于氨水形成 蓝色溶液。
蓝色溶液。
① 中阴离子的立体构型是
中阴离子的立体构型是_______ 。
②在 中存在哪些化学键
中存在哪些化学键_______ 。
A.离子键 B.配位键 C.金属键 D.极性共价键
③ 、
、 、
、 的沸点由高到低的顺序为
的沸点由高到低的顺序为_______ (填化学式,下同),还原性由强到弱的顺序为_______ ,键角由大到小的顺序为_______ 。
(2)丁二酮肟是检验 的灵敏试剂。丁二酮肟分子(
的灵敏试剂。丁二酮肟分子(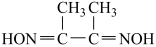 )中C原子轨道杂化类型为
)中C原子轨道杂化类型为_______ ,1mol丁二酮肟分子所含 键的数目为
键的数目为_______ 。
(3)配合物 常温下为液体,易溶于
常温下为液体,易溶于 、苯等有机溶剂。
、苯等有机溶剂。 中
中 与
与 的
的 原子形成配位键。不考虑空间构型,
原子形成配位键。不考虑空间构型, 的结构可用示意图表示为
的结构可用示意图表示为_____ (用“→”表示出配位键)。
(4)①氨硼烷( )分子中,
)分子中, 化学键称为
化学键称为_______ 键,其电子对由_______ 原子提供。 分子中,与
分子中,与 原子相连的
原子相连的 呈正电性(
呈正电性(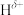 ),与
),与 原子相连的
原子相连的 呈负电性(
呈负电性(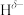 ),组成元素电负性大小顺序是
),组成元素电负性大小顺序是_______ 。与 原子总数相等的等电子体是
原子总数相等的等电子体是_______ (写分子式)。
②氨硼烷在催化剂作用下水解释放氢气: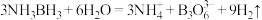 ,
, 的结构为
的结构为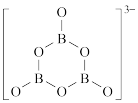 。在该反应中,B原子的杂化轨道类型由
。在该反应中,B原子的杂化轨道类型由_______ 变为_______ 。
(1)硫酸镍溶于氨水形成
 蓝色溶液。
蓝色溶液。①
 中阴离子的立体构型是
中阴离子的立体构型是②在
 中存在哪些化学键
中存在哪些化学键A.离子键 B.配位键 C.金属键 D.极性共价键
③
 、
、 、
、 的沸点由高到低的顺序为
的沸点由高到低的顺序为(2)丁二酮肟是检验
 的灵敏试剂。丁二酮肟分子(
的灵敏试剂。丁二酮肟分子(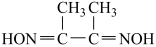 )中C原子轨道杂化类型为
)中C原子轨道杂化类型为 键的数目为
键的数目为(3)配合物
 常温下为液体,易溶于
常温下为液体,易溶于 、苯等有机溶剂。
、苯等有机溶剂。 中
中 与
与 的
的 原子形成配位键。不考虑空间构型,
原子形成配位键。不考虑空间构型, 的结构可用示意图表示为
的结构可用示意图表示为(4)①氨硼烷(
 )分子中,
)分子中, 化学键称为
化学键称为 分子中,与
分子中,与 原子相连的
原子相连的 呈正电性(
呈正电性( ),与
),与 原子相连的
原子相连的 呈负电性(
呈负电性( ),组成元素电负性大小顺序是
),组成元素电负性大小顺序是 原子总数相等的等电子体是
原子总数相等的等电子体是②氨硼烷在催化剂作用下水解释放氢气:
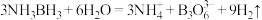 ,
, 的结构为
的结构为 。在该反应中,B原子的杂化轨道类型由
。在该反应中,B原子的杂化轨道类型由
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】铁、铜、锌是形成许多金属材料和有机材料的重要组成元素。回答下列问题:
(1)金属铜在元素周期表_______ 区。
(2)铜和锌同周期且相邻,现有几种铜、锌元素的相应状态,①锌: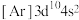 、②锌:
、②锌: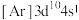 、③铜:
、③铜: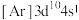 、④铜:
、④铜: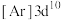 ,失去1个电子需要的能量由大到小排序是
,失去1个电子需要的能量由大到小排序是_______ 。
(3)向 溶液中滴加氨水可以得到
溶液中滴加氨水可以得到 型离子化合物,其阳离子结构如图所示。
型离子化合物,其阳离子结构如图所示。_______ 。
A.该阳离子中存在的化学键有极性共价键、配位键和氢键
B.溶液中的阴离子为正四面体结构
C.电负性大小:
D.往该溶液中继续加95%乙醇,并用玻璃棒摩擦试管壁,析出深蓝色晶体
②该化合物加热时首先失去的组分是 ,原因是
,原因是_______ 。
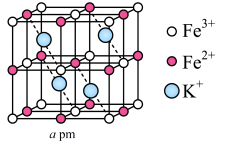
(4)铁及其化合物在生产、生活中有重要应用。
①改性 是一种优良的磁性材料,该
是一种优良的磁性材料,该 晶胞的
晶胞的 的结构如图所示,研究发现结构中的
的结构如图所示,研究发现结构中的 只可能出现在图中某一“▲”所示位置上,请确定
只可能出现在图中某一“▲”所示位置上,请确定 所在晶胞的位置
所在晶胞的位置_______ (填a或b或c)。 。铁-氰骨架组成小立方体,Fe粒子在顶点,
。铁-氰骨架组成小立方体,Fe粒子在顶点, 在棱上,两端均与Fe相连,立方体中心空隙可容纳
在棱上,两端均与Fe相连,立方体中心空隙可容纳 ,如图所示(
,如图所示( 在图中省略)。普鲁士蓝中
在图中省略)。普鲁士蓝中 与
与 个数之比为
个数之比为_______ ;该晶胞的化学式为_______ 。
(1)金属铜在元素周期表
(2)铜和锌同周期且相邻,现有几种铜、锌元素的相应状态,①锌:
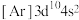 、②锌:
、②锌: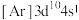 、③铜:
、③铜: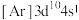 、④铜:
、④铜: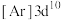 ,失去1个电子需要的能量由大到小排序是
,失去1个电子需要的能量由大到小排序是(3)向
 溶液中滴加氨水可以得到
溶液中滴加氨水可以得到 型离子化合物,其阳离子结构如图所示。
型离子化合物,其阳离子结构如图所示。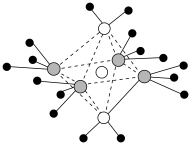
A.该阳离子中存在的化学键有极性共价键、配位键和氢键
B.溶液中的阴离子为正四面体结构
C.电负性大小:

D.往该溶液中继续加95%乙醇,并用玻璃棒摩擦试管壁,析出深蓝色晶体

②该化合物加热时首先失去的组分是
 ,原因是
,原因是(4)铁及其化合物在生产、生活中有重要应用。
①改性
 是一种优良的磁性材料,该
是一种优良的磁性材料,该 晶胞的
晶胞的 的结构如图所示,研究发现结构中的
的结构如图所示,研究发现结构中的 只可能出现在图中某一“▲”所示位置上,请确定
只可能出现在图中某一“▲”所示位置上,请确定 所在晶胞的位置
所在晶胞的位置
 。铁-氰骨架组成小立方体,Fe粒子在顶点,
。铁-氰骨架组成小立方体,Fe粒子在顶点, 在棱上,两端均与Fe相连,立方体中心空隙可容纳
在棱上,两端均与Fe相连,立方体中心空隙可容纳 ,如图所示(
,如图所示( 在图中省略)。普鲁士蓝中
在图中省略)。普鲁士蓝中 与
与 个数之比为
个数之比为
您最近一年使用:0次
【推荐3】Ⅰ.铁是地壳中含量第二位的金属元素,其单质、合金及众多的化合物在生产生活中都有广泛的应用,请回答下问题:
(1)写出铁元素在周期表中的位置:_____ ;写出Fe2+的价电子排布式_____ 。
(2)某种铁的化合物俗称“绿矾”,化学式为FeSO4•7H2O,“绿矾”中SO 的空间构型为
的空间构型为____ (用文字描述),其中S的杂化轨道类型为_____ 。
Ⅱ.铁能形成多种配合物,其中一种配合物Fe(CO)5的熔点为-20℃,沸点为103℃,可用于制备纯铁,请回答下列问题:
(3)Fe(CO)5晶体类型属于____ 晶体,配体为:____ 。
(4)价电子数和原子数相同的分子、离子或原子团互称为等电子体,往往具有相似的化学键和构型,请写出与CO互为等电子体的一种阴离子的电子式:____ 。
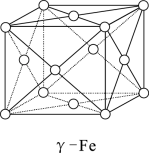
(5)γ—Fe晶体的晶胞为立方晶胞,结构如图所示,其晶胞边长为apm,则γ—Fe单质的密度为____ g/cm3(设NA为阿伏加德罗常数的值,列出算式即可)
(1)写出铁元素在周期表中的位置:
(2)某种铁的化合物俗称“绿矾”,化学式为FeSO4•7H2O,“绿矾”中SO
 的空间构型为
的空间构型为Ⅱ.铁能形成多种配合物,其中一种配合物Fe(CO)5的熔点为-20℃,沸点为103℃,可用于制备纯铁,请回答下列问题:
(3)Fe(CO)5晶体类型属于
(4)价电子数和原子数相同的分子、离子或原子团互称为等电子体,往往具有相似的化学键和构型,请写出与CO互为等电子体的一种阴离子的电子式:
(5)γ—Fe晶体的晶胞为立方晶胞,结构如图所示,其晶胞边长为apm,则γ—Fe单质的密度为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】华东理工大学某研究团队自主研发了一种钙钛矿单晶生长技术,大大缩短了晶体生长周期,实现了多种金属卤化物钙钛矿半导体的低温、快速、可控制备,为新一代高性能光电子器件提供了丰富材料库。钙钛矿的主要成分为 。
。
(1)基态 原子的价层电子排布式为
原子的价层电子排布式为___________ 。
(2)为鉴别某一固体样品是否为晶体,或对某一晶体样品的结构进行精确测定,可选用的实验仪器为___________ (填序号)。
 原子光谱仪
原子光谱仪  红外光谱仪
红外光谱仪  射线衍射仪
射线衍射仪
(3) 的晶胞如图所示,X表示的是
的晶胞如图所示,X表示的是___________ (填“ ”、“
”、“ ”或“O”)元素的离子,晶胞中金属离子与氧离子间的化学键类型为
”或“O”)元素的离子,晶胞中金属离子与氧离子间的化学键类型为___________ 。已知:该晶胞棱长为 ,阿伏加德罗常数为
,阿伏加德罗常数为 的摩尔质量为
的摩尔质量为 ,则该晶体的密度为ρ=
,则该晶体的密度为ρ=___________  。
。 的四卤化物熔点如下表所示,
的四卤化物熔点如下表所示,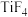 熔点高于其他三种卤化物,自
熔点高于其他三种卤化物,自 至
至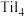 熔点依次升高,原因是
熔点依次升高,原因是___________ 。
(5)单晶硅也是一种常见的半导体材料,常用于太阳能电池板,单晶硅的晶体类型为___________ 晶体。单晶硅熔点___________ 金刚石熔点(填“高于”或“低于”),原因是___________ 。
 。
。(1)基态
 原子的价层电子排布式为
原子的价层电子排布式为(2)为鉴别某一固体样品是否为晶体,或对某一晶体样品的结构进行精确测定,可选用的实验仪器为
 原子光谱仪
原子光谱仪  红外光谱仪
红外光谱仪  射线衍射仪
射线衍射仪(3)
 的晶胞如图所示,X表示的是
的晶胞如图所示,X表示的是 ”、“
”、“ ”或“O”)元素的离子,晶胞中金属离子与氧离子间的化学键类型为
”或“O”)元素的离子,晶胞中金属离子与氧离子间的化学键类型为 ,阿伏加德罗常数为
,阿伏加德罗常数为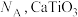 的摩尔质量为
的摩尔质量为 ,则该晶体的密度为ρ=
,则该晶体的密度为ρ= 。
。
 的四卤化物熔点如下表所示,
的四卤化物熔点如下表所示, 熔点高于其他三种卤化物,自
熔点高于其他三种卤化物,自 至
至 熔点依次升高,原因是
熔点依次升高,原因是| 化合物 |  |  | 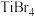 | 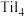 |
熔点 | 377 | 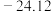 | 38.3 | 155 |
(5)单晶硅也是一种常见的半导体材料,常用于太阳能电池板,单晶硅的晶体类型为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】硒化锌晶胞结构如图所示,其晶胞参数为a pm。
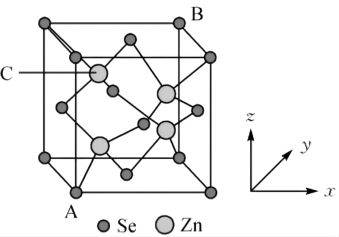
(1)相邻Zn2+的Se2-与之间的距离为_______ pm。
(2)已知原子坐标:A点为(0,0,0), B点为(1,1,1) ,则C点原子坐标为_______ 。
(3)若硒化锌晶体的密度为ρg·cm-3,则阿伏加德罗常数NA=_______ (用含a、ρ的计算式表示)。

(1)相邻Zn2+的Se2-与之间的距离为
(2)已知原子坐标:A点为(0,0,0), B点为(1,1,1) ,则C点原子坐标为
(3)若硒化锌晶体的密度为ρg·cm-3,则阿伏加德罗常数NA=
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】氮化铜是一种在常温下处于亚稳态的半导体材料,由于氮化铜的可多种离子掺杂特性,有可能成为一种性能优异的锂电池负极材料。
(1)写出基态铜原子的外围电子排布式_______ 。
(2)氮元素及其同主族的非金属元素形成的最简单氢化物中,沸点最高的是_______ (填化学式),简述理由_______ 。
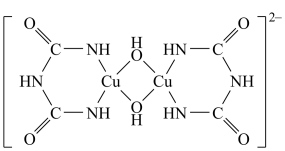
(3)在碱性溶液中缩二脲能与 反应得到特征的紫色配合物,其中的阴离子结构如图所示。该配离子中,配位原子是
反应得到特征的紫色配合物,其中的阴离子结构如图所示。该配离子中,配位原子是_______ 和_______ (填元素符号),它们的第一电离能较大的是_______ 。
(4)氮化铜的晶胞为立方晶胞,其晶胞结构如图所示。
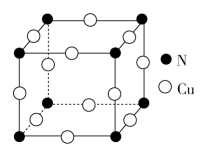
①根据晶胞结构,可判断氮化铜的化学式为_______ 。
②已知晶胞边长 ,则最近的两个Cu原子间的距离为
,则最近的两个Cu原子间的距离为_______ pm,列式并计算氮化铜晶体的密度
_______  。(保留小数点后两位)
。(保留小数点后两位)
(1)写出基态铜原子的外围电子排布式
(2)氮元素及其同主族的非金属元素形成的最简单氢化物中,沸点最高的是
(3)在碱性溶液中缩二脲能与
 反应得到特征的紫色配合物,其中的阴离子结构如图所示。该配离子中,配位原子是
反应得到特征的紫色配合物,其中的阴离子结构如图所示。该配离子中,配位原子是
(4)氮化铜的晶胞为立方晶胞,其晶胞结构如图所示。

①根据晶胞结构,可判断氮化铜的化学式为
②已知晶胞边长
 ,则最近的两个Cu原子间的距离为
,则最近的两个Cu原子间的距离为
 。(保留小数点后两位)
。(保留小数点后两位)
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】Fe是人类应用较早,且至今应用量最大的金属。
(1)Fe3+基态核外电子排布式为_______ 。
(2)铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。丙酮分子中碳原子轨道的杂化类型是_______ ,1mol丙酮分子中含有σ键的数目为_______ 。
(3)C、H、O三种元素的电负性由小到大的顺序为_______ 。
(4)乙醇的沸点高于丙酮,这是因为_______ 。
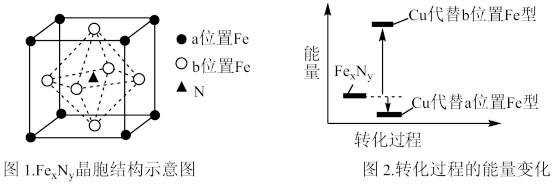
(5)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为_______ 。
(6)以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,获得Fe3O4的部分工艺流程如下:
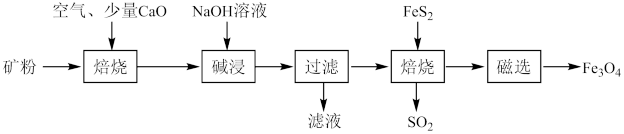
①焙烧过程均会产生SO2,用NaOH溶液吸收过量SO2的离子方程式为_______ 。
②“过滤”得到的滤渣中含大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2):n(Fe2O3)=_______ 。
(1)Fe3+基态核外电子排布式为
(2)铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。丙酮分子中碳原子轨道的杂化类型是
(3)C、H、O三种元素的电负性由小到大的顺序为
(4)乙醇的沸点高于丙酮,这是因为
(5)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为

(6)以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,获得Fe3O4的部分工艺流程如下:

①焙烧过程均会产生SO2,用NaOH溶液吸收过量SO2的离子方程式为
②“过滤”得到的滤渣中含大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2):n(Fe2O3)=
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】【化学——选修物质结构与性质】已知A、B、C、D、E五种元素的原子序数依次增大,其中A、E原子的最外层电子数均等于其周期序数,E原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍;D原子L层上有2对成对电子。请回答下列问题:
(1)E元素基态原子的电子排布式为___________________________ 。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为_____________ (填元素符号)。
(3)D元素与氟元素相比,电负性:D_______________ F(填“>”、“=”或“<”)。
(4)BD2在高温高压下所形成的晶体其晶胞如图所示。该晶体的类型属于___________________ (选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中B原子轨道的杂化类型为_____________ 。l mol B2A2分子中含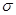 键的数目是
键的数目是_________________ 。
(5)光谱证实单质E与强碱溶液反应有[E(OH)4]—生成,则[E(OH)4]—中存在____________ 。
a.共价键 b.配位键 c.σ键 d.π键
(1)E元素基态原子的电子排布式为
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为
(3)D元素与氟元素相比,电负性:D
(4)BD2在高温高压下所形成的晶体其晶胞如图所示。该晶体的类型属于
 键的数目是
键的数目是
(5)光谱证实单质E与强碱溶液反应有[E(OH)4]—生成,则[E(OH)4]—中存在
a.共价键 b.配位键 c.σ键 d.π键
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】铁及其化合物在生产、生活中有重要应用。回答下列问题:
(1) 的价电子轨道表示式为
的价电子轨道表示式为___________ 。
(2) 和
和 可形成如图所示的配合物离子。其中铁的一个配体为茂环阴离子(
可形成如图所示的配合物离子。其中铁的一个配体为茂环阴离子( ),该配体以
),该配体以 电子参与配位。(-Ph表示苯基)
电子参与配位。(-Ph表示苯基)

①在该配合物结构中, 的配位数为
的配位数为___________ 。该配合物中碳原子的杂化方式共有___________ 种。
②N、S、O第一电离能由大到小的顺序为___________ 。
③ 表示环戊二烯负离子(每个碳原子上都结合了一个氢原子),已知分子中的大
表示环戊二烯负离子(每个碳原子上都结合了一个氢原子),已知分子中的大 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 ),则
),则 中的大
中的大 键应表示为
键应表示为___________ 。
(3)普鲁士蓝晶体属立方晶系,晶胞棱长为apm。铁—氰骨架组成晶胞中的8个小立方体,Fe粒子在小立方体顶点, 在小立方体的棱上,两端均与Fe相连,小立方体中心空隙可容纳
在小立方体的棱上,两端均与Fe相连,小立方体中心空隙可容纳 ,如图所示(
,如图所示( 在图中省略)。
在图中省略)。
①该晶胞的化学式为___________ 。
②若所有铁粒子为等径小球,则 与
与 之间最近距离为
之间最近距离为___________ pm;该晶体的密度为___________  (阿伏加德罗常数为
(阿伏加德罗常数为 )。
)。
(1)
 的价电子轨道表示式为
的价电子轨道表示式为(2)
 和
和 可形成如图所示的配合物离子。其中铁的一个配体为茂环阴离子(
可形成如图所示的配合物离子。其中铁的一个配体为茂环阴离子( ),该配体以
),该配体以 电子参与配位。(-Ph表示苯基)
电子参与配位。(-Ph表示苯基)
①在该配合物结构中,
 的配位数为
的配位数为②N、S、O第一电离能由大到小的顺序为
③
 表示环戊二烯负离子(每个碳原子上都结合了一个氢原子),已知分子中的大
表示环戊二烯负离子(每个碳原子上都结合了一个氢原子),已知分子中的大 键可用符号
键可用符号 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大 键可表示为
键可表示为 ),则
),则 中的大
中的大 键应表示为
键应表示为(3)普鲁士蓝晶体属立方晶系,晶胞棱长为apm。铁—氰骨架组成晶胞中的8个小立方体,Fe粒子在小立方体顶点,
 在小立方体的棱上,两端均与Fe相连,小立方体中心空隙可容纳
在小立方体的棱上,两端均与Fe相连,小立方体中心空隙可容纳 ,如图所示(
,如图所示( 在图中省略)。
在图中省略)。
①该晶胞的化学式为
②若所有铁粒子为等径小球,则
 与
与 之间最近距离为
之间最近距离为 (阿伏加德罗常数为
(阿伏加德罗常数为 )。
)。
您最近一年使用:0次