铁、铜、锌是形成许多金属材料和有机材料的重要组成元素。回答下列问题:
(1)金属铜在元素周期表_______ 区。
(2)铜和锌同周期且相邻,现有几种铜、锌元素的相应状态,①锌: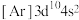 、②锌:
、②锌: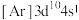 、③铜:
、③铜: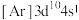 、④铜:
、④铜: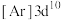 ,失去1个电子需要的能量由大到小排序是
,失去1个电子需要的能量由大到小排序是_______ 。
(3)向 溶液中滴加氨水可以得到
溶液中滴加氨水可以得到 型离子化合物,其阳离子结构如图所示。
型离子化合物,其阳离子结构如图所示。_______ 。
A.该阳离子中存在的化学键有极性共价键、配位键和氢键
B.溶液中的阴离子为正四面体结构
C.电负性大小:
D.往该溶液中继续加95%乙醇,并用玻璃棒摩擦试管壁,析出深蓝色晶体
②该化合物加热时首先失去的组分是 ,原因是
,原因是_______ 。
(4)铁及其化合物在生产、生活中有重要应用。
①改性 是一种优良的磁性材料,该
是一种优良的磁性材料,该 晶胞的
晶胞的 的结构如图所示,研究发现结构中的
的结构如图所示,研究发现结构中的 只可能出现在图中某一“▲”所示位置上,请确定
只可能出现在图中某一“▲”所示位置上,请确定 所在晶胞的位置
所在晶胞的位置_______ (填a或b或c)。 。铁-氰骨架组成小立方体,Fe粒子在顶点,
。铁-氰骨架组成小立方体,Fe粒子在顶点, 在棱上,两端均与Fe相连,立方体中心空隙可容纳
在棱上,两端均与Fe相连,立方体中心空隙可容纳 ,如图所示(
,如图所示( 在图中省略)。普鲁士蓝中
在图中省略)。普鲁士蓝中 与
与 个数之比为
个数之比为_______ ;该晶胞的化学式为_______ 。
(1)金属铜在元素周期表
(2)铜和锌同周期且相邻,现有几种铜、锌元素的相应状态,①锌:
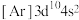 、②锌:
、②锌: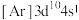 、③铜:
、③铜: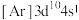 、④铜:
、④铜: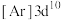 ,失去1个电子需要的能量由大到小排序是
,失去1个电子需要的能量由大到小排序是(3)向
 溶液中滴加氨水可以得到
溶液中滴加氨水可以得到 型离子化合物,其阳离子结构如图所示。
型离子化合物,其阳离子结构如图所示。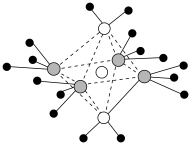
A.该阳离子中存在的化学键有极性共价键、配位键和氢键
B.溶液中的阴离子为正四面体结构
C.电负性大小:

D.往该溶液中继续加95%乙醇,并用玻璃棒摩擦试管壁,析出深蓝色晶体

②该化合物加热时首先失去的组分是
 ,原因是
,原因是(4)铁及其化合物在生产、生活中有重要应用。
①改性
 是一种优良的磁性材料,该
是一种优良的磁性材料,该 晶胞的
晶胞的 的结构如图所示,研究发现结构中的
的结构如图所示,研究发现结构中的 只可能出现在图中某一“▲”所示位置上,请确定
只可能出现在图中某一“▲”所示位置上,请确定 所在晶胞的位置
所在晶胞的位置
 。铁-氰骨架组成小立方体,Fe粒子在顶点,
。铁-氰骨架组成小立方体,Fe粒子在顶点, 在棱上,两端均与Fe相连,立方体中心空隙可容纳
在棱上,两端均与Fe相连,立方体中心空隙可容纳 ,如图所示(
,如图所示( 在图中省略)。普鲁士蓝中
在图中省略)。普鲁士蓝中 与
与 个数之比为
个数之比为
2024·浙江金华·模拟预测 查看更多[3]
浙江省义乌中学2024届高三上学期首考适应性考试化学试题(已下线)T35-物质结构与性质(已下线)压轴题10 物质结构与性质综合题(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)
更新时间:2024-02-03 20:35:37
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】硅材料和铝材料在生产生活中应用广泛.回答下列问题:
(1)一种磷酸硅铝分子筛常用于催化甲醇制烯烃的反应.由硅原子核形成的三种微粒:
a.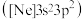 、b.
、b.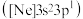 、c.
、c.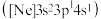 ,半径由大到小的顺序为
,半径由大到小的顺序为____________ (填标号);第三周期元素中,第一电离能介于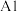 和P之间的元素有
和P之间的元素有____________ 种.
(2) 是一种高介电常数材料.已知:N(SiH3)3中
是一种高介电常数材料.已知:N(SiH3)3中 键角120°, N(CH3)3中
键角120°, N(CH3)3中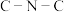 键角111°.共价键的极性
键角111°.共价键的极性
____________  (填“>”、“=”或“<”).
(填“>”、“=”或“<”).
(3)铝硼中间合金在铝生产中应用广泛.金属铝熔点为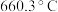 ,晶体硼熔点为
,晶体硼熔点为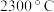 ,晶体硼熔点高于铝的原因是
,晶体硼熔点高于铝的原因是____________ .晶体硼的结构单元是正二十面体,每个单元中有12个硼原子,结构如下图.若其中有两个原子为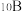 ,其余为
,其余为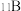 ,则该结构单元有
,则该结构单元有____________ 种.____________ 个;以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点的分数坐标为 ,则B点的分数坐标为
,则B点的分数坐标为____________ ;设NA为阿伏加德罗常数的值, Na2AlAu3的摩尔质量为Mg∙mol-1,晶体的密度为ρg∙cm-3,则A、C两原子间的距离为____________ pm(列出计算表达式).
(1)一种磷酸硅铝分子筛常用于催化甲醇制烯烃的反应.由硅原子核形成的三种微粒:
a.
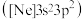 、b.
、b.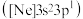 、c.
、c.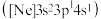 ,半径由大到小的顺序为
,半径由大到小的顺序为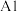 和P之间的元素有
和P之间的元素有(2)
 是一种高介电常数材料.已知:N(SiH3)3中
是一种高介电常数材料.已知:N(SiH3)3中 键角120°, N(CH3)3中
键角120°, N(CH3)3中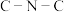 键角111°.共价键的极性
键角111°.共价键的极性
 (填“>”、“=”或“<”).
(填“>”、“=”或“<”).(3)铝硼中间合金在铝生产中应用广泛.金属铝熔点为
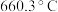 ,晶体硼熔点为
,晶体硼熔点为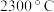 ,晶体硼熔点高于铝的原因是
,晶体硼熔点高于铝的原因是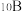 ,其余为
,其余为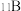 ,则该结构单元有
,则该结构单元有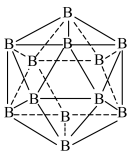

 ,则B点的分数坐标为
,则B点的分数坐标为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】短周期元素X、Y、Z、W、M、P、Q原子序数依次增大。基态X、Z、Q原子均有两个单电子,P简单离子在同周期离子中半径最小,Q与Z同主族。冰晶石的主要成分是由W、M、P三种元素组成的。
(1)元素X在周期表中的位置为___________ ,其位于___________ 区。
(2)Z元素原子的轨道表示式为___________ 。
(3)P元素基态电子排布式为___________ 。
(4)Q元素基态原子核外电子占据的最高能级为___________ ,该能级能容纳的最多电子数为___________ 。
(5)X、Y、Z、W第一电离由大到小的顺序为___________ (用元素符号表示,下同),Z、W、Q电负性由大到小的顺序为___________ ,X、Y、Z、M、P原子半径由大到小的顺序为___________ 。
(6)原子序数为29和51的元素基态原子价电子排布式分别为___________ 。
(1)元素X在周期表中的位置为
(2)Z元素原子的轨道表示式为
(3)P元素基态电子排布式为
(4)Q元素基态原子核外电子占据的最高能级为
(5)X、Y、Z、W第一电离由大到小的顺序为
(6)原子序数为29和51的元素基态原子价电子排布式分别为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】(1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有 NOx、 (PAN)、HCOOH、等二次污染物。
(PAN)、HCOOH、等二次污染物。
① 1mol PAN中含有的σ键数目为_______ 。PAN中C、N、O种元素的第一电离能由大到小的顺序为_________________ 。
② NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中中心离子的配位数为________ ,中心离子的核外电子排布式为_______________ 。
③相同压强下,HCOOH的沸点比CH3OCH3____ (填“高”或“低”),其原因是__________________ 。
(2)PM2.5微细粒子包含(NH4)2SO4、NH4NO3等。
① (NH4)2SO4晶体中各种微粒间的作用力不涉及___________ (填序号)。
a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键
② NH4NO3中阳离子的空间构型为_______ ,阴离子的中心原子轨道采用_______ 杂化。
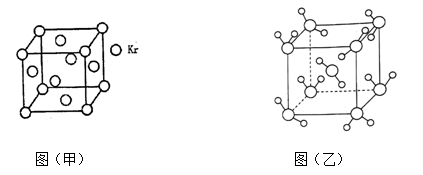
(3)测定大气中PM2.5的浓度方法之一是β—射线吸收法,β—射线放射源可用85Kr。已知Kr晶体的晶胞结构如图(甲)所示,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则m/n=_____ (填数字)。
(4)最新研究发现,水能凝结成13种类型的结晶体。除普通冰外,还有-30℃才凝固的低温冰,180℃依然不变的热冰,比水密度大的重冰等。重冰的结构如图(乙)所示。已知晶胞参数a=333.7 pm,阿伏伽德罗常数的值取6.02×1023,则重冰的密度为_______ g.cm-3(计算结果精确到0.01)。
 (PAN)、HCOOH、等二次污染物。
(PAN)、HCOOH、等二次污染物。① 1mol PAN中含有的σ键数目为
② NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中中心离子的配位数为
③相同压强下,HCOOH的沸点比CH3OCH3
(2)PM2.5微细粒子包含(NH4)2SO4、NH4NO3等。
① (NH4)2SO4晶体中各种微粒间的作用力不涉及
a.离子键 b.共价键 c.配位键 d.范德华力 e.氢键
② NH4NO3中阳离子的空间构型为
(3)测定大气中PM2.5的浓度方法之一是β—射线吸收法,β—射线放射源可用85Kr。已知Kr晶体的晶胞结构如图(甲)所示,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则m/n=

(4)最新研究发现,水能凝结成13种类型的结晶体。除普通冰外,还有-30℃才凝固的低温冰,180℃依然不变的热冰,比水密度大的重冰等。重冰的结构如图(乙)所示。已知晶胞参数a=333.7 pm,阿伏伽德罗常数的值取6.02×1023,则重冰的密度为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】已知X、Y、Z、R都是周期表中前四周期的元素,它们的核电荷数依次增大。X是空气中含量最高的元素,Z基态原子核外K、L、M三层电子数之比为1∶4∶2,R基态原子的3d原子轨道上的电子数是4s原子轨道上的4倍,Y基态原子的最外层电子数等于Z、R基态原子的最外层电子数之和。(答题时,X、Y、Z、R用所对应的元素符号表示)
(1)X、Y、Z的第一电离能由小到大的顺序为_______ ,写出 的空间构型:
的空间构型:_______ 。
(2) 的外围电子排布式为
的外围电子排布式为______ 。
(3)Z基态原子核外电子占据的原子轨道总数为________ ,有_____ 种运动状态不同的电子。
(4)现用四氯化硅和氮气在氢气气氛保护下,加强热发生反应,可得到较高纯度的 。反应的化学方程式为
。反应的化学方程式为________ 。
(5)Y、Z形成的某晶体的晶胞结构如下图所示,则该化合物的化学式为______ 。

(1)X、Y、Z的第一电离能由小到大的顺序为
 的空间构型:
的空间构型:(2)
 的外围电子排布式为
的外围电子排布式为(3)Z基态原子核外电子占据的原子轨道总数为
(4)现用四氯化硅和氮气在氢气气氛保护下,加强热发生反应,可得到较高纯度的
 。反应的化学方程式为
。反应的化学方程式为(5)Y、Z形成的某晶体的晶胞结构如下图所示,则该化合物的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】我国科学家成功合成了世界上首个五氮阴离子盐(H3O)3(NH4)4(N5)6Cl(用R代表),请根据其组成的元素和结构回答下列问题:
(1)氮原子价层电子的轨道表达式为_____________________ 。
(2)第一电离能N______ O(填“>”、“<”或“=”),其原因是_____________ 。
(3)经X射线衍射测得化合物R的晶体结构,其局部结构如下图所示。

①R中两种阳离子的相同之处为_________ ,不同之处为__________ 。(填标号)
a.中心原子的杂化轨道类型 b.中心原子的价层电子对数
c.立体结构 d.共价键类型
②R中阴离子N5-中的σ键总数为________ 个。大π键可用符号πmn表示,其中m为形成大π键的原子数,n为形成大π键的电子数,则N5-中的大π键应表示为__________ 。
③图中虚线代表氢键,其表示式为(NH4+)N−H…Cl、___________ 、____________ 。
(4)提取炼铜的阳极泥中金、银、铂时,用到王水(HNO3和HCl的物质的量之比为1∶3的混酸),过程如下:
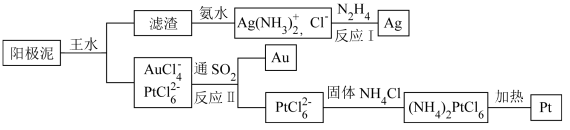
①滤渣的成分是_____________ ,(NH4)2PtCl6中配体是_______________________ 。
②金和浓硝酸反应的化学方程式为:Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O,该反应的平衡常数很小,几乎不反应,但金却可以溶于王水,原因是____________________ ,试写出该反应的化学方程式________ 。
(1)氮原子价层电子的轨道表达式为
(2)第一电离能N
(3)经X射线衍射测得化合物R的晶体结构,其局部结构如下图所示。

①R中两种阳离子的相同之处为
a.中心原子的杂化轨道类型 b.中心原子的价层电子对数
c.立体结构 d.共价键类型
②R中阴离子N5-中的σ键总数为
③图中虚线代表氢键,其表示式为(NH4+)N−H…Cl、
(4)提取炼铜的阳极泥中金、银、铂时,用到王水(HNO3和HCl的物质的量之比为1∶3的混酸),过程如下:

①滤渣的成分是
②金和浓硝酸反应的化学方程式为:Au+6HNO3(浓)=Au(NO3)3+3NO2↑+3H2O,该反应的平衡常数很小,几乎不反应,但金却可以溶于王水,原因是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】回答下列问题:
(1)对具有下列价电子排布的Ni或As进行光谱实验,用光谱仪一定能摄取到原子发射光谱的是____ (填字母)。
(2)Fe成为阳离子时首先失去____ 轨道电子,Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式为____ 。
(3)羟基磷灰石[Ca(PO4)3OH]是牙齿中的重要矿物质,其中羟基(—OH)中氧原子的杂化方式为___ ,PO 的空间构型为
的空间构型为____ ,该化合物所含元素电负性最大的是____ 。
(4)向胆矾溶液中滴加氨水至过量,最终得到深蓝色的透明溶液,再加入乙醇后析出深蓝色晶体,写出生成深蓝色透明溶液的离子方程式___ 。
(5)H2O与CH3CH2OH可以任意比例互溶,原因是____ 、____ (回答两点)。
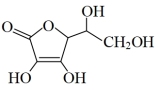
(6)抗坏血酸的分子结构如图所示,分子中碳原子的轨道杂化类型为____ ,分子中有____ 个手性碳原子。
(1)对具有下列价电子排布的Ni或As进行光谱实验,用光谱仪一定能摄取到原子发射光谱的是
| A.Ni:3d10 | B.As:4s24p 4p 4p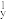 4p 4p |
C.As: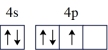 | D.Ni: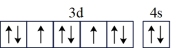 |
(3)羟基磷灰石[Ca(PO4)3OH]是牙齿中的重要矿物质,其中羟基(—OH)中氧原子的杂化方式为
 的空间构型为
的空间构型为(4)向胆矾溶液中滴加氨水至过量,最终得到深蓝色的透明溶液,再加入乙醇后析出深蓝色晶体,写出生成深蓝色透明溶液的离子方程式
(5)H2O与CH3CH2OH可以任意比例互溶,原因是
(6)抗坏血酸的分子结构如图所示,分子中碳原子的轨道杂化类型为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】二甲基亚砜(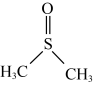 )是一种重要的非质子极性溶剂。铬和锰等过渡金属卤化物在二甲基亚砜中有一定溶解度,故可以应用在有机电化学中。回答下列问题:
)是一种重要的非质子极性溶剂。铬和锰等过渡金属卤化物在二甲基亚砜中有一定溶解度,故可以应用在有机电化学中。回答下列问题:
(1)基态 原子的价电子排布图(轨道表示式)为
原子的价电子排布图(轨道表示式)为_______ 。
(2)铬和锰基态原子核外未成对电子数之比为_______ 。
(3)已知:二甲基亚砜能够与水和丙酮(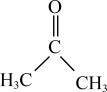 )分别以任意比互溶。
)分别以任意比互溶。
①二甲基亚砜分子中硫原子的杂化类型为_______ 。
②丙酮分子中各原子电负性由大到小的顺序为_______ 。
③二甲基亚砜易溶于水,原因可能为_______ 。
(4) 的结构有三种,且铬的配位数均为6,等物质的量的三种物质电离出的氯离子数目之比为
的结构有三种,且铬的配位数均为6,等物质的量的三种物质电离出的氯离子数目之比为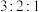 ,对应的颜色分别为紫色、浅绿色和蓝绿色。其中浅绿色的结构中配离子的化学式为
,对应的颜色分别为紫色、浅绿色和蓝绿色。其中浅绿色的结构中配离子的化学式为_______ ,该分子内的作用力不可能含有_______ (填序号)。
A.离子键 B.共价键 C.金属键 D.配位键 E.氢键 F.范德华力
(5)已知硫化锰( )晶胞如图所示,该晶胞参数
)晶胞如图所示,该晶胞参数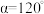 ,
,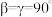 。
。
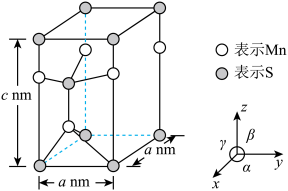
①该晶体中,锰原子周围的硫原子数目为_______ 。
②空间利用率指的是构成晶体的原子、离子或分子在整个晶体空间中所占有的体积百分比。已知锰和硫的原子半径分别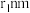 和
和 ,该晶体中原子的空间利用率为(列出计算式即可)
,该晶体中原子的空间利用率为(列出计算式即可)_______ 。
 )是一种重要的非质子极性溶剂。铬和锰等过渡金属卤化物在二甲基亚砜中有一定溶解度,故可以应用在有机电化学中。回答下列问题:
)是一种重要的非质子极性溶剂。铬和锰等过渡金属卤化物在二甲基亚砜中有一定溶解度,故可以应用在有机电化学中。回答下列问题:(1)基态
 原子的价电子排布图(轨道表示式)为
原子的价电子排布图(轨道表示式)为(2)铬和锰基态原子核外未成对电子数之比为
(3)已知:二甲基亚砜能够与水和丙酮(
 )分别以任意比互溶。
)分别以任意比互溶。①二甲基亚砜分子中硫原子的杂化类型为
②丙酮分子中各原子电负性由大到小的顺序为
③二甲基亚砜易溶于水,原因可能为
(4)
 的结构有三种,且铬的配位数均为6,等物质的量的三种物质电离出的氯离子数目之比为
的结构有三种,且铬的配位数均为6,等物质的量的三种物质电离出的氯离子数目之比为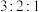 ,对应的颜色分别为紫色、浅绿色和蓝绿色。其中浅绿色的结构中配离子的化学式为
,对应的颜色分别为紫色、浅绿色和蓝绿色。其中浅绿色的结构中配离子的化学式为A.离子键 B.共价键 C.金属键 D.配位键 E.氢键 F.范德华力
(5)已知硫化锰(
 )晶胞如图所示,该晶胞参数
)晶胞如图所示,该晶胞参数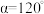 ,
,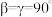 。
。
①该晶体中,锰原子周围的硫原子数目为
②空间利用率指的是构成晶体的原子、离子或分子在整个晶体空间中所占有的体积百分比。已知锰和硫的原子半径分别
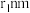 和
和 ,该晶体中原子的空间利用率为(列出计算式即可)
,该晶体中原子的空间利用率为(列出计算式即可)
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】Ⅰ.2016年7月8日,世界首款石墨烯基锂离子电池产品在北京发布。在石墨烯基锂离子电池中,由纯度在99%以上的单层石墨烯包覆的磷酸铁锂作正极材料,加强导电性,实现快速充电。
(1)碳原子的核外电子排布式为___________ 。
(2)石墨烯的结构如图所示,在石墨烯中碳原子的杂化方式为___________ 。

Ⅱ.Fe、Ni、Pt在周期表中同族,该族元素的化合物在科学研究和实际生产中有许多重要用途。
(1)①Fe在元素周期表中的位置为___________ 。
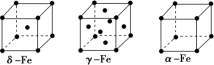
②铁有δ、γ、α三种晶型,各晶胞结构如图,则δ、α两种晶胞中铁原子的配位数之比为___________ 。γFe的晶胞边长为a pm,则Fe原子半径为___________ pm。
③已知FeO晶体晶胞结构为NaCl型,与O2-距离相等且最近的亚铁离子围成的空间构型为___________ 。
(2)铂可与不同的配体形成多种配合物。分子式为[Pt(NH3)2Cl4]的配合物的配体是___________ ;该配合物有两种不同的结构,其中呈橙黄色的物质的结构比较不稳定,在水中的溶解度大;呈亮黄色的物质的结构较稳定,在水中的溶解度小,图1所示的物质中呈亮黄色的是___________ (填“A”或“B”),理由是___________ 。
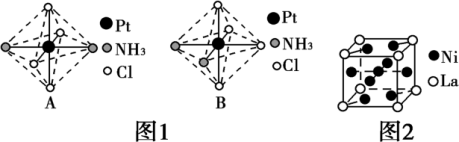
(3)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构如图2所示。
①储氢原理为:镧镍合金吸附H2,H2解离为H储存在其中形成化合物。若储氢后,氢原子占据晶胞中上下底面的棱和面心,则形成的储氢化合物的化学式为___________ 。
②测知镧镍合金晶胞体积为9.0×10-23cm3,则镧镍合金的晶体密度为___________ g·cm-3.(不必计算出结果)
(1)碳原子的核外电子排布式为
(2)石墨烯的结构如图所示,在石墨烯中碳原子的杂化方式为

Ⅱ.Fe、Ni、Pt在周期表中同族,该族元素的化合物在科学研究和实际生产中有许多重要用途。
(1)①Fe在元素周期表中的位置为
②铁有δ、γ、α三种晶型,各晶胞结构如图,则δ、α两种晶胞中铁原子的配位数之比为

③已知FeO晶体晶胞结构为NaCl型,与O2-距离相等且最近的亚铁离子围成的空间构型为
(2)铂可与不同的配体形成多种配合物。分子式为[Pt(NH3)2Cl4]的配合物的配体是

(3)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构如图2所示。
①储氢原理为:镧镍合金吸附H2,H2解离为H储存在其中形成化合物。若储氢后,氢原子占据晶胞中上下底面的棱和面心,则形成的储氢化合物的化学式为
②测知镧镍合金晶胞体积为9.0×10-23cm3,则镧镍合金的晶体密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
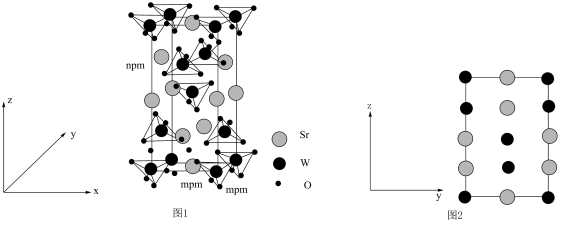
【推荐3】单质硼、硼酸(H3BO3)、硼砂(Na2B4O7·10H2O)中阴离子(H4B4O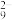 )的结构或结构单元分别如图1、图2、图3所示。
)的结构或结构单元分别如图1、图2、图3所示。
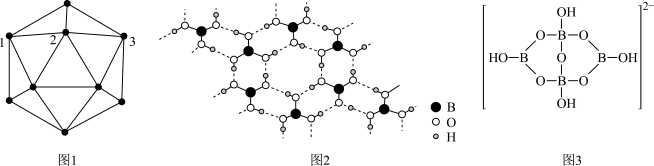
回答下列问题:
(1)图1为某晶体硼的部分结构单元,该结构单元由20个等边三角形构成,则构成此结构单元的B原子数为____ ,图中标记1、2、3的3个B原子形成的夹角为____ ,该结构单元中有____ 个B—B键。
(2)已知H3BO3与NaOH溶液反应时,当NaOH过量时,发生反应的化学方程式为H3BO3+NaOH=NaBO2+2H2O,当H3BO3过量时,发生反应的化学方程式为4H3BO3+2NaOH+3H2O=Na2B4O7·10H2O,则H3BO3是____ 元弱酸,硼酸晶体中存在的作用力有____ (填标号)。
a.离子键 b.共价键 c.配位键 d.氢键 e.范德华力
(3) 中得电子的原子是
中得电子的原子是____ (填元素符号),结构中B原子的杂化方式为____ ,结构中9个O原子____ (填“可能”或“不可能”)共平面。
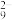 )的结构或结构单元分别如图1、图2、图3所示。
)的结构或结构单元分别如图1、图2、图3所示。
回答下列问题:
(1)图1为某晶体硼的部分结构单元,该结构单元由20个等边三角形构成,则构成此结构单元的B原子数为
(2)已知H3BO3与NaOH溶液反应时,当NaOH过量时,发生反应的化学方程式为H3BO3+NaOH=NaBO2+2H2O,当H3BO3过量时,发生反应的化学方程式为4H3BO3+2NaOH+3H2O=Na2B4O7·10H2O,则H3BO3是
a.离子键 b.共价键 c.配位键 d.氢键 e.范德华力
(3)
 中得电子的原子是
中得电子的原子是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】钨酸锶是一种功能性材料,在光致发光、发光二极管、闪质子交换膜烁材料、磁性材料、湿度传感器和催化剂等领域有着广泛的应用,从而备受人们关注,其晶胞结构如图1所示,晶胞棱边夹角均为90°,Sr原子和W原子沿x轴投影如图2所示。
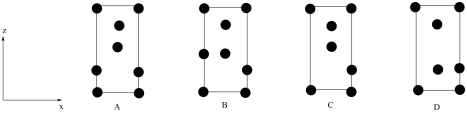
(1)基态氧原子最高能级理论上具有的轨道数为___________ ,原子中运动的电子有两种相反的自旋状态,若有一种自旋状态用 表示,则与之相反的用
表示,则与之相反的用 表示,
表示,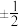 称为电子的自旋磁量子数,基态氧原子核外电子自旋磁量子数的代数和为
称为电子的自旋磁量子数,基态氧原子核外电子自旋磁量子数的代数和为___________ 。
(2)Sr的原子序数为38,其位于元素周期表的___________ (填“s”、“p”、“d”或“ds”)区,SrO的熔点比MgO___________ (填“高”或“低”),原因是___________ 。
(3)钨酸锶的化学式为___________ ,晶胞中W原子沿y轴投影所形成的投影图为___________ (填标号),设 为阿佛加德罗常数的值,则该晶体的密度为
为阿佛加德罗常数的值,则该晶体的密度为___________ g·cm-3。

(1)基态氧原子最高能级理论上具有的轨道数为
 表示,则与之相反的用
表示,则与之相反的用 表示,
表示,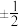 称为电子的自旋磁量子数,基态氧原子核外电子自旋磁量子数的代数和为
称为电子的自旋磁量子数,基态氧原子核外电子自旋磁量子数的代数和为(2)Sr的原子序数为38,其位于元素周期表的
(3)钨酸锶的化学式为
 为阿佛加德罗常数的值,则该晶体的密度为
为阿佛加德罗常数的值,则该晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】A、B、C、D、E、F、G是原子序数依次增大的前四周期元素,A元素原子核外电子只有一种自旋取向,A、B元素原子的最外层电子数相等;C元素原子核外s能级上的电子总数与p能级上的电子总数相等;D元素原子半径是短周期主族元素中最大的;E元素的价层电子在s和p能级的原子轨道中运动的电子数相等; 与F元素的基态原子均有5个未成对电子。请回答下列问题:
与F元素的基态原子均有5个未成对电子。请回答下列问题:
(1)若A离子与B离子的电子层结构相同,半径较大的是___________ (填离子符号),A与B形成的二元化合物的晶体类型为___________ 。
(2)比较第一电离能的大小:I1(B)___________ (填“>”、“<”或“=”)I1(D),原因是___________ 。
(3)晶体熔点:
___________ (填“高于”、“低于”或“等于”)DCA。
(4)基态G原子的价层电子排布式为___________ ,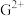 与
与 的未成对电子数之比为
的未成对电子数之比为___________ 。
(5)基态F原子含有___________ 种空间运动状态不同的电子。C和F形成的一种化合物的立方晶胞如图所示,则该化合物的化学式为___________ 。
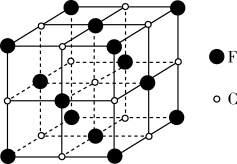
 与F元素的基态原子均有5个未成对电子。请回答下列问题:
与F元素的基态原子均有5个未成对电子。请回答下列问题:(1)若A离子与B离子的电子层结构相同,半径较大的是
(2)比较第一电离能的大小:I1(B)
(3)晶体熔点:

(4)基态G原子的价层电子排布式为
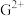 与
与 的未成对电子数之比为
的未成对电子数之比为(5)基态F原子含有

您最近一年使用:0次

 中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的
中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的 的配位数为
的配位数为 中,电负性最高的元素是
中,电负性最高的元素是 轨道形成
轨道形成 属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示:
属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示:


