如表为长式周期表的一部分,其中的编号代表对应的元素。
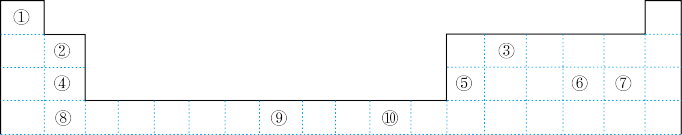
请回答下列问题:
(1)表中属于d区的元素是_______ (填编号)。
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为_______ 。
(3)④⑤⑥⑦四种元素的第一电离能由大到小的顺序是_______ (用元素符号表示)。
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的未成对电子数为_______ ;该元素与元素①形成的分子X的立体构型为_______ ,与⑧在同一周期的元素中的未成对电子数目最多的元素的价电子排布式是_______ 。
(5)某些不同族元素的性质也有一定的相似性,如表中元素⑤与元素②的氢氧化物有相似的性质,请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:_______ 。

请回答下列问题:
(1)表中属于d区的元素是
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为
(3)④⑤⑥⑦四种元素的第一电离能由大到小的顺序是
(4)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的未成对电子数为
(5)某些不同族元素的性质也有一定的相似性,如表中元素⑤与元素②的氢氧化物有相似的性质,请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:
更新时间:2022-11-13 19:29:18
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】A、B、C、D、E、F、G是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如表所示,请用化学用语回答下列问题。
(1)写出元素符号A:___________ B:___________ G___________ ,写出元素B的基态原子的轨道表示式:___________ 。
(2)C、D、E三种元素的原子半径由大到小的顺序___________ 。
(3)由A、B、C三种元素分别与氢元素形成的简单气态氢化物,其空间构型分别为:___________ ,___________ ,___________ ,其中C的简单气态氢化物的键角为:___________ 。
(4)已知元素A、B形成的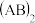 链状分子中所有原子都满足8电子稳定结构,则其分子中
链状分子中所有原子都满足8电子稳定结构,则其分子中 键与
键与 键之比为
键之比为___________ 。
(5)F元素的简单阴离子结构示意图___________ 。电解D与F形成的化合物的水溶液在工业上有着重要应用,试写出其电解的总的化学反应方程式:___________ 。
(6)元素G位于周期表的___________ 区,其价电子的排布式为:___________ ,该元素可形成 、
、 ,其中较稳定的是
,其中较稳定的是 ,原因是
,原因是___________ 。
(7)短周期元素M与元素E在周期表中的位置呈现对角线关系,已知元素M、F的电负性分别为1.5和3.0,预测它们形成的化合物是___________ 化合物(填“离子”或“共价”)。推测M的最高价氧化物对应水化物___________ (填“能”或“不能”)与D的最高价氧化物对应水化物发生反应。
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 原子半径在同周期元素中最大 |
| E | 基态原子最外层电子排布式为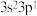 |
| F | 基态原子的最外层p轨道有2个电子的自旋状态与其他电子的自旋状态相反 |
| G | 生活中使用最多的一种金属 |
(2)C、D、E三种元素的原子半径由大到小的顺序
(3)由A、B、C三种元素分别与氢元素形成的简单气态氢化物,其空间构型分别为:
(4)已知元素A、B形成的
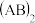 链状分子中所有原子都满足8电子稳定结构,则其分子中
链状分子中所有原子都满足8电子稳定结构,则其分子中 键与
键与 键之比为
键之比为(5)F元素的简单阴离子结构示意图
(6)元素G位于周期表的
 、
、 ,其中较稳定的是
,其中较稳定的是 ,原因是
,原因是(7)短周期元素M与元素E在周期表中的位置呈现对角线关系,已知元素M、F的电负性分别为1.5和3.0,预测它们形成的化合物是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】回答下列问题。
(1)已知元素的电负性和元素的化合价一样,也是元素的一种基本性质,下面给出14种元素的电负性。
①判断下列化合物中属于离子化合物的是________ (填字母);
A.Mg3N2 B.BeCl2 C.AlCl3 D.SiC
②已知PCl3、NCl3均能发生水解反应,PCl3水解反应的化学方程式为__________________________ ;NCl3水解产物为____________________ 。
(2)观察Li、Be、Mg、Al在元素周期表中的位置回答:
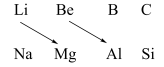
①铍的最高价氧化物的水化物是________ (填“酸性”、“碱性”或“两性”)化合物,证明这一结论的有关离子方程式是_____________________________________________________ ;
②根据Mg在空气中的燃烧情况,Li在空气中燃烧生成产物为__________ (用化学式表示)。
(3)现有核电荷数小于20的元素A,其电离能数据如下:(I1表示原子失去第1个电子的电离能;In表示原子失去第n个电子的电离能,单位:1×102kJ·mol-1)
①外层电子离核越远,能量越高,电离能越__________ (填“大”或“小”);阳离子电荷数越高,失去电子时,电离能越________ (填“大”或“小”);
②上述11个电子分属________ 个电子层;
③失去了11个电子后,该元素还有________ 个电子;
④该元素最高价氧化物对应水化物的化学式是______________________________________ 。
(1)已知元素的电负性和元素的化合价一样,也是元素的一种基本性质,下面给出14种元素的电负性。
| 元素 | Al | B | Be | C | Cl | F | Li |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
①判断下列化合物中属于离子化合物的是
A.Mg3N2 B.BeCl2 C.AlCl3 D.SiC
②已知PCl3、NCl3均能发生水解反应,PCl3水解反应的化学方程式为
(2)观察Li、Be、Mg、Al在元素周期表中的位置回答:

①铍的最高价氧化物的水化物是
②根据Mg在空气中的燃烧情况,Li在空气中燃烧生成产物为
(3)现有核电荷数小于20的元素A,其电离能数据如下:(I1表示原子失去第1个电子的电离能;In表示原子失去第n个电子的电离能,单位:1×102kJ·mol-1)
| 序号 | I1 | I2 | I3 | I4 | I5 | I6 |
| 电离能 | 7.644 | 15.03 | 80.12 | 109.3 | 141.2 | 186.5 |
| 序号 | I7 | I8 | I9 | I10 | I11 | …… |
| 电离能 | 224.9 | 266.0 | 327.9 | 367.4 | 1761 | …… |
①外层电子离核越远,能量越高,电离能越
②上述11个电子分属
③失去了11个电子后,该元素还有
④该元素最高价氧化物对应水化物的化学式是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】著名化学家徐光宪在稀土领域贡献突出,被誉为“稀土界的袁隆平”。钇是稀土元素之一,我国蕴藏着丰富的钇矿石(Y2FeBe2Si2O10),工业上通过如下工艺流程制取氧化钇,并获得副产物铍。
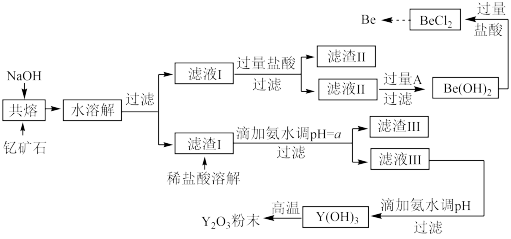
已知:ⅰ.钇(Y)的常见化合价为+3价;
ⅱ.铍和铝处于元素周期表的对角线位置,化学性质相似;
ⅲ.Fe3+、Y3+形成氢氧化物沉淀时的pH如下表:
(1)将钇矿石与NaOH共熔的反应方程式补充完整:
__ Y2FeBe2Si2O10+__ NaOH+____ 
__ Y(OH)3 +__ Fe2O3 + __ Na2SiO3 + __ Na2BeO2 + __ H2O
(2)滤渣Ⅱ的主要成分是____________ 。
(3)试剂A可以是___________ 。
A.NaOH溶液 B.氨水 C.CO2 D.CaO
(4)用氨水调节pH=a时,a的取值范围是_____________________ 。
(5)计算常温下Y3+ +3H2O Y(OH)3+3H+的平衡常数K=
Y(OH)3+3H+的平衡常数K=________ 。(常温下Ksp [Y(OH)3] = 8.0×10-23)
(6)滤液Ⅲ加入氨水产生沉淀的离子方程式为_______________ 。
(7)从BeCl2溶液中得到BeCl2固体的操作是________ 。
(8)常见的由BeCl2固体生产Be的工业方法有两种:①电解法:电解NaCl-BeCl2混合熔融盐制备Be;②热还原法:熔融条件下,钾还原BeCl2制备Be。以上两种方法你认为哪种更好并请说明理由_________ 。

已知:ⅰ.钇(Y)的常见化合价为+3价;
ⅱ.铍和铝处于元素周期表的对角线位置,化学性质相似;
ⅲ.Fe3+、Y3+形成氢氧化物沉淀时的pH如下表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.1 | 3.1 |
| Y3+ | 6.0 | 8.3 |

(2)滤渣Ⅱ的主要成分是
(3)试剂A可以是
A.NaOH溶液 B.氨水 C.CO2 D.CaO
(4)用氨水调节pH=a时,a的取值范围是
(5)计算常温下Y3+ +3H2O
 Y(OH)3+3H+的平衡常数K=
Y(OH)3+3H+的平衡常数K=(6)滤液Ⅲ加入氨水产生沉淀的离子方程式为
(7)从BeCl2溶液中得到BeCl2固体的操作是
(8)常见的由BeCl2固体生产Be的工业方法有两种:①电解法:电解NaCl-BeCl2混合熔融盐制备Be;②热还原法:熔融条件下,钾还原BeCl2制备Be。以上两种方法你认为哪种更好并请说明理由
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】我国自主研发的用氟硼铍酸钾(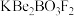 )晶体制造深紫外固体激光器技术领先世界。回答下列问题:
)晶体制造深紫外固体激光器技术领先世界。回答下列问题:
(1)写出O原子的价层电子轨道表示式:_______ ,基态Be、B、O三种元素的原子第一电离能由大到小的顺序为_______ ,KF、KCl、KBr三种晶体中熔点最高的是_______ 。
(2)在500~600℃气相中,氯化铍以二聚体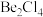 的形式存在,在该二聚体中Be原子的杂化方式是
的形式存在,在该二聚体中Be原子的杂化方式是_______ ,1mol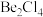 中含有的配位键数目为
中含有的配位键数目为_______ 。
(3)往硫酸铜溶液中加入过量氨水,可生成 配离子。已知
配离子。已知 与
与 的空间结构都是三角锥形,但
的空间结构都是三角锥形,但 不易与
不易与 形成配离子,其原因是
形成配离子,其原因是_______ 。
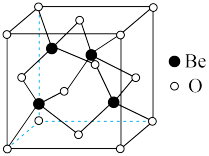
(4)BeO晶体是制备氟硼铍酸钾晶体的原料之一,其晶胞结构如图所示。与每个O原子最近且距离相等的Be原子的个数为_______ ;设O与Be的最近距离为 pm,用
pm,用 表示阿伏加德罗常数的值,则BeO晶体的密度为
表示阿伏加德罗常数的值,则BeO晶体的密度为_______ ( 用含
用含 和
和 的式子表示)。
的式子表示)。
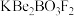 )晶体制造深紫外固体激光器技术领先世界。回答下列问题:
)晶体制造深紫外固体激光器技术领先世界。回答下列问题:(1)写出O原子的价层电子轨道表示式:
(2)在500~600℃气相中,氯化铍以二聚体
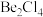 的形式存在,在该二聚体中Be原子的杂化方式是
的形式存在,在该二聚体中Be原子的杂化方式是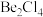 中含有的配位键数目为
中含有的配位键数目为(3)往硫酸铜溶液中加入过量氨水,可生成
 配离子。已知
配离子。已知 与
与 的空间结构都是三角锥形,但
的空间结构都是三角锥形,但 不易与
不易与 形成配离子,其原因是
形成配离子,其原因是(4)BeO晶体是制备氟硼铍酸钾晶体的原料之一,其晶胞结构如图所示。与每个O原子最近且距离相等的Be原子的个数为
 pm,用
pm,用 表示阿伏加德罗常数的值,则BeO晶体的密度为
表示阿伏加德罗常数的值,则BeO晶体的密度为 用含
用含 和
和 的式子表示)。
的式子表示)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】以 为原料催化加氢可以制备
为原料催化加氢可以制备 、
、 、
、 ,
, 为我国科学家发明的二氧化碳加氢的一种催化剂。回答下列问题:
为我国科学家发明的二氧化碳加氢的一种催化剂。回答下列问题:
(1)基态Zn原子价层轨道表示式为___________ ,其核外电子空间运动状态有___________ 种。
(2)每个基态碳原子含有未成对电子的数目为___________ ,第一电离能:C___________ (填“>”或“<”)O。
(3) 催化加氢制备
催化加氢制备 的化学方程式为
的化学方程式为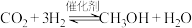 。
。
①等物质的量的 和
和 分子中
分子中 键数目之比为
键数目之比为___________ 。
②沸点:
___________ (填“>”或“<”) ,其原因为
,其原因为___________ 。
③ 分子中中心原子的杂化方式为
分子中中心原子的杂化方式为___________ ,其空间结构为___________ 。
(4)四方体 晶胞结构如图所示,原子坐标参数表示晶胞内部各原子的相对位置,M、W、Z原子的坐标参数分别为(0,0,0)、(
晶胞结构如图所示,原子坐标参数表示晶胞内部各原子的相对位置,M、W、Z原子的坐标参数分别为(0,0,0)、(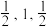 )、(
)、(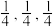 )。
)。

①R原子的坐标参数为___________ 。
②假设 的密度为
的密度为 ,摩尔质量为
,摩尔质量为 ,
, 表示阿伏加德罗常数的值,则晶胞中Zr原子和O原子的最短距离为
表示阿伏加德罗常数的值,则晶胞中Zr原子和O原子的最短距离为___________ nm(列出算式即可),
 为原料催化加氢可以制备
为原料催化加氢可以制备 、
、 、
、 ,
, 为我国科学家发明的二氧化碳加氢的一种催化剂。回答下列问题:
为我国科学家发明的二氧化碳加氢的一种催化剂。回答下列问题:(1)基态Zn原子价层轨道表示式为
(2)每个基态碳原子含有未成对电子的数目为
(3)
 催化加氢制备
催化加氢制备 的化学方程式为
的化学方程式为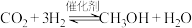 。
。①等物质的量的
 和
和 分子中
分子中 键数目之比为
键数目之比为②沸点:

 ,其原因为
,其原因为③
 分子中中心原子的杂化方式为
分子中中心原子的杂化方式为(4)四方体
 晶胞结构如图所示,原子坐标参数表示晶胞内部各原子的相对位置,M、W、Z原子的坐标参数分别为(0,0,0)、(
晶胞结构如图所示,原子坐标参数表示晶胞内部各原子的相对位置,M、W、Z原子的坐标参数分别为(0,0,0)、(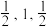 )、(
)、(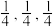 )。
)。
①R原子的坐标参数为
②假设
 的密度为
的密度为 ,摩尔质量为
,摩尔质量为 ,
, 表示阿伏加德罗常数的值,则晶胞中Zr原子和O原子的最短距离为
表示阿伏加德罗常数的值,则晶胞中Zr原子和O原子的最短距离为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】铬及其化合物被广泛应用于冶金、化工、铸铁、耐火及高科技等领域。
(1)基态铬原子的价电子排布式为_______ 。
(2)CrO2Cl2是重要的氯化剂。制备CrO2Cl2的反应为K2Cr2O7+3CC14=2KC1+2CrO2Cl2+3COCl2↑。
①COCl2中C、O和Cl元素的电负性由大到小的顺序是________ (用元素符号表示)。
②CrO2Cl2常温下为深红色液体,能与 CC14、CS2等互溶,据此可判断CrO2Cl2分子空间构型是_______ 。(填“平面四边形”或“四面体形”)。
(3)三价铬丙二酸配合物具有优良的催化性能,其中阴离子的结构如图甲所示:

①阴离子中碳原子的杂化轨道类型是______ ,中心铬的配位数为_______ 。
②在丙二酸根与Cr3+配位时,配位原子为1号氧而不是2号氧的原因是___________ 。
(4)Cr—N系列涂层具有良好的耐磨和耐腐蚀性。某氮化铬的晶胞结构与氯化钠的相同,已知N原子在晶胞中的位置如图乙所示:
①下列为晶胞中 Cr 原子沿x轴方向的投影的是______ (填字母)。
a.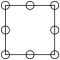 b.
b. 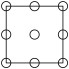 c.
c. 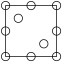 d.
d.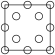
②晶胞中 N 原子的坐标是 A(0,0,0),B( ,
, ,0),则距A和B最近的 Cr 原子的坐标是
,0),则距A和B最近的 Cr 原子的坐标是_______ 。
(1)基态铬原子的价电子排布式为
(2)CrO2Cl2是重要的氯化剂。制备CrO2Cl2的反应为K2Cr2O7+3CC14=2KC1+2CrO2Cl2+3COCl2↑。
①COCl2中C、O和Cl元素的电负性由大到小的顺序是
②CrO2Cl2常温下为深红色液体,能与 CC14、CS2等互溶,据此可判断CrO2Cl2分子空间构型是
(3)三价铬丙二酸配合物具有优良的催化性能,其中阴离子的结构如图甲所示:

①阴离子中碳原子的杂化轨道类型是
②在丙二酸根与Cr3+配位时,配位原子为1号氧而不是2号氧的原因是
(4)Cr—N系列涂层具有良好的耐磨和耐腐蚀性。某氮化铬的晶胞结构与氯化钠的相同,已知N原子在晶胞中的位置如图乙所示:
①下列为晶胞中 Cr 原子沿x轴方向的投影的是
a.
 b.
b.  c.
c.  d.
d.
②晶胞中 N 原子的坐标是 A(0,0,0),B(
 ,
, ,0),则距A和B最近的 Cr 原子的坐标是
,0),则距A和B最近的 Cr 原子的坐标是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】已知A、B、C、D、E都是周期表中前四周期的元素,它们的原子序数依次增大。其中A原子的核外p电子数比s电子数少l,C是电负性最大的元素,D原子次外层电子数是最外层电子数的2倍,E原子次外层全充满,且最外层只有l个电子。
(1)写出基态D原子的外围电子排布式_________________ 。
(2)A、B、C三种元素的第一电离能由大到小的顺序为_______ (用元素符号表示), A、B两元素分别与D形成的共价键中,极性较强的键是_________ 。
(3)现有A的氢化物X,其中心原子的杂化类型为______ ,其分子空间构型为_______ 。1mol配离子[E(X)4]2+中含δ键的数目为_____ NA,E2+容易与X形成配离子,但不易与AC3形成配离子,其原因是_________ 。
(4)已知E单质的晶体堆积模型为面心立方最密堆积,则晶体中E原子的配位数为_____ ,假设E原子为刚性小球.已知E原子半径为r,列式表示该晶体的空间利用率__________ 。(空间利用率指晶体中全部原子所占体积与晶体总体积之比)。
(1)写出基态D原子的外围电子排布式
(2)A、B、C三种元素的第一电离能由大到小的顺序为
(3)现有A的氢化物X,其中心原子的杂化类型为
(4)已知E单质的晶体堆积模型为面心立方最密堆积,则晶体中E原子的配位数为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】铝、锌、铁在人类生产和生活中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Fe2+电子排布式为___________ ,Zn的基态原子能级最高的电子的电子云轮廓图形状为___________ 。
(2)已知Al的第一电离能为578kJ·mol-1、Mg的第一电离能为740kJ·mol-1,请解释Mg的第一电离能比Al大的原因___________ 。
(3)Zn2+可形成[Zn(NH3)6]SO4络合物,1mol[Zn(NH3)6]2+配离子中含σ键___________ mol,其阴离子中心原子的杂化方式是___________ ,NH3的沸点高于PH3的原因是___________ 。
(4)已知Zn2+等过渡元素离子形成的水合离子的颜色如下表所示:
请根据原子结构中外围电子排布推测Sc3+、Zn2+的水合离子为无色的原因:___________ 。
(5)Fe晶体中堆积方式为体心立方堆积,则这种堆积方式的空间利用率为___________ ,这种堆积方式的配位数为___________ 。
(6)Fe和N可组成一种过渡金属氮化物,其晶胞如图所示。六棱柱底边边长为xnm,高为ynm,NA为阿伏加德罗常数的值,则晶胞的密度为___________ g·cm-3(列出计算式即可)。
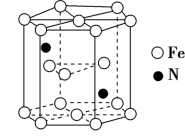
(1)Fe2+电子排布式为
(2)已知Al的第一电离能为578kJ·mol-1、Mg的第一电离能为740kJ·mol-1,请解释Mg的第一电离能比Al大的原因
(3)Zn2+可形成[Zn(NH3)6]SO4络合物,1mol[Zn(NH3)6]2+配离子中含σ键
(4)已知Zn2+等过渡元素离子形成的水合离子的颜色如下表所示:
| 离子 | Sc3+ | Cr3+ | Fe2+ | Zn2+ |
| 水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
(5)Fe晶体中堆积方式为体心立方堆积,则这种堆积方式的空间利用率为
(6)Fe和N可组成一种过渡金属氮化物,其晶胞如图所示。六棱柱底边边长为xnm,高为ynm,NA为阿伏加德罗常数的值,则晶胞的密度为

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】X、Y、Z、W四种常见元素,其相关信息如下表:
(1)W位于周期表的第________ 周期,第____________ 族。
(2)用“>”或“<”填空。
(3)X2、碳和Z的氧化物在1300℃时可合成Z3X4。写出该反应化学方程式_____________ 。Z3X4是一种耐高温的结构陶瓷材料,是________ 化合物(填“共价”或“离子”)。
(4)查阅资料知道:
4Y(s)+3O2(g)=2Y2O3(s) △H=-3351.4 kJ/mol
3W(s)+2O2(g)=W3O4(s) △H=-1120 kJ/mol
则Y与W3O4反应的热化学方程式是:____________________ 。
| 元素 | 相关信息 |
| X | 空气含量最多的元素 |
| Y | 3p能级只有一个电子 |
| Z | 单质用于制造集成电路和太阳能板的主要原料 |
| W | 常见化合价有+2、+3,其中一种氧化物为红褐色 |
(2)用“>”或“<”填空。
| 离子半径 | 电负性 | 第一电离能 | 单质熔点 |
| X | Z | X | X |
(4)查阅资料知道:
4Y(s)+3O2(g)=2Y2O3(s) △H=-3351.4 kJ/mol
3W(s)+2O2(g)=W3O4(s) △H=-1120 kJ/mol
则Y与W3O4反应的热化学方程式是:
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】《千里江山图》流传千年依旧色彩艳丽,与其绘制方法和所用颜料有关,第一遍画好山水画,第二遍用 上红色,为后面的绿色做铺垫。
上红色,为后面的绿色做铺垫。
(1)铁离子中能量相同的d轨道中电子排布成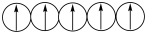 ,而不排布成
,而不排布成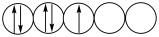 ,最直接的依据是_______。
,最直接的依据是_______。
(2)Mn和Fe的各级电离能如下。
Mn与Fe相比, 和
和 较小,而
较小,而 较大,其原因是
较大,其原因是_______ 。
第三遍上石绿化学式为: ,第四遍还要再叠加一层绿,第五遍上青色。
,第四遍还要再叠加一层绿,第五遍上青色。
(3)根据价层电子对互斥理论判断下列微粒空间结构与 类似的是_______。
类似的是_______。
(4)用鲍林的杂化轨道理论解释 分子的正四面体结构,下列说法不正确的是_______。
分子的正四面体结构,下列说法不正确的是_______。
《千里江山图》中还用到了黄色的颜料雌黄,雌黄的主要成分是 。
。
(5)As与N、P属于同主族元素,三者气态氢化物的空间结构都是_______ 氢化物分子的键角由大到小的顺序为_______ 。
(6)下列对于 和
和 的说法中正确的是_______。
的说法中正确的是_______。
(7)HCN分子中 键与
键与 键的数目之比为
键的数目之比为_______ 。
(8)水分子和氨气分子的键角大小顺序为_______ ,试解释上述键角大小的原因_______ 。
 上红色,为后面的绿色做铺垫。
上红色,为后面的绿色做铺垫。(1)铁离子中能量相同的d轨道中电子排布成
 ,而不排布成
,而不排布成 ,最直接的依据是_______。
,最直接的依据是_______。| A.能量最低原则 | B.泡利不相容原理 | C.原子轨道能级图 | D.洪特规则 |
电离能/( ) ) |  |  |  |  |  |
| Mn | 717.3 | 1509.0 | 3248 | 4940 | 6990 |
| Fe | 762.5 | 1561.9 | 2957 | 5290 | 7240 |
 和
和 较小,而
较小,而 较大,其原因是
较大,其原因是第三遍上石绿化学式为:
 ,第四遍还要再叠加一层绿,第五遍上青色。
,第四遍还要再叠加一层绿,第五遍上青色。(3)根据价层电子对互斥理论判断下列微粒空间结构与
 类似的是_______。
类似的是_______。A. | B. | C. | D. |
 分子的正四面体结构,下列说法不正确的是_______。
分子的正四面体结构,下列说法不正确的是_______。| A.杂化轨道的形状、能量和未杂化前一样 |
B.C原子的 杂化轨道之间夹角一样 杂化轨道之间夹角一样 |
C.C原子的4个价电子分别占据4个 杂化轨道 杂化轨道 |
| D.分子中C原子的p轨道与H原子的s轨道杂化后形成4个新轨道 |
《千里江山图》中还用到了黄色的颜料雌黄,雌黄的主要成分是
 。
。(5)As与N、P属于同主族元素,三者气态氢化物的空间结构都是
(6)下列对于
 和
和 的说法中正确的是_______。
的说法中正确的是_______。| A.都是极性分子 | B.中心原子都采取sp杂化 |
C. 为直线形结构 为直线形结构 | D.N原子和C原子上都没有孤对电子 |
 键与
键与 键的数目之比为
键的数目之比为(8)水分子和氨气分子的键角大小顺序为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】A﹣234是2018年关注度最高的8大分子之一,其结构为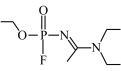 。请根据其结构及其组成元素回答以下问题:
。请根据其结构及其组成元素回答以下问题:
(1)A﹣234分子中N原子的杂化方式为_______ ,该物质所形成的晶体类型为_______ ,基态P原子中核外电子占据的最高能级符号是_______ 。
(2)N、O、F的第一电离能由大到小的顺序为_______ 。
(3)用价层电子对互斥模型预测POF3的立体构型:_______ 。
(4)请比较NH3与NF3的键角大小:NH3_______ (填“>”、“<”或“=”)NF3。
(5)P能够形成PCl3和PCl5,而N只能形成NCl3,其原因是_______ 。
(6)N与Ga所形成的化合物被誉为21世纪引领5G时代的基石材料,其晶胞为六方晶型,如图所示。晶胞参数a=xnm,c=ynm。N原子的配位数为_______ ,该晶胞的密度为_______ g/cm3(用含有x、y的式子表示)。

 。请根据其结构及其组成元素回答以下问题:
。请根据其结构及其组成元素回答以下问题:(1)A﹣234分子中N原子的杂化方式为
(2)N、O、F的第一电离能由大到小的顺序为
(3)用价层电子对互斥模型预测POF3的立体构型:
(4)请比较NH3与NF3的键角大小:NH3
(5)P能够形成PCl3和PCl5,而N只能形成NCl3,其原因是
(6)N与Ga所形成的化合物被誉为21世纪引领5G时代的基石材料,其晶胞为六方晶型,如图所示。晶胞参数a=xnm,c=ynm。N原子的配位数为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】人类使用铜及其合金具有悠久的历史,铜及其化合物在电子工业、材料工业、工农业生产及日常生活方面具有广泛用途。
(1) 的核外电子排布式为
的核外电子排布式为______ 。
(2) 和
和 是自然界中重要的铜盐,
是自然界中重要的铜盐, 的立体构型是
的立体构型是______ ,S、O、N三种元素的第一电离能由大到小的顺序为______ 。
(3)向盛有 溶液的试管中加入氨水,首先形成蓝色难溶物,继续加入氨水,难溶物溶解,得到深蓝色透明溶液,溶液呈深蓝色是因为存在离子
溶液的试管中加入氨水,首先形成蓝色难溶物,继续加入氨水,难溶物溶解,得到深蓝色透明溶液,溶液呈深蓝色是因为存在离子______ (填离子符号);向反应后的溶液中加入乙醇,析出深蓝色的晶体,该晶体中含有的化学键类型有______ 。
(4)利用 和NaOH制备的
和NaOH制备的 悬浊液检验醛基时,生成红色的
悬浊液检验醛基时,生成红色的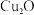 ,其晶胞结构如图所示。
,其晶胞结构如图所示。
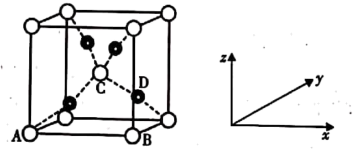
①该晶胞原子坐标参数A为 ;B为
;B为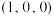 ;C为
;C为 。则D原子的坐标参数为
。则D原子的坐标参数为______ 。
②若 晶体密度为
晶体密度为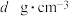 ,晶胞参数为a pm,则阿伏加德罗常数值
,晶胞参数为a pm,则阿伏加德罗常数值
______ 。
(1)
 的核外电子排布式为
的核外电子排布式为(2)
 和
和 是自然界中重要的铜盐,
是自然界中重要的铜盐, 的立体构型是
的立体构型是(3)向盛有
 溶液的试管中加入氨水,首先形成蓝色难溶物,继续加入氨水,难溶物溶解,得到深蓝色透明溶液,溶液呈深蓝色是因为存在离子
溶液的试管中加入氨水,首先形成蓝色难溶物,继续加入氨水,难溶物溶解,得到深蓝色透明溶液,溶液呈深蓝色是因为存在离子(4)利用
 和NaOH制备的
和NaOH制备的 悬浊液检验醛基时,生成红色的
悬浊液检验醛基时,生成红色的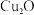 ,其晶胞结构如图所示。
,其晶胞结构如图所示。
①该晶胞原子坐标参数A为
 ;B为
;B为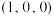 ;C为
;C为 。则D原子的坐标参数为
。则D原子的坐标参数为②若
 晶体密度为
晶体密度为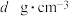 ,晶胞参数为a pm,则阿伏加德罗常数值
,晶胞参数为a pm,则阿伏加德罗常数值
您最近一年使用:0次



