铝、锌、铁在人类生产和生活中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Fe2+电子排布式为___________ ,Zn的基态原子能级最高的电子的电子云轮廓图形状为___________ 。
(2)已知Al的第一电离能为578kJ·mol-1、Mg的第一电离能为740kJ·mol-1,请解释Mg的第一电离能比Al大的原因___________ 。
(3)Zn2+可形成[Zn(NH3)6]SO4络合物,1mol[Zn(NH3)6]2+配离子中含σ键___________ mol,其阴离子中心原子的杂化方式是___________ ,NH3的沸点高于PH3的原因是___________ 。
(4)已知Zn2+等过渡元素离子形成的水合离子的颜色如下表所示:
请根据原子结构中外围电子排布推测Sc3+、Zn2+的水合离子为无色的原因:___________ 。
(5)Fe晶体中堆积方式为体心立方堆积,则这种堆积方式的空间利用率为___________ ,这种堆积方式的配位数为___________ 。
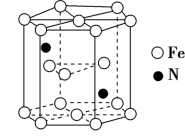
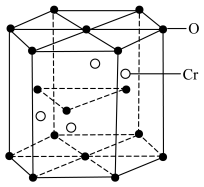
(6)Fe和N可组成一种过渡金属氮化物,其晶胞如图所示。六棱柱底边边长为xnm,高为ynm,NA为阿伏加德罗常数的值,则晶胞的密度为___________ g·cm-3(列出计算式即可)。
(1)Fe2+电子排布式为
(2)已知Al的第一电离能为578kJ·mol-1、Mg的第一电离能为740kJ·mol-1,请解释Mg的第一电离能比Al大的原因
(3)Zn2+可形成[Zn(NH3)6]SO4络合物,1mol[Zn(NH3)6]2+配离子中含σ键
(4)已知Zn2+等过渡元素离子形成的水合离子的颜色如下表所示:
| 离子 | Sc3+ | Cr3+ | Fe2+ | Zn2+ |
| 水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
(5)Fe晶体中堆积方式为体心立方堆积,则这种堆积方式的空间利用率为
(6)Fe和N可组成一种过渡金属氮化物,其晶胞如图所示。六棱柱底边边长为xnm,高为ynm,NA为阿伏加德罗常数的值,则晶胞的密度为

更新时间:2021-09-07 18:19:50
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
解题方法
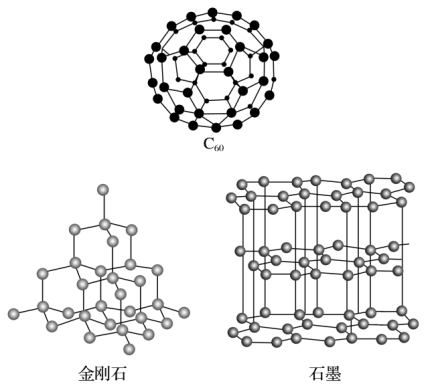
【推荐1】I.碳元素的单质有多种形式,如图依次是C60、石墨和金刚石的结构图:
回答下列问题:
(1)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为_____________ 。
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为____________ 、____________ 。
(3)C、N、O三种元素的第一电离能由小到大的顺序是______________ 。
(4)C60属于_____________ 晶体,石墨属于_____________ 晶体。
(5)金刚石晶胞含有_____________ 个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,则r=_____________ a。
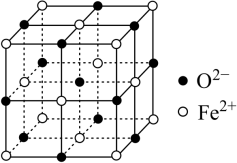
II.FeO晶体结构如下图所示,FeO晶体中Fe2+距离最近且相等的Fe2+有________ 个。若该晶胞边长为b cm,则该晶体的密度为_________ g·cm-3。(用NA表示阿伏加 德罗常数)

回答下列问题:
(1)金刚石、石墨、C60、碳纳米管等都是碳元素的单质形式,它们互为
(2)金刚石、石墨烯(指单层石墨)中碳原子的杂化形式分别为
(3)C、N、O三种元素的第一电离能由小到大的顺序是
(4)C60属于
(5)金刚石晶胞含有
II.FeO晶体结构如下图所示,FeO晶体中Fe2+距离最近且相等的Fe2+有

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】氮是地球上极为丰富的元素。回答下列问题:
(1)氮化锂
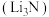 晶体中氮以
晶体中氮以 存在,基态
存在,基态 核外电子占据的最高能级共有
核外电子占据的最高能级共有(2)胸腺嘧啶是构成
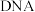 的一种含氮碱基,结构简式如图所示。
的一种含氮碱基,结构简式如图所示。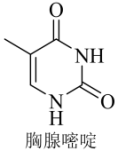
①其构成元素中N的第一电离能大于O的原因为
②其分子中 键和
键和 键的数目之比为
键的数目之比为
③1mol胸腺嘧啶在酸性条件下发生水解反应,最多消耗 。
。
(3)
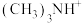 和
和 可形成离子液体,熔点低于100℃,其挥发性一般比有机溶剂
可形成离子液体,熔点低于100℃,其挥发性一般比有机溶剂 的空间结构为
的空间结构为(4)
 与
与 形成化合物的晶胞如图所示,与同一个
形成化合物的晶胞如图所示,与同一个 最近且等距的
最近且等距的 有
有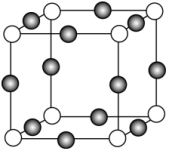
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】马氏体时效不锈钢(Cr12Ni10MoTi)具有良好的强韧性匹配和耐腐蚀性能,已经应用在航空航天、海洋建设和压力容器制造等领域。请回答下列问题:
(1)Cr在元素周期表中的位置是___________ ,Mo与Cr属于同一族且相邻的元素,则基态Mo原子的价电子排布图为___________
(2)NiO可用作电子元件材料、催化剂、搪瓷涂料和蓄电池材料等。NiO是离子晶体,其晶格能可通过如图所示的BornHaber循环计算得到。则Ni原子的第二电离能(I2)为___________ kJ·mol-1;NiO的晶格能为___________ kJ·mol-1

(3)Ti(BH4)2是一种过渡元素硼氢化物储氢材料,BH 的空间构型为
的空间构型为___________ ;与BH 互为等电子体的阳离子的结构式为
互为等电子体的阳离子的结构式为___________
(4)Cr元素形成的某种配合物的组成为CrCl3·6NH3,向1 mol该配合物中加入足量AgNO3溶液,能产生3 mol AgCl沉淀,若加入足量NaOH溶液、加热、无刺激性气味的气体产生,则1 mol该化合物中含有σ键的数目为___________
(5)TiCl4、TiBr4、TiI4均为分子晶体,则TiCl4、TiBr4、TiI4的熔、沸点由高到低的顺序为___________ (用化学式表示)
(6)铬的一种氧化物晶胞结构如图所示,该氧化物中铬元素的化合价为___________ 价;若六棱柱的底面边长为L nm,高为h nm,NA代表阿伏加德罗常数的值,则该晶体的密度ρ=___________ g·cm-3(用含L、h、NA的代数式表示,只列计算式)
(1)Cr在元素周期表中的位置是
(2)NiO可用作电子元件材料、催化剂、搪瓷涂料和蓄电池材料等。NiO是离子晶体,其晶格能可通过如图所示的BornHaber循环计算得到。则Ni原子的第二电离能(I2)为

(3)Ti(BH4)2是一种过渡元素硼氢化物储氢材料,BH
 的空间构型为
的空间构型为 互为等电子体的阳离子的结构式为
互为等电子体的阳离子的结构式为(4)Cr元素形成的某种配合物的组成为CrCl3·6NH3,向1 mol该配合物中加入足量AgNO3溶液,能产生3 mol AgCl沉淀,若加入足量NaOH溶液、加热、无刺激性气味的气体产生,则1 mol该化合物中含有σ键的数目为
(5)TiCl4、TiBr4、TiI4均为分子晶体,则TiCl4、TiBr4、TiI4的熔、沸点由高到低的顺序为
(6)铬的一种氧化物晶胞结构如图所示,该氧化物中铬元素的化合价为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】常见的太阳能电池有硅太阳能电池、镓(Ga)砷(As)太阳能电池及铜铟镓硒薄膜太阳能电池等。下列有关它们的化合物的问题,请回答:
(1)基态Ga原子的电子排布式为_______ ;H2O的沸点高于 H2Se的沸点(-42℃),其原因是_______ 。
(2)Na3AsO4中阴离子的空间构型为_______ ,As 原子采取_______ 杂化。
(3)晶体Si、SiC都属于原子晶体,请写出它们的熔点从高到低的顺序排列_______ 。
(4)银与铜位于同一副族。氟化银具有氯化钠型结构,其中的阴离子采用面心立方最密堆积方式,氯化钠的晶胞结构如图所示。则 Ag+周围等距离且最近的F-在空间围成的几何构型为_______ ,已知氟化银的密度为 dg·cm-3,则氟化银晶胞的晶胞参数为_______ nm(不必简化)。

(1)基态Ga原子的电子排布式为
(2)Na3AsO4中阴离子的空间构型为
(3)晶体Si、SiC都属于原子晶体,请写出它们的熔点从高到低的顺序排列
(4)银与铜位于同一副族。氟化银具有氯化钠型结构,其中的阴离子采用面心立方最密堆积方式,氯化钠的晶胞结构如图所示。则 Ag+周围等距离且最近的F-在空间围成的几何构型为

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A、C原子的L能层中都有两个未成对的电子,C、D同主族。E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
(1)基态E原子中,电子占据的最高能层符号为_______ ,该能层具有的原子轨道数为_______ 。
(2)E3+离子的价层电子排布式为______________ 。
(3)DCl2中D原子采取的轨道杂化方式为_________________________ ,C元素的气态氢化物的VSEPR模型名称为____________________________ 。
(4)写出一个与DAB-离子互为等电子体的合理分子式:__________________________ 。
(5)利用E(AB)63-检验E2+的离子方程式为_________________________ 。
(6)已知F的晶体结构为面心立方,F的原子直径d= 0.256nm,求1cm3 F中,含有F原子的个数约为_______________ 个。(保留3位有效数字)
(1)基态E原子中,电子占据的最高能层符号为
(2)E3+离子的价层电子排布式为
(3)DCl2中D原子采取的轨道杂化方式为
(4)写出一个与DAB-离子互为等电子体的合理分子式:
(5)利用E(AB)63-检验E2+的离子方程式为
(6)已知F的晶体结构为面心立方,F的原子直径d= 0.256nm,求1cm3 F中,含有F原子的个数约为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】以软锰矿(主要成分为 )为原料可生产高锰酸钾,为测定制得的高锰酸钾样品的纯度,进行如下实验:称取
)为原料可生产高锰酸钾,为测定制得的高锰酸钾样品的纯度,进行如下实验:称取 样品,加水溶解后定容于
样品,加水溶解后定容于 容量瓶中,摇匀。取物质的量浓度为
容量瓶中,摇匀。取物质的量浓度为 的
的 标准溶液
标准溶液 ,加入稀硫酸酸化,用上述配制的
,加入稀硫酸酸化,用上述配制的 溶液平行滴定三次,平均消耗
溶液平行滴定三次,平均消耗 溶液的体积为
溶液的体积为 。已知:
。已知: 。回答下列问题:
。回答下列问题:
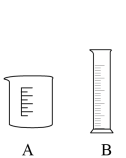
(1)为准确量取 的
的 标准溶液,最好选用的仪器为
标准溶液,最好选用的仪器为_______ (填标号)。


(2)已知 的结构式如图所示:
的结构式如图所示: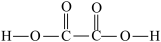 。
。
①0.1mol 分子中含有的σ键的数目为
分子中含有的σ键的数目为_______ 。
② 分子中有
分子中有_______ 种非极性键。
③有机物大多难溶于水,而 可与水互溶的原因为
可与水互溶的原因为_______
(3)基态M原子有5个未成对电子,则在前四周期中,基态原子未成对电子数最多的元素是_______ (元素填符号),基态原子有3个未成对电子的元素有_______ 种。
(4)该样品纯度的计算式为_______ (用含a、c、 、
、 、
、 的代数式表示)。
的代数式表示)。
 )为原料可生产高锰酸钾,为测定制得的高锰酸钾样品的纯度,进行如下实验:称取
)为原料可生产高锰酸钾,为测定制得的高锰酸钾样品的纯度,进行如下实验:称取 样品,加水溶解后定容于
样品,加水溶解后定容于 容量瓶中,摇匀。取物质的量浓度为
容量瓶中,摇匀。取物质的量浓度为 的
的 标准溶液
标准溶液 ,加入稀硫酸酸化,用上述配制的
,加入稀硫酸酸化,用上述配制的 溶液平行滴定三次,平均消耗
溶液平行滴定三次,平均消耗 溶液的体积为
溶液的体积为 。已知:
。已知: 。回答下列问题:
。回答下列问题:(1)为准确量取
 的
的 标准溶液,最好选用的仪器为
标准溶液,最好选用的仪器为


(2)已知
 的结构式如图所示:
的结构式如图所示: 。
。①0.1mol
 分子中含有的σ键的数目为
分子中含有的σ键的数目为②
 分子中有
分子中有③有机物大多难溶于水,而
 可与水互溶的原因为
可与水互溶的原因为(3)基态M原子有5个未成对电子,则在前四周期中,基态原子未成对电子数最多的元素是
(4)该样品纯度的计算式为
 、
、 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】[选修3:物质结构与性质]磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性元件。
(1)基态铜原子的电子排布式为_____ ;高温时氧化铜会转化为氧化亚铜,原因是____________________________________ 。
(2)元素周期表第3周期中,第一电离能比P小的非金属元素是_______ (填元素符号)。
(3)N、P、As同主族,三种元素最简单氢化物沸点由低到高的顺序为____________ ,原因是____________________________________ 。
(4)某直链多磷酸钠的阴离子呈如图1所示的无限单链状结构,其中磷氧四面体通过共用顶点的氧原子相连,则P原子的杂化方式为_____ ,该多磷酸钠的化学式为______ 。
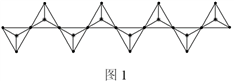
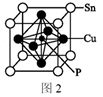
(5)某磷青铜晶胞结构如图2所示。
①则其化学式为______ 。
②该晶体中距离Sn原子最近的Cu原子有____ 个。
③若晶体密度为8.82 g·cm-3,最近的Cu原子核间距为______ pm(用含NA的代数式表示,设NA表示阿伏伽德罗常数的值)。
(1)基态铜原子的电子排布式为
(2)元素周期表第3周期中,第一电离能比P小的非金属元素是
(3)N、P、As同主族,三种元素最简单氢化物沸点由低到高的顺序为
(4)某直链多磷酸钠的阴离子呈如图1所示的无限单链状结构,其中磷氧四面体通过共用顶点的氧原子相连,则P原子的杂化方式为


(5)某磷青铜晶胞结构如图2所示。
①则其化学式为
②该晶体中距离Sn原子最近的Cu原子有
③若晶体密度为8.82 g·cm-3,最近的Cu原子核间距为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】铜配合物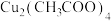 (见图1,未表示出氢原子)和锌配合物
(见图1,未表示出氢原子)和锌配合物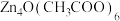 (见图2,未表示出氢原子)可分别形成笼状配合物和多孔配位聚合物。回答下列问题:
(见图2,未表示出氢原子)可分别形成笼状配合物和多孔配位聚合物。回答下列问题:
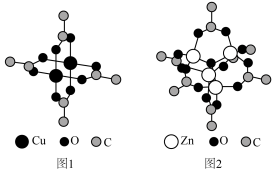
(1)基态 的未成对电子数为
的未成对电子数为___________ ; 第二电离能较大者是
第二电离能较大者是___________ 。
(2) 中C原子的轨道杂化类型为
中C原子的轨道杂化类型为___________ ,所含元素电负性由小到大的顺序为___________ 。
(3)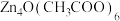 中锌离子的配位数为
中锌离子的配位数为___________ ;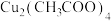 熔点为
熔点为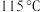 ,属于
,属于___________ (填“离子”、“共价”或“分子”)晶体。
(4)用对苯二甲酸根替换 后,
后,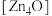 团簇被对苯二甲酸根相互连接形成的晶体Z立方晶胞的1/8如图。已知该晶体密度为
团簇被对苯二甲酸根相互连接形成的晶体Z立方晶胞的1/8如图。已知该晶体密度为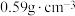 ,假设其摩尔质量为
,假设其摩尔质量为 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
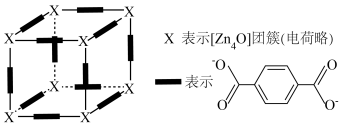
①对苯二甲酸根的___________ 原子提供孤对电子与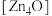 团簇形成配位键。
团簇形成配位键。
②晶体Z的化学式为___________ 。
③立方晶胞参数为___________  (列出计算式)。
(列出计算式)。
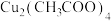 (见图1,未表示出氢原子)和锌配合物
(见图1,未表示出氢原子)和锌配合物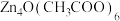 (见图2,未表示出氢原子)可分别形成笼状配合物和多孔配位聚合物。回答下列问题:
(见图2,未表示出氢原子)可分别形成笼状配合物和多孔配位聚合物。回答下列问题:
(1)基态
 的未成对电子数为
的未成对电子数为 第二电离能较大者是
第二电离能较大者是(2)
 中C原子的轨道杂化类型为
中C原子的轨道杂化类型为(3)
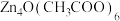 中锌离子的配位数为
中锌离子的配位数为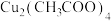 熔点为
熔点为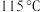 ,属于
,属于(4)用对苯二甲酸根替换
 后,
后,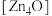 团簇被对苯二甲酸根相互连接形成的晶体Z立方晶胞的1/8如图。已知该晶体密度为
团簇被对苯二甲酸根相互连接形成的晶体Z立方晶胞的1/8如图。已知该晶体密度为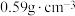 ,假设其摩尔质量为
,假设其摩尔质量为 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
①对苯二甲酸根的
 团簇形成配位键。
团簇形成配位键。②晶体Z的化学式为
③立方晶胞参数为
 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】过渡金属元素及其化合物制成的材料有着广泛的用途。
(1)第四电离能I4(Co)<I4(Fe),其原因是____ 。
(2)Ti的四卤化物熔点如表所示,TiF4熔点高于其他三种卤化物,自TiCl4到TiI4熔点依次升高,原因是____ 。
(3)某镍配合物结构如图所示,分子内含有的作用力有____ (填字母)。
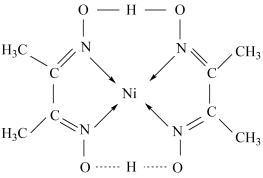
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(4)甲基呋喃与氨在高温下反应得到甲基吡咯:
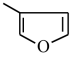 (甲基呋喃)+NH3
(甲基呋喃)+NH3
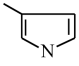 (甲基吡咯)
(甲基吡咯)
1mol甲基呋喃分子中含有σ键为____ mol,甲基吡咯分子中碳原子轨道的杂化方式是___ ;甲基吡咯分子中含有一个平面五元环,则氮原子轨道的杂化方式是____ 。
(1)第四电离能I4(Co)<I4(Fe),其原因是
(2)Ti的四卤化物熔点如表所示,TiF4熔点高于其他三种卤化物,自TiCl4到TiI4熔点依次升高,原因是
| 化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | 377 | -24.12 | 38.3 | 155 |
(3)某镍配合物结构如图所示,分子内含有的作用力有

A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(4)甲基呋喃与氨在高温下反应得到甲基吡咯:
 (甲基呋喃)+NH3
(甲基呋喃)+NH3
 (甲基吡咯)
(甲基吡咯)1mol甲基呋喃分子中含有σ键为
您最近一年使用:0次
【推荐1】某课题组在光子晶体领域取得新进展,成功制备出高质量硫化锌光子晶体。回答下列问题:
(1)基态硫原子的价电子排布图为____________________ 。第一电离能介于Al、P之间的第三周期元素为_________________ 。
(2)H2S中S的价层电子对数为__________ ,H2O的键角________ (填“>”、“<”或“=”)H2S的键角,原因是_________________________________________ 。
(3)硫酸锌中三种元素的电负性由大到小的顺序为_______________ ,硫酸锌溶于氨水可生成[Zn(NH3)4]SO4溶液,1mol[Zn(NH3)4]SO4中含有σ键的数目为____________ (NA为阿伏加 德罗常数的值)。与SO42-互为等电子体的分子有____________ (任写一种)
(4)SO2中S的杂化类型为____________ ,SO3的立体构型为_______________ 。
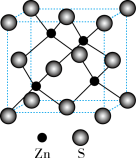
(5)硫化锌的晶胞结构如图所示,该晶胞中与硫原子距离最近且相等的硫原子有______ 个,若该晶胞的密度为ρg/cm3,用NA代表阿伏加 德罗常数的值,则晶胞边长为_________________ nm。
(1)基态硫原子的价电子排布图为
(2)H2S中S的价层电子对数为
(3)硫酸锌中三种元素的电负性由大到小的顺序为
(4)SO2中S的杂化类型为
(5)硫化锌的晶胞结构如图所示,该晶胞中与硫原子距离最近且相等的硫原子有

您最近一年使用:0次
【推荐2】2019年1月3日上午,嫦娥四号探测器翩然落月,首次实现人类飞行器在月球背面的软着陆。所搭载的“玉兔二号”月球车,通过砷化镓(GaAs)太阳能电池提供能量进行工作。回答下列问题:
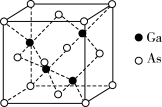
(1)基态Ga原子价电子排布式__________________ ,核外电子占据最高能级的电子云形状为_________ ;基态As原子最高能层上有_______ 个电子。
(2)镓失去电子的逐级电离能(单位:kJ•mol−1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为____ 和+3,砷的第一电离能比镓_____ (填“大”或“小”)。
(3)第四周期元素中,与基态As原子核外未成对电子数目相同的元素符号为__________ 。
(4)砷化镓可由(CH3)3Ga和AsH3在700℃制得,(CH3)3Ga中Ga原子的杂化方式为______ ,AsH3分子的空间构型为____________ 。
(5)相同压强下,AsH3的沸点______ NH3(填“大于”或“小于”),原因为__________________
(6)GaAs为原子晶体,其晶胞结构如图所示,Ga与As以___________ (填“共价键”或“离子键”)键合。设阿伏加 德罗常数的值为NA,该晶胞边长为a pm,则GaAs晶体的密度为_____ g•cm−3(列出计算式即可)。

(1)基态Ga原子价电子排布式
(2)镓失去电子的逐级电离能(单位:kJ•mol−1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为
(3)第四周期元素中,与基态As原子核外未成对电子数目相同的元素符号为
(4)砷化镓可由(CH3)3Ga和AsH3在700℃制得,(CH3)3Ga中Ga原子的杂化方式为
(5)相同压强下,AsH3的沸点
(6)GaAs为原子晶体,其晶胞结构如图所示,Ga与As以
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】铁—末端亚胺基物种被认为是铁催化的烯烃氮杂环丙烷化、C—H键胺化反应以及铁促进的由氮气分子到含氮化合物的转化反应中的关键中间体。对这类活性金属配合物的合成、谱学表征和反应性质的研究一直是化学家们关注的重点。我国科学家成功实现了首例两配位的二价铁—末端亚胺基配合物的合成。回答下列有关问题。
(1)Fe2+的价电子排布式___ 。
(2)1molNH4BF4(氟硼酸铵)中含有的配位键数是___ 。
(3)pH=6时,EDTA可滴定溶液中Fe2+的含量,EDTA的结构如图所示。

①结构中电负性最大的元素是___ ,其中C、N原子的杂化形式分别为___ 、___ 。
②EDTA可与多种金属阳离子形成稳定配合物的原因是___ 。
(4)我国科学家近年制备了热动力学稳定的氦-钠化合物,其晶胞结构如图所示。

①该化合物的化学式为___ 。
②其晶胞参数为a=395pm,晶体密度为___ g/cm3(NA表示阿伏加 德罗常数数值,列出计算式即可)
(1)Fe2+的价电子排布式
(2)1molNH4BF4(氟硼酸铵)中含有的配位键数是
(3)pH=6时,EDTA可滴定溶液中Fe2+的含量,EDTA的结构如图所示。

①结构中电负性最大的元素是
②EDTA可与多种金属阳离子形成稳定配合物的原因是
(4)我国科学家近年制备了热动力学稳定的氦-钠化合物,其晶胞结构如图所示。

①该化合物的化学式为
②其晶胞参数为a=395pm,晶体密度为
您最近一年使用:0次



