从明矾[KAl(SO4)2·12H2O]制备Al、K2SO4和H2SO4的过程如下图所示:
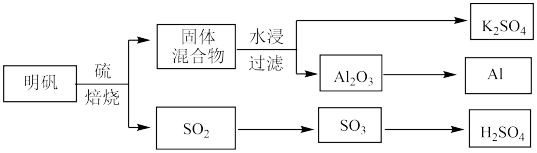
(1) S的基态原子核外有______ 个未成对电子;Cl 的基态原子核外电子排布式为________ 。
(2)用“>”或“<”填空:
(3) SO2分子构型为__________ ;SO3中硫原子采用杂化方式为__________ ;写出与SO3互为等电子体的一种离子:______________ 。
(4) Al单质为面心立方晶体,其晶胞参数a=0.405 nm,则Al的密度ρ=____ g·cm -3(只需列出计算式,不必计算出结果)。

(1) S的基态原子核外有
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| O | Cl- | KCl | H2SO4 |
(3) SO2分子构型为
(4) Al单质为面心立方晶体,其晶胞参数a=0.405 nm,则Al的密度ρ=
更新时间:2020-10-25 10:59:07
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L层上有2对成对电子;E+原子核外有3层电子且M层3d轨道电子全充满。请回答下列问题:
(1)E元素在周期表中的位置_____ ,属于_____ 区。
(2)B、C、D三种元素的第一电离能数值由小到大 的顺序为___ (填元素符号),第一电离能最大的原因是____ 。
(3)D元素与氟元素相比,电负性:D____ F(填“>”、“=”或“<”),下列表述中能证明这一事实的是____ (填选项序号)
A.常温下氟气的颜色比D单质的颜色深
B.氟气与D的氢化物剧烈反应,产生D的单质
C.氟与D形成的化合物中D元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(4)只含C、A两元素的离子化合物NH5,它的所有原子的最外层都符合相应的稀有气体原子电子层结构,其电子式为___ ,它的晶体中含有多种化学键,但一定不含有的化学键是____ (填选项序号)。
A.极性键 B.非极性键 C.配位键 D.金属键
(5)B2A4是重要的基本石油化工原料。lmolB2A4分子中含σ键____ mol。
(1)E元素在周期表中的位置
(2)B、C、D三种元素的第一电离能数值由
(3)D元素与氟元素相比,电负性:D
A.常温下氟气的颜色比D单质的颜色深
B.氟气与D的氢化物剧烈反应,产生D的单质
C.氟与D形成的化合物中D元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(4)只含C、A两元素的离子化合物NH5,它的所有原子的最外层都符合相应的稀有气体原子电子层结构,其电子式为
A.极性键 B.非极性键 C.配位键 D.金属键
(5)B2A4是重要的基本石油化工原料。lmolB2A4分子中含σ键
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】磷是生物体中不可缺少的元素之一,它能形成多种化合物。
(1)基态磷原子中,电子占据的最高能层符号为___________ ;该能层能量最高的电子云在空间有___________ 个伸展方向,原子轨道呈__________ 形。
(2)磷元素与同周期相邻两元素相比,第一电离能由大到小的顺序为___________ 。
(3)单质磷与Cl2反应,可以生成PCl3和PCl5.其中各原子均满足8电子稳定结构的化合物中,P原子的杂化轨道类型为__________ ,其分子的空间构型为____________ 。
(4)磷化硼(BP)是一种超硬耐磨涂层材料,如图为其晶胞,硼原子与磷原子最近的距离为acm。用Mg/mol表示磷化硼的摩尔质量,NA表示阿伏加德罗常数的值,则磷化硼晶体的密度为___________ 。

(5)H3PO4为三元中强酸,与Fe3+形成H3[Fe(PO4)2],此性质常用于掩蔽溶液中的Fe3+。基态Fe3+的核外电子排布式为__________ ;PO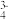 作为
作为_________ 为Fe提供_________ 。
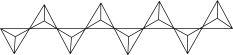
(6)磷酸盐分为直链多磷酸盐、支链状超磷酸盐和环状聚偏磷酸盐三类。某直链多磷酸钠的阴离子呈如图所示的无限单链状结构,其中磷氧四面体通过共用顶角氧原子相连。则该多磷酸钠的化学式为_______ 。
(1)基态磷原子中,电子占据的最高能层符号为
(2)磷元素与同周期相邻两元素相比,第一电离能由大到小的顺序为
(3)单质磷与Cl2反应,可以生成PCl3和PCl5.其中各原子均满足8电子稳定结构的化合物中,P原子的杂化轨道类型为
(4)磷化硼(BP)是一种超硬耐磨涂层材料,如图为其晶胞,硼原子与磷原子最近的距离为acm。用Mg/mol表示磷化硼的摩尔质量,NA表示阿伏加德罗常数的值,则磷化硼晶体的密度为

(5)H3PO4为三元中强酸,与Fe3+形成H3[Fe(PO4)2],此性质常用于掩蔽溶液中的Fe3+。基态Fe3+的核外电子排布式为
 作为
作为(6)磷酸盐分为直链多磷酸盐、支链状超磷酸盐和环状聚偏磷酸盐三类。某直链多磷酸钠的阴离子呈如图所示的无限单链状结构,其中磷氧四面体通过共用顶角氧原子相连。则该多磷酸钠的化学式为

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐3】已知X、Y、Z、W、Q、R六种元素中,原子序数依次增大,其结构或性质信息如表。
请根据信息回答有关问题:
(1)元素X原子核外共有_______ 种不同运动状态的电子。
(2)元素X、Y的第一电离能较大的是_______ (填元素符号),其理由是_______ 。
(3)元素X、Y、Z的电负性最小的是_______ (填元素名称)。
(4)元素W的基态原子核外电子排布式为_______ 。
(5)元素Q在周期表中位置为_______ ,元素R基态原子的价电子排布式为_______ 。
| 元素 | 结构或性质信息 |
| X | 基态原子的最外层电子排布式为nsnnpn+1 |
| Y | 基态原子的L层上有2个未成对的p电子 |
| Z | 基态原子的M层上s、p电子个数相等 |
| W | 位于第4周期ⅥB族 |
| Q | 元素的正三价离子的3d能级半充满 |
| R | 元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子 |
(1)元素X原子核外共有
(2)元素X、Y的第一电离能较大的是
(3)元素X、Y、Z的电负性最小的是
(4)元素W的基态原子核外电子排布式为
(5)元素Q在周期表中位置为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】锰及其化合物用途非常广泛。回答下列问题:
(1)基态Mn原子的电子排布式为_________ 。
(2)MnCl2熔点(650℃)比MnO熔点(1650℃)低, 其主要原因是____________ 。
(3)锰的一种配合物的化学式为[Mn(CO)5(CH3CN)]Br。
①配合物中锰元素的价态为________ 。
②配体CH3CN与中心原子形成配位键时,提供孤对电子的原子是_____ ,该分子中碳原子的杂化方式为_______ ;C、H、N的电负性从大到小的顺序为________ 。
③配体CO的等电子体有:_________ (任写一种),N2O的分子空间构型为__________ 。
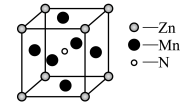
(4)某种含锰特殊材料的晶胞结构如下图所示,该晶体的化学式为:_________ ;若晶胞边长为a nm,用NA表示阿伏伽德罗常数的值,则该晶胞的密度为____ ( 列出代数式即可)。
(1)基态Mn原子的电子排布式为
(2)MnCl2熔点(650℃)比MnO熔点(1650℃)低, 其主要原因是
(3)锰的一种配合物的化学式为[Mn(CO)5(CH3CN)]Br。
①配合物中锰元素的价态为
②配体CH3CN与中心原子形成配位键时,提供孤对电子的原子是
③配体CO的等电子体有:
(4)某种含锰特殊材料的晶胞结构如下图所示,该晶体的化学式为:

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】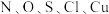 五种元素的单质及其化合物在现代工业生产中有着广泛应用。请回答下列问题:
五种元素的单质及其化合物在现代工业生产中有着广泛应用。请回答下列问题:
(1)第一电离能:N_______ (填“>”或“<”,下同)O,电负性:O_______ S。
(2) 极易溶于水的原因是
极易溶于水的原因是_______ ; 属于
属于_______ (填“极性”或“非极性”)分子,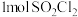 含有
含有 的键为
的键为_______  。
。
(3) 的空间构型是
的空间构型是_______ , 的中心原子的杂化方式为
的中心原子的杂化方式为_______ 。
(4)与 互为等电子体的微粒有
互为等电子体的微粒有_______ (任写两种)。
(5) 与
与 形成化合物的晶胞如图所示。
形成化合物的晶胞如图所示。
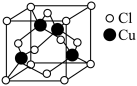
该晶体的化学式为_______ .已知该晶体中 原子和
原子和 原子之间的最短距离为
原子之间的最短距离为 ,且恰好为体对角线的
,且恰好为体对角线的 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该晶体的密度为
,则该晶体的密度为_______ (只写计算式) 。
。
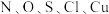 五种元素的单质及其化合物在现代工业生产中有着广泛应用。请回答下列问题:
五种元素的单质及其化合物在现代工业生产中有着广泛应用。请回答下列问题:(1)第一电离能:N
(2)
 极易溶于水的原因是
极易溶于水的原因是 属于
属于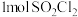 含有
含有 的键为
的键为 。
。(3)
 的空间构型是
的空间构型是 的中心原子的杂化方式为
的中心原子的杂化方式为(4)与
 互为等电子体的微粒有
互为等电子体的微粒有(5)
 与
与 形成化合物的晶胞如图所示。
形成化合物的晶胞如图所示。
该晶体的化学式为
 原子和
原子和 原子之间的最短距离为
原子之间的最短距离为 ,且恰好为体对角线的
,且恰好为体对角线的 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该晶体的密度为
,则该晶体的密度为 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】A B C D E是前四周期元素,且原子序数依次增大。A的原子核中只有一个质子;B原子外围电子排布nSn nPn ;D原子核外有2个电子层,S轨道电子总数和P轨道电子总数相等;E2+ 的M能层上各能级的电子数之比为1:3:3 请回答下列问题:
(1)E原子基态电子排布式_______________________
(2)这五种元素中电负性最大的是________________ (填元素符号,下同)第一电离能最小的是__________________
(3)化合物EBC2中阴离子是BC22-,和BC2 2- 互为等电子体的分子有C2D和____________ ,由此可知BC2 2- 的空间构型是___________ 。
(4)由A C两元素形成一种10电子分子X,写出X的电子式_________
X可与多种金属离子形成配合物。钴有两种化学式均为Co(X)5BrSO4的配合物,且配位数均为6,则它们分别溶于水时电离出的阳离子的化学式可能是_______________ 和______________ ;
(5)A C两元素还能形成一种离子化合物,写出该化合物化学式__________ ;你认为该化合物中除了离子键外还存在化学键是__________________ ;该化合物溶于水有气体产生,写出反应化学方程式________________________
(1)E原子基态电子排布式
(2)这五种元素中电负性最大的是
(3)化合物EBC2中阴离子是BC22-,和BC2 2- 互为等电子体的分子有C2D和
(4)由A C两元素形成一种10电子分子X,写出X的电子式
X可与多种金属离子形成配合物。钴有两种化学式均为Co(X)5BrSO4的配合物,且配位数均为6,则它们分别溶于水时电离出的阳离子的化学式可能是
(5)A C两元素还能形成一种离子化合物,写出该化合物化学式
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】(1)在硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构。则分子中B原子杂化轨道的类型及同层分子间的主要作用力分别是:( )
A.sp,范德华力 B.sp2,范德华力 C.sp2,氢键 D.sp3,氢键
(2)在基态多电子原子中,关于核外电子能量的叙述错误的是:( )
A.最易失去的电子能量最高
B.电离能最小的电子能量最高
C.p轨道电子能量一定高于s轨道电子能量
D.在离核最近区域内运动的电子能量最低
(3)已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式正确的:( )

A、ZXY3 B、ZX2Y6 C、ZX4Y8 D、ZX8Y12
(4)向银氨溶液中加入NaCl溶液,无白色沉淀产生,说明银氨溶液中_________ (填离子符号)离子浓度很小。若向银氨溶液中加入盐酸立即产生白色沉淀,写出此反应的离子方程式__________________________ 。下列分子或离子中都存在着配位键的是 ( )
A.NH3、H2O B. 、H3O+
、H3O+
C.N2、HClO D. [Cu(NH3)4]2+、PCl3
(5)如图是从NaCl或CsCl晶体结构中分割出来的部分结构图,其中属于从NaCl晶体中分割出来的结构图的是( )

A.(1)和(3) B.(2)和(3) C.(1)和(4) D.只有(4)
A.sp,范德华力 B.sp2,范德华力 C.sp2,氢键 D.sp3,氢键
(2)在基态多电子原子中,关于核外电子能量的叙述错误的是:
A.最易失去的电子能量最高
B.电离能最小的电子能量最高
C.p轨道电子能量一定高于s轨道电子能量
D.在离核最近区域内运动的电子能量最低
(3)已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式正确的:

A、ZXY3 B、ZX2Y6 C、ZX4Y8 D、ZX8Y12
(4)向银氨溶液中加入NaCl溶液,无白色沉淀产生,说明银氨溶液中
A.NH3、H2O B.
 、H3O+
、H3O+C.N2、HClO D. [Cu(NH3)4]2+、PCl3
(5)如图是从NaCl或CsCl晶体结构中分割出来的部分结构图,其中属于从NaCl晶体中分割出来的结构图的是

A.(1)和(3) B.(2)和(3) C.(1)和(4) D.只有(4)
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】X、Y、Z、W、M、N是原子序数依次增大的前四周期元素,X的核外电子总数与其电子层数相同;Z和M同主族,且两者的单质室温下均为气体;W的原子序数为Y原子价电子数的3倍,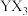 极易溶于水;基态
极易溶于水;基态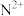 的d轨道半充满。由上述元素中的四种组成的两种化合物常用于合成阻燃材料,其结构简式如图所示。
的d轨道半充满。由上述元素中的四种组成的两种化合物常用于合成阻燃材料,其结构简式如图所示。
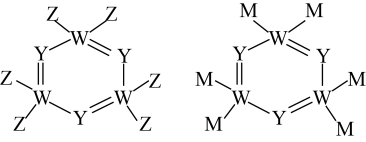
回答下列问题:
(1)基态N原子的价电子排布式为______ ,基态X原子中电子占据最高能级的电子云轮廓图为______ 形。写出M在周期表中的位置______ 。
(2)W、M形成的一种化合物以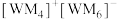 的形式存在,下列对
的形式存在,下列对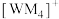 中心原子杂化方式推断合理的是
中心原子杂化方式推断合理的是______ (填标号)。
a. b.
b. c.
c. d.
d.
(3)①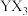 极易溶于水,难溶于
极易溶于水,难溶于 ,可能原因是
,可能原因是______ 。
②W与Y的第一电离能,W______ Y(填大于、小于或等于),从原子结构的角度解释原因______ 。
(4)如果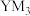 的水解产物是
的水解产物是 和
和 ,则Y与M中电负性较大的是
,则Y与M中电负性较大的是______ (填元素名称)。
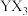 极易溶于水;基态
极易溶于水;基态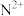 的d轨道半充满。由上述元素中的四种组成的两种化合物常用于合成阻燃材料,其结构简式如图所示。
的d轨道半充满。由上述元素中的四种组成的两种化合物常用于合成阻燃材料,其结构简式如图所示。
回答下列问题:
(1)基态N原子的价电子排布式为
(2)W、M形成的一种化合物以
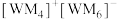 的形式存在,下列对
的形式存在,下列对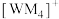 中心原子杂化方式推断合理的是
中心原子杂化方式推断合理的是a.
 b.
b. c.
c. d.
d.
(3)①
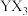 极易溶于水,难溶于
极易溶于水,难溶于 ,可能原因是
,可能原因是②W与Y的第一电离能,W
(4)如果
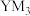 的水解产物是
的水解产物是 和
和 ,则Y与M中电负性较大的是
,则Y与M中电负性较大的是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】以氮化镓(GaN)、砷化镓(GaAs)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点,如砷化镓灯泡寿命是普通灯泡的100倍,而耗能仅为10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措。请回答下列问题:
(1)镓为元素周期表第31号元素,基态镓原子的电子排布式为___________ ,核外电子占据最高能层符号为________ 。
(2)氮化镓与金刚石具有相似的晶体结构,氮化镓中氮原子与镓原子之间以_______ 键相结合,氮化镓属于_______ 晶体。
(3)下列说法正确的是_______
A.第一电离能:As < Ga B.砷和镓都属于p区元素
C.电负性:As < Ga D.半导体GaP、SiC与砷化镓为等电子体
(4)①砷化镓是将(CH3)3Ga和AsH3用MOCVD(金属有机物化学气相淀积)方法制备得到的,该反应在700℃进行,反应的方程式为:____________________ 。
②反应物AsH3分子的几何构型为_______ ,(CH3)3Ga中镓原子杂化方式为___ 。
(1)镓为元素周期表第31号元素,基态镓原子的电子排布式为
(2)氮化镓与金刚石具有相似的晶体结构,氮化镓中氮原子与镓原子之间以
(3)下列说法正确的是
A.第一电离能:As < Ga B.砷和镓都属于p区元素
C.电负性:As < Ga D.半导体GaP、SiC与砷化镓为等电子体
(4)①砷化镓是将(CH3)3Ga和AsH3用MOCVD(金属有机物化学气相淀积)方法制备得到的,该反应在700℃进行,反应的方程式为:
②反应物AsH3分子的几何构型为
您最近一年使用:0次



