X、Y、Z、W、M、N是原子序数依次增大的前四周期元素,X的核外电子总数与其电子层数相同;Z和M同主族,且两者的单质室温下均为气体;W的原子序数为Y原子价电子数的3倍,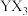 极易溶于水;基态
极易溶于水;基态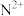 的d轨道半充满。由上述元素中的四种组成的两种化合物常用于合成阻燃材料,其结构简式如图所示。
的d轨道半充满。由上述元素中的四种组成的两种化合物常用于合成阻燃材料,其结构简式如图所示。
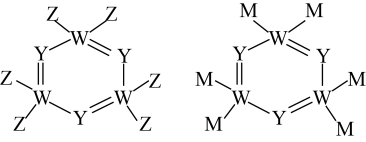
回答下列问题:
(1)基态N原子的价电子排布式为______ ,基态X原子中电子占据最高能级的电子云轮廓图为______ 形。写出M在周期表中的位置______ 。
(2)W、M形成的一种化合物以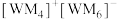 的形式存在,下列对
的形式存在,下列对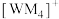 中心原子杂化方式推断合理的是
中心原子杂化方式推断合理的是______ (填标号)。
a. b.
b. c.
c. d.
d.
(3)①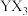 极易溶于水,难溶于
极易溶于水,难溶于 ,可能原因是
,可能原因是______ 。
②W与Y的第一电离能,W______ Y(填大于、小于或等于),从原子结构的角度解释原因______ 。
(4)如果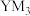 的水解产物是
的水解产物是 和
和 ,则Y与M中电负性较大的是
,则Y与M中电负性较大的是______ (填元素名称)。
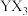 极易溶于水;基态
极易溶于水;基态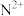 的d轨道半充满。由上述元素中的四种组成的两种化合物常用于合成阻燃材料,其结构简式如图所示。
的d轨道半充满。由上述元素中的四种组成的两种化合物常用于合成阻燃材料,其结构简式如图所示。
回答下列问题:
(1)基态N原子的价电子排布式为
(2)W、M形成的一种化合物以
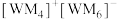 的形式存在,下列对
的形式存在,下列对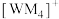 中心原子杂化方式推断合理的是
中心原子杂化方式推断合理的是a.
 b.
b. c.
c. d.
d.
(3)①
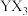 极易溶于水,难溶于
极易溶于水,难溶于 ,可能原因是
,可能原因是②W与Y的第一电离能,W
(4)如果
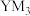 的水解产物是
的水解产物是 和
和 ,则Y与M中电负性较大的是
,则Y与M中电负性较大的是
更新时间:2024-02-14 11:37:08
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
名校
【推荐1】现有七种元素A、B、C、D、E、F、G,其中A、B、C为三个不同周期的短周期元素,E、F、G为第四周期元素。请根据下列相关信息,回答问题。
(1)C基态原子中能量最高的电子,其电子云在空间有_________ 个方向,原子轨道呈________ 形,C简单离子核外有______ 种运动状态不同的电子。
(2)①一般情况下,同种物质为固态时密度大于其液态,但固态A2B的密度比其液态时小,原因是_______ ;
②A2B2难溶于CS2,简要说明理由:__________________________________________ 。
(3)G位于________ 族________ 区,它的一种氧化物常用于工业生产硫酸的催化剂,已知G在该氧化物中的化合价等于其价电子数,则该氧化物的化学式为_______________ ;F晶体的空间堆积方式为________ 。
(4)ED3分子的VSEPR模型名称为__________ ,其中E原子的杂化轨道类型为________ 。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数与s电子数相等 |
| C基态原子的价电子排布为nsn-1npn+1 |
| D的能层数与C相同,且电负性比C大 |
| E元素的主族序数与周期数的差为1,且第一电离能比同周期相邻两种元素都大 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第五列 |
(2)①一般情况下,同种物质为固态时密度大于其液态,但固态A2B的密度比其液态时小,原因是
②A2B2难溶于CS2,简要说明理由:
(3)G位于
(4)ED3分子的VSEPR模型名称为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】Ⅰ.现有部分元素的性质与原子(或分子)结构如表所示:
回答下列问题:
(1)T是_______ (填元素符号)。元素X在周期表的位置_______ 。
(2)Y与Z相比,金属性较强的是_____ (填元素符号),下列表述中能证明这一事实的是_______ (填标号)。
A.Y单质的熔点比Z单质的低
B.Y的化合价比Z的低
C.Y单质与水反应比Z单质与水反应剧烈得多
(3)Z的最高价氧化物属于_______ 氧化物(“酸性”、“碱性”或“两性”),写出Y、Z最高价氧化物对应水化物反应的离子方程式____ 。
Ⅱ.2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。
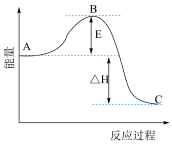
已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
(4)图中A、C分别表示_______ 、_______ 。
(5)图中△H=_______ kJ·mol-1。
(6)已知单质硫的燃烧热为296KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H_______ 。
元素 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质分子为双原子分子,是空气的主要成分,分子比较稳定 |
| Y | M层比K层少一个电子 |
| Z | 有三个电子层,M层上有3个电子 |
(1)T是
(2)Y与Z相比,金属性较强的是
A.Y单质的熔点比Z单质的低
B.Y的化合价比Z的低
C.Y单质与水反应比Z单质与水反应剧烈得多
(3)Z的最高价氧化物属于
Ⅱ.2SO2(g)+O2(g)
 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。
已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
(4)图中A、C分别表示
(5)图中△H=
(6)已知单质硫的燃烧热为296KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大。元素A、B、C、D、E的原子结构等信息如下:
请回答下列问题:(用A、B、C、D、E,所对应的元素符号作答)
(1)D位于周期表中_______ 区,E的核外电子排布式是_____________________ 。
(2)B、C、D第一电离能由大到小为__________________ 。
(3)A和C形成的常见分子中,中心原子的杂化方式为_________ 。
(4)1molABC分子中含有σ键数目为_________ 。
(5)与化合物BD互为等电子体的阴离子化学式为_________ 。
(6)B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是__________________ 。
| 元素 | 元素性质或原子结构 |
| A | 周期表中原子半径最小的元素 |
| B | 原子核外有三种不同的能级且各个能级所填充的电子数相同 |
| C | 最外层p轨道半充满 |
| D | 位于短周期,其原子的核外成对电子数是未成对电子数的3倍 |
| E | 位于ds区且原子的最外层电子数为偶数 |
请回答下列问题:(用A、B、C、D、E,所对应的元素符号作答)
(1)D位于周期表中
(2)B、C、D第一电离能由大到小为
(3)A和C形成的常见分子中,中心原子的杂化方式为
(4)1molABC分子中含有σ键数目为
(5)与化合物BD互为等电子体的阴离子化学式为
(6)B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】光伏材料又称太阳能材料,能将太阳能直接转换成电能。可作太阳能电池材料的有单晶硅、多晶硅、非晶硅、 、
、 、
、 、
、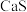 、
、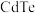 、
、 等。
等。
(1)元素镓(Ga)在元素周期表中的位置是___________ 。
(2)P、S、Ga元素的电负性从大到小的顺序为___________ 。
(3)As元素的第一电离能___________ (填“大于”“小于”或“等于”)Se元素的第一电离能,原因是___________ 。
(4)写出原子序数最小的第Ⅷ族元素基态原子的核外电子排布式___________
(5)第四周期中4s轨道半充满的元素共有___________ 种。
(6)太阳能电池材料的很多金属元素在枃灼烧时会产生特殊的火焰颜色,产生这种现象是因为基态原子变为激发态原子后,电子再跃迁到___________ (选填“较高”或“较低”)能基状态时释放能量。
 、
、 、
、 、
、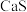 、
、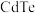 、
、 等。
等。(1)元素镓(Ga)在元素周期表中的位置是
(2)P、S、Ga元素的电负性从大到小的顺序为
(3)As元素的第一电离能
(4)写出原子序数最小的第Ⅷ族元素基态原子的核外电子排布式
(5)第四周期中4s轨道半充满的元素共有
(6)太阳能电池材料的很多金属元素在枃灼烧时会产生特殊的火焰颜色,产生这种现象是因为基态原子变为激发态原子后,电子再跃迁到
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】BaTiO3,被用作陶瓷电容器的介电材料、麦克风和其他传感器的压电材料。以含钛炉渣(主要成分是TiO2,含少量Fe2O3、CaO、SiO2等)为原料制备BaTiO3的流程如下:
回答下列问题:
(1)下列为Ba粒子简化电子排布式,其中能量最高的是 (填字母)。
(2)“还原”中发生反应的离子方程式为________ 。若省去“还原”工艺,则________ 。
(3)设计实验检验滤液1中是否含有Fe2+:________ 。
(4)BaTiO(C2O4)2·4H2O中Ti的化合价为________ ,“焙烧”发生反应的化学方程式为________ 。
(5)经X射线分析鉴定,钛酸钡(BaTiO3)的晶胞结构如下图所示(Ti4+、Ba2+均与O2-相接触),已知晶胞边长为 pm,O2-的半径为
pm,O2-的半径为 pm,则Ti4+、Ba2+的半径分别为
pm,则Ti4+、Ba2+的半径分别为______ pm、______ pm。(用含 、
、 的代数式表示)
的代数式表示)
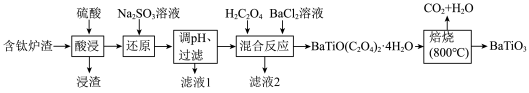
| 金属离子 | TiO2+ | Fe2+ | Fe3+ |
| 开始沉淀的pH | 0.5 | 6.3 | 1.5 |
| 完全沉淀的pH | 2.5 | 8.3 | 2.8 |
(1)下列为Ba粒子简化电子排布式,其中能量最高的是 (填字母)。
| A.[Xe]6s2 | B.[Xe]6s1 | C.[Xe]6s16p1 | D.[Xe]6s0p2 |
(2)“还原”中发生反应的离子方程式为
(3)设计实验检验滤液1中是否含有Fe2+:
(4)BaTiO(C2O4)2·4H2O中Ti的化合价为
(5)经X射线分析鉴定,钛酸钡(BaTiO3)的晶胞结构如下图所示(Ti4+、Ba2+均与O2-相接触),已知晶胞边长为
 pm,O2-的半径为
pm,O2-的半径为 pm,则Ti4+、Ba2+的半径分别为
pm,则Ti4+、Ba2+的半径分别为 、
、 的代数式表示)
的代数式表示)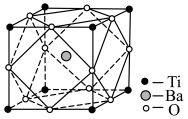
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】过渡元素在工业、农业、科学技术以及人类生活等方面有着重要作用。请回答下列问题:
(1)基态Cu原子的核外电子排布式为__ 。
(2)高密度磁记录材料纳米钴(Co)可通过亚肼(N2H2)还原氯化亚钴来制备。
①N2H2分子中氮原子的杂化形式为___ 。
②亚肼(N2H2)分子中四个原子在一个平面上,由于几何形状的不同,它有两种同分异构体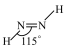 和
和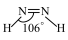 ,乙炔(C2H2)与亚肼(N2H2)均为四原子分子,但乙炔(C2H2)分子只有一种结构,原因是
,乙炔(C2H2)与亚肼(N2H2)均为四原子分子,但乙炔(C2H2)分子只有一种结构,原因是__ 。
③Co3+能与NH3和N 形成配离子[Co(N3)(NH3)5]2+,在该配离子中Co3+的配位数为
形成配离子[Co(N3)(NH3)5]2+,在该配离子中Co3+的配位数为__ ;写出与N 互为等电子体的分子:
互为等电子体的分子:___ (任写一种,填化学式);N 的空间构型是
的空间构型是__ 。
(3)FeO、NiO晶胞结构相同,晶体中r(Ni2+)和r(Fe2+)分别为69pm和78pm,则熔点:NiO___ FeO(填“>”或“<”),原因是___ ;已知NiO晶体结构中阴、阳离子的配位数均为6,则NiO晶胞的俯视图可能是__ (填字母序号)。

(4)CdS的立方晶胞结构如图所示,已知阿伏加 德罗常数的值为NA,该晶胞的晶胞参数为apm,该晶体的密度为ρg/cm-3,则Cd原子的相对原子质量的数值近似为___ (用含ρ、NA、a的代数式表示)。

(1)基态Cu原子的核外电子排布式为
(2)高密度磁记录材料纳米钴(Co)可通过亚肼(N2H2)还原氯化亚钴来制备。
①N2H2分子中氮原子的杂化形式为
②亚肼(N2H2)分子中四个原子在一个平面上,由于几何形状的不同,它有两种同分异构体
 和
和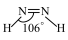 ,乙炔(C2H2)与亚肼(N2H2)均为四原子分子,但乙炔(C2H2)分子只有一种结构,原因是
,乙炔(C2H2)与亚肼(N2H2)均为四原子分子,但乙炔(C2H2)分子只有一种结构,原因是③Co3+能与NH3和N
 形成配离子[Co(N3)(NH3)5]2+,在该配离子中Co3+的配位数为
形成配离子[Co(N3)(NH3)5]2+,在该配离子中Co3+的配位数为 互为等电子体的分子:
互为等电子体的分子: 的空间构型是
的空间构型是(3)FeO、NiO晶胞结构相同,晶体中r(Ni2+)和r(Fe2+)分别为69pm和78pm,则熔点:NiO

(4)CdS的立方晶胞结构如图所示,已知阿伏加 德罗常数的值为NA,该晶胞的晶胞参数为apm,该晶体的密度为ρg/cm-3,则Cd原子的相对原子质量的数值近似为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】碳和硅是自然界中大量存在的元素,硅及其化合物是工业上最重要的材料。设NA代表阿伏加德罗常数的值。粗硅的制备方法有两种:
方法一:SiO2+2C Si+2CO↑
Si+2CO↑
方法二:SiO2+2Mg Si+2MgO
Si+2MgO
(1)基态Si原子的电子排布式为______ 。
(2)上述2个反应中,涉及的所有元素中第一电离能最小的是______ (填元素符号)。
(3)C(金刚石)、晶体硅、CO三种晶体的熔点由高到低的顺序______ 。
(4)SiO2晶胞(如图1)可理解成将金刚石晶胞(如图2)中的C原子置换成Si原子,然后在Si-Si键中间插入O原子而形成。

①推测SiO2晶胞中Si采取_______ 杂化。
②SiO2晶胞中含有______ 个Si原子和______ 个O原子。
③假设金刚石晶胞的边长为apm,试计算该晶胞的密度为______ g•cm-3(写出表达式即可),设C原子半径为rC,则金刚石晶胞空间占有率为______ %(列出计算表达式)。
方法一:SiO2+2C
 Si+2CO↑
Si+2CO↑方法二:SiO2+2Mg
 Si+2MgO
Si+2MgO(1)基态Si原子的电子排布式为
(2)上述2个反应中,涉及的所有元素中第一电离能最小的是
(3)C(金刚石)、晶体硅、CO三种晶体的熔点由高到低的顺序
(4)SiO2晶胞(如图1)可理解成将金刚石晶胞(如图2)中的C原子置换成Si原子,然后在Si-Si键中间插入O原子而形成。

①推测SiO2晶胞中Si采取
②SiO2晶胞中含有
③假设金刚石晶胞的边长为apm,试计算该晶胞的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】下列说法正确的有____________ 。
(1)每一周期元素都是从碱金属开始,以稀有气体结束
(2)f区都是副族元素,s区和p区的都是主族元素
(3)铝的第一电离能大于K的第一电离能
(4)B电负性和Si相近
(5)Ge的电负性为1.8,则其是典型的非金属
(6)半径:K+>Cl—
(7)酸性 HClO>H2SO4,碱性:NaOH > Mg(OH)2
(8)元素的最高正化合价=其最外层电子数=族序数
(1)每一周期元素都是从碱金属开始,以稀有气体结束
(2)f区都是副族元素,s区和p区的都是主族元素
(3)铝的第一电离能大于K的第一电离能
(4)B电负性和Si相近
(5)Ge的电负性为1.8,则其是典型的非金属
(6)半径:K+>Cl—
(7)酸性 HClO>H2SO4,碱性:NaOH > Mg(OH)2
(8)元素的最高正化合价=其最外层电子数=族序数
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】第四周期中某些元素的相关化合物在化工、医药、材料等领域有着广泛应用.
(1)现代化学中,常利用_____ 上的特征谱线来鉴定元素.Ga的外围电子排布图为___________ ,基态Ga原子核外有_____ 种运动状态不同的电子.
(2)锗、砷、硒、溴的第一电离能由大到小的顺序为___________ (用元素符号表示),其中锗的化合物四氯化锗可用作光导纤维掺杂剂,其熔点为﹣49.5℃,沸点为83.1℃,则其晶体类型为_____ ,中心原子的杂化类型为_____ .砷酸的酸性弱于硒酸,从分子结构的角度解释原因____________ .
(3)铁能形成[Fe(Bipy)2C12]ClO4等多种合配物(Bipy结构如图).

①该配合物中心原子的化合价为_____ ,与中心原子形成配位键的原子是_____ .
②与ClO 互为等电子体的一种非极性分子是
互为等电子体的一种非极性分子是________ (写一种).
③1mol Bipy中所含σ键_____ mol.
④1mol该配合物最多消耗__________ mol硝酸银溶液(已知AgClO4易溶于水).
(1)现代化学中,常利用
(2)锗、砷、硒、溴的第一电离能由大到小的顺序为
(3)铁能形成[Fe(Bipy)2C12]ClO4等多种合配物(Bipy结构如图).

①该配合物中心原子的化合价为
②与ClO
 互为等电子体的一种非极性分子是
互为等电子体的一种非极性分子是③1mol Bipy中所含σ键
④1mol该配合物最多消耗
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】碳、氮、氧元素的单质或化合物在很多领域有着广泛的应用。回答下列问题:
(1) 、
、 、
、 的键角由大到小的顺序是
的键角由大到小的顺序是______ 。
(2)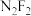 (二氟氮烯)分子中,氮原子的杂化类型为
(二氟氮烯)分子中,氮原子的杂化类型为 ,则
,则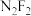 的结构式为
的结构式为______ 。
(3)甲醇的沸点(64.7℃)介于水和甲硫醇(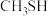 ,7.6℃)之间,原因是
,7.6℃)之间,原因是____________ 。
(4)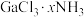 (x=3,4,5,6)是一系列化合物,向含1mol
(x=3,4,5,6)是一系列化合物,向含1mol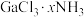 的溶液中加入足量
的溶液中加入足量 溶液,生成的含银物质只有难溶于硝酸的白色沉淀;过滤后,充分加热滤液,有4mol氨气逸出,且又有上述沉淀生成,两次沉淀的物质的量之比为1∶2。
溶液,生成的含银物质只有难溶于硝酸的白色沉淀;过滤后,充分加热滤液,有4mol氨气逸出,且又有上述沉淀生成,两次沉淀的物质的量之比为1∶2。
①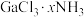 含有的化学键类型有
含有的化学键类型有______ (填标号)。
A.极性共价键 B.离子键 C.配位键 D.金属键 E.氢键
②能准确表示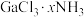 结构的化学式为
结构的化学式为______ 。
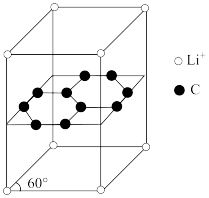
(5)锂电池负极材料晶体为 嵌入两层石墨层中导致石墨堆积方式发生改变,上下层一样,形成如图所示的晶胞结构。晶胞中锂离子和碳原子的个数之比为
嵌入两层石墨层中导致石墨堆积方式发生改变,上下层一样,形成如图所示的晶胞结构。晶胞中锂离子和碳原子的个数之比为______ ;其中与一个 距离最近且相等的C原子数为
距离最近且相等的C原子数为______ 。
(1)
 、
、 、
、 的键角由大到小的顺序是
的键角由大到小的顺序是(2)
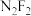 (二氟氮烯)分子中,氮原子的杂化类型为
(二氟氮烯)分子中,氮原子的杂化类型为 ,则
,则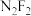 的结构式为
的结构式为(3)甲醇的沸点(64.7℃)介于水和甲硫醇(
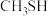 ,7.6℃)之间,原因是
,7.6℃)之间,原因是(4)
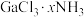 (x=3,4,5,6)是一系列化合物,向含1mol
(x=3,4,5,6)是一系列化合物,向含1mol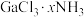 的溶液中加入足量
的溶液中加入足量 溶液,生成的含银物质只有难溶于硝酸的白色沉淀;过滤后,充分加热滤液,有4mol氨气逸出,且又有上述沉淀生成,两次沉淀的物质的量之比为1∶2。
溶液,生成的含银物质只有难溶于硝酸的白色沉淀;过滤后,充分加热滤液,有4mol氨气逸出,且又有上述沉淀生成,两次沉淀的物质的量之比为1∶2。①
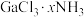 含有的化学键类型有
含有的化学键类型有A.极性共价键 B.离子键 C.配位键 D.金属键 E.氢键
②能准确表示
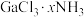 结构的化学式为
结构的化学式为(5)锂电池负极材料晶体为
 嵌入两层石墨层中导致石墨堆积方式发生改变,上下层一样,形成如图所示的晶胞结构。晶胞中锂离子和碳原子的个数之比为
嵌入两层石墨层中导致石墨堆积方式发生改变,上下层一样,形成如图所示的晶胞结构。晶胞中锂离子和碳原子的个数之比为 距离最近且相等的C原子数为
距离最近且相等的C原子数为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】铝和硅在地壳中含量丰富,其单质和化合物具有广泛的应用价值。请回答下列问题:
(1)①基态Si原子的价电子排布式为___________ 。
②Si所在周期中的非金属元素(稀有气体除外),其第一电离能由小到大的顺序为___________ 。
③写出一种与SiCl4互为等电子体的离子的化学式___________ 。
(2)AlCl3的相对分子质量为133.5,178℃开始升华,易溶于水、四氯化碳等,熔融时生成可挥发的二聚物(Al2Cl6),结构如图所示:

①二聚物中Al原子的杂化轨道类型为___________ 。
②从键的形成角度分析1键和2键的区别:___________ 。
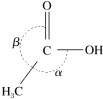
(3)LiAlH4是一种特殊的还原剂,可将羧酸直接还原成醇。
CH3COOH CH3CH2OH
CH3CH2OH
①AlH 的VSEPR模型名称是
的VSEPR模型名称是___________ 。
②CH3COOH分子中π键和σ键的数目之比为___________ ,分子中键角α___________ (填“>”、“=”或“<”)键角β。
(4)铝和氮可形成一种具有四面体结构单元的高温结构陶瓷,其晶胞如图所示:
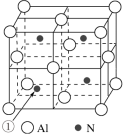
①晶胞中Al的配位数是___________ ,若该晶胞的边长为a nm,则该晶体的密度为___________ g·cm-3.(用NA表示阿伏加德罗常数的值)
②晶胞中的原子可用x、y、z组成的三数组来表达它在晶胞中的位置,该数组称为该原子的原子坐标,如晶胞中N原子①的原子坐标为( ,
, ,
, ),试写出晶胞中Al原子的原子坐标
),试写出晶胞中Al原子的原子坐标___________ (任填一个位置)
(1)①基态Si原子的价电子排布式为
②Si所在周期中的非金属元素(稀有气体除外),其第一电离能由小到大的顺序为
③写出一种与SiCl4互为等电子体的离子的化学式
(2)AlCl3的相对分子质量为133.5,178℃开始升华,易溶于水、四氯化碳等,熔融时生成可挥发的二聚物(Al2Cl6),结构如图所示:

①二聚物中Al原子的杂化轨道类型为
②从键的形成角度分析1键和2键的区别:
(3)LiAlH4是一种特殊的还原剂,可将羧酸直接还原成醇。
CH3COOH
 CH3CH2OH
CH3CH2OH①AlH
 的VSEPR模型名称是
的VSEPR模型名称是②CH3COOH分子中π键和σ键的数目之比为

(4)铝和氮可形成一种具有四面体结构单元的高温结构陶瓷,其晶胞如图所示:


①晶胞中Al的配位数是
②晶胞中的原子可用x、y、z组成的三数组来表达它在晶胞中的位置,该数组称为该原子的原子坐标,如晶胞中N原子①的原子坐标为(
 ,
, ,
, ),试写出晶胞中Al原子的原子坐标
),试写出晶胞中Al原子的原子坐标
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】氮及其化合物与人类生产、生活息息相关。回答下列问题:
(1)固氮酶有铁蛋白和钒铁蛋白两种,它们不仅能够催化N2还原成NH3,还能将乙炔催化还原成乙烯。
①基态Fe3+的核外电子排布式为___________ ,钒元素在周期表中位置是___________ 。
②C、N、O三种元素第一电离能从大到小的顺序是___________ 。
③下列说法正确的有___________ (不定项选择)。
A.C2H2、C2H4都是非极性分子
B.碳负离子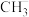 呈三角锥形
呈三角锥形
C.NO+电子式为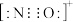
D.NH3沸点比N2高,主要是因为前者是极性分子
(2) NH3和CH4键角较小的是___________ 。
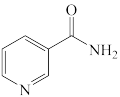
(3)烟酰胺是一种含氮有机物,结构简式如图所示,烟酰胺分子中氮原子的杂化轨道类型有___________ ,1mol该分子中含σ键的数目为___________ 。
(1)固氮酶有铁蛋白和钒铁蛋白两种,它们不仅能够催化N2还原成NH3,还能将乙炔催化还原成乙烯。
①基态Fe3+的核外电子排布式为
②C、N、O三种元素第一电离能从大到小的顺序是
③下列说法正确的有
A.C2H2、C2H4都是非极性分子
B.碳负离子
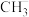 呈三角锥形
呈三角锥形C.NO+电子式为
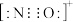
D.NH3沸点比N2高,主要是因为前者是极性分子
(2) NH3和CH4键角较小的是
(3)烟酰胺是一种含氮有机物,结构简式如图所示,烟酰胺分子中氮原子的杂化轨道类型有

您最近一年使用:0次



