题型:解答题-结构与性质
难度:0.4
引用次数:363
题号:10392054
青铜是人类历史上一项重大发明,它是铜(Cu)、锡(Sn) 和铅(Pb) 的合金,也是金属冶铸史上最早的合金 。 请回答 :
(1)基态Cu原子通过失去_____ 轨道电子转化为Cu+;Sn的原子序数为50,基态Sn原子的价层电子排布式为______ 。
(2)红氨酸(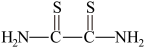 ) 可用于鉴别 Cu2+。红氨酸分子中C 原子的价层电子对数目为
) 可用于鉴别 Cu2+。红氨酸分子中C 原子的价层电子对数目为___ ; N原子的杂化方式为___ ; N原子与 H原子形成共价键的电子云对称形式为___ 。
(3)CuCl的盐酸溶液能吸收CO, 该反应可用于测定气体混合物中CO的含量,生成物M的结构如下图所示。
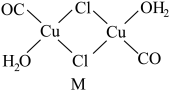
①与CO互为等电子体的离子为_________ (任写一种即可)。
②M中所有元素的电负性由大到小的顺序为____________ 。
③画图表示出M 中Cu原子形成的所有配位键_________ 。
(4)金属钙和铜的晶体结构相似,但铜的熔点比钙高,试分析其原因为___________ 。
(5)铜晶体中,Cu 原子之间会形成不同类型的空隙,比如下图铜晶胞中铜原子a1、a2、a3、a4围成一个正四面体空隙 ,a2、a3、a4、a5、a6、a7围成一个正八面体空隙。
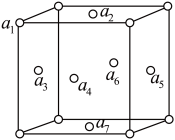
①铜晶体中,铜原子数:正四面体空隙数:正八面体空隙数=____ 。
②若a2 与a3 的核间距离为d pm, 阿伏加 德罗常数的值为NA,则铜晶体的密度为___ g•cm-3( 列出计算表达式)。
(1)基态Cu原子通过失去
(2)红氨酸(
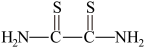 ) 可用于鉴别 Cu2+。红氨酸分子中C 原子的价层电子对数目为
) 可用于鉴别 Cu2+。红氨酸分子中C 原子的价层电子对数目为(3)CuCl的盐酸溶液能吸收CO, 该反应可用于测定气体混合物中CO的含量,生成物M的结构如下图所示。

①与CO互为等电子体的离子为
②M中所有元素的电负性由大到小的顺序为
③画图表示出M 中Cu原子形成的所有配位键
(4)金属钙和铜的晶体结构相似,但铜的熔点比钙高,试分析其原因为
(5)铜晶体中,Cu 原子之间会形成不同类型的空隙,比如下图铜晶胞中铜原子a1、a2、a3、a4围成一个正四面体空隙 ,a2、a3、a4、a5、a6、a7围成一个正八面体空隙。

①铜晶体中,铜原子数:正四面体空隙数:正八面体空隙数=
②若a2 与a3 的核间距离为d pm, 阿伏加 德罗常数的值为NA,则铜晶体的密度为
更新时间:2020/06/13 22:54:11
|
相似题推荐
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐1】A、B、C、D、E是元素周期表中五种短周期元素,原子序数依次增大。A、B、C、D位于同一周期。已知A原子核外有3个能级,且每个能级上的容纳的电子数目相同。C与E同主族,且C的单质为空气中的主要成份。X元素的原子核外有26个运动状态完全不相同的电子。回答下列问题:
(1)C、D、E中第一电离能最大的是___________ (填元素符号)。
(2)B的气态氢化物分子呈___________ 形,该分子的中心原子的杂化方式为___________ 。
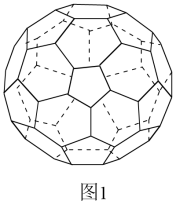
(3)A的一种单质相对分子质量为720,分子构型为如图1所示一个32面体,其中有12个五元环,20个六元环,则1molA的这种单质中π键的数目为___________ 。___________ ,如果X的原子半径为acm,阿伏加德罗常数的值为NA,则计算此单质的密度表达式为___________ g/cm3(不必化简)。
(1)C、D、E中第一电离能最大的是
(2)B的气态氢化物分子呈
(3)A的一种单质相对分子质量为720,分子构型为如图1所示一个32面体,其中有12个五元环,20个六元环,则1molA的这种单质中π键的数目为
您最近一年使用:0次
【推荐2】2022年2月我国科学家在《科学》杂志发表反型钙钛矿太阳能电池研究方面的最新科研成果论文,为钙钛矿电池研究开辟新方向。
(1)基态钛原子的px原子轨道上的电子数为____ 个。与钛同周期的第ⅡB族和ⅢA族两种元素中第一电离能较大的是____ (写元素符号)。
(2)Ti的配合物有多种。Ti(CO)6、Ti(H2O) 、TiF
、TiF 的配体所含原子中电负性由大到小的顺序是
的配体所含原子中电负性由大到小的顺序是____ (写元素符号);Ti(H2O) 中∠H—O—H
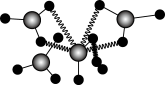
中∠H—O—H____ (填“大于”、“小于”或“等于”)单个水分子中∠H—O—H;Ti(NO3)4的球棍结构如图,Ti的配位数是____ ,N原子的杂化方式为____ 。
(3)反型钙钛矿电池无需使用具有光催化活性的TiO2(通过氮掺杂生成TiO2-aNb,反应如图)以及掺杂的有机空穴传输层,光照下的输出稳定性更好,更具发展潜力。

则TiO2-aNb晶体中a=____ 。已知原子1、2的分数坐标为(0,0, )和(1,0,0),则原子3的坐标分别为
)和(1,0,0),则原子3的坐标分别为____ ,设阿伏加德罗常数的值为NA,TiO2的密度为____ g·cm-3(列出计算式)
(1)基态钛原子的px原子轨道上的电子数为
(2)Ti的配合物有多种。Ti(CO)6、Ti(H2O)
 、TiF
、TiF 的配体所含原子中电负性由大到小的顺序是
的配体所含原子中电负性由大到小的顺序是 中∠H—O—H
中∠H—O—H
(3)反型钙钛矿电池无需使用具有光催化活性的TiO2(通过氮掺杂生成TiO2-aNb,反应如图)以及掺杂的有机空穴传输层,光照下的输出稳定性更好,更具发展潜力。

则TiO2-aNb晶体中a=
 )和(1,0,0),则原子3的坐标分别为
)和(1,0,0),则原子3的坐标分别为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】钛(Ti)和锆(Zr)是同一副族的相邻元素,它们的化合物在生产、生活中有着广泛的用途。
回答下列问题:
(1)钛和锆的价层电子结构相同,基态锆原子的价电子排布式为___________ ;与钛同周期元素的基态原子中,未成对电子数与钛相同的元素有___________ 种。
(2)Ti(BH4)2是一种储氢材料。BH 的空间构型是
的空间构型是___________ ,H、B、Ti的电负性由小到大的顺序为___________ 。
(3)ZrCl4可以与乙二胺形成配合物[ ZrCl4( H2NCH2CH2NH2)]。
①1 mol [ ZrCl4( H2NCH2CH2NH2)]中含有σ键的物质的量为___________ mol。
②H2NCH2CH2NH2形成[ ZrCl4( H2NCH2CH2NH2)]后,H-N-H键角将___________ (填“变大”、“变小”或“不变”),原因是___________ 。
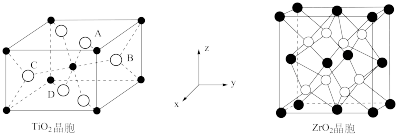
(4)已知TiO2晶胞中Ti4+位于O2-所构成的正八面体的体心,ZrO2晶胞中Zr4+位于O2-所构成的立方体的体心,其晶胞结构如下图所示。_________________ 。
②TiO2晶胞中A、B的原子坐标为(0.69,0.69,1),(0.19,0.81,0.5),则C、D原子坐标为___________ 、___________ 。
③已知二氧化锆晶胞的密度为ρ g·cm-3,则晶体中Zr原子和O原子之间的最短距离___________ pm(列出表达式,NA为阿伏加德罗常数的值,ZrO2的摩尔质量为M g/mol)。
回答下列问题:
(1)钛和锆的价层电子结构相同,基态锆原子的价电子排布式为
(2)Ti(BH4)2是一种储氢材料。BH
 的空间构型是
的空间构型是(3)ZrCl4可以与乙二胺形成配合物[ ZrCl4( H2NCH2CH2NH2)]。
①1 mol [ ZrCl4( H2NCH2CH2NH2)]中含有σ键的物质的量为
②H2NCH2CH2NH2形成[ ZrCl4( H2NCH2CH2NH2)]后,H-N-H键角将
(4)已知TiO2晶胞中Ti4+位于O2-所构成的正八面体的体心,ZrO2晶胞中Zr4+位于O2-所构成的立方体的体心,其晶胞结构如下图所示。
②TiO2晶胞中A、B的原子坐标为(0.69,0.69,1),(0.19,0.81,0.5),则C、D原子坐标为
③已知二氧化锆晶胞的密度为ρ g·cm-3,则晶体中Zr原子和O原子之间的最短距离
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】硅铁合金广泛应用于冶金工业,可用于铸铁时的脱氧剂、添加剂等,回答下列问题:
(1)基态Si原子电子占据最高能级的电子云轮廓图为___________ 形。
(2)已知氢的电负性为2.1,硅的电负性为1.8,SiH4分子中氢元素的化合价为___________ 。
(3)SiCl4分子的中心原子的价层电子对数为___________ ,分子的立体构型为___________ ;四卤化硅的沸点如下,分析其变化规律___________ ,并解释原因___________ 。
(4)[Fe(H2O)6]2+可与乙二胺(H2NCH2CH2NH2,简写为en)发生如下反应:[Fe(H2O)6]2++en=[Fe(H2O)4(en)]2++2H2O,[Fe(H2O)6]2+的中心离子的配位数为___________ ;[Fe(H2O)4(en)]2+的配位原子为___________ 。
(5)已知MgO具有NaCl型晶体结构,其结构如图所示,则每个Mg2+周围距离最近的Mg2+个数为___________ 。已知MgO晶胞边长为0.4nm,则MgO的密度为___________  (写出计算结果,保留小数点后一位,NA用
(写出计算结果,保留小数点后一位,NA用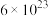 进行计算)。
进行计算)。
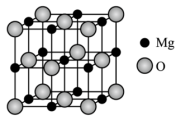
(1)基态Si原子电子占据最高能级的电子云轮廓图为
(2)已知氢的电负性为2.1,硅的电负性为1.8,SiH4分子中氢元素的化合价为
(3)SiCl4分子的中心原子的价层电子对数为
| SiF4 | SiCl4 | SiBr4 | SiI4 | |
| 沸点/K | 187.4 | 330.1 | 408 | 460.6 |
(5)已知MgO具有NaCl型晶体结构,其结构如图所示,则每个Mg2+周围距离最近的Mg2+个数为
 (写出计算结果,保留小数点后一位,NA用
(写出计算结果,保留小数点后一位,NA用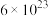 进行计算)。
进行计算)。
您最近一年使用:0次
解答题-有机推断题
|
较难
(0.4)
名校
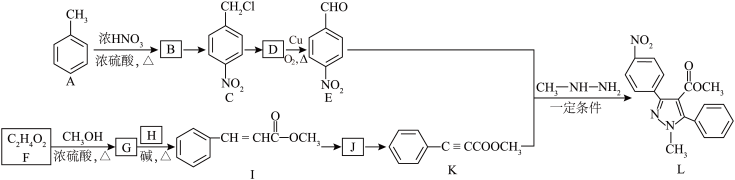
【推荐2】吡唑类化合物是重要的医药中间体,如图是吡唑类物质L的一种合成路线: R1-CH=N-R2
R1-CH=N-R2
回答下列问题:
(1)D的化学名称是___________ ; E中的含氧官能团名称为___________ 。
(2)G→I反应的化学方程式为___________ 。
(3)J→K的反应类型是___________ 。
(4)关于上述合成路线的相关物质及转化,下列说法错误的有___________。
(5)对于化合物I,分析预测其可能的化学性质,完成下表。
(6)参照上述合成路线,以乙酸和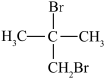 为原料,设计合成
为原料,设计合成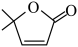 的路线
的路线___________ (无机试剂任选,准确写出反应条件)。
已知:①R1-CHO+R2CH2COOR3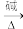
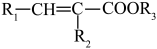
 R1-CH=N-R2
R1-CH=N-R2回答下列问题:
(1)D的化学名称是
(2)G→I反应的化学方程式为
(3)J→K的反应类型是
(4)关于上述合成路线的相关物质及转化,下列说法错误的有___________。
| A.由化合物D到E的转化中,有π键的形成 |
| B.由化合物E和K到L的转化中,存在C原子杂化方式的改变 |
| C.化合物K所有原子共平面 |
| D.lmol化合物CH3-NH-NH2最多能与1mol质子(H+)形成配位键 |
(5)对于化合物I,分析预测其可能的化学性质,完成下表。
| 序号 | 反应试剂、条件 | 反应形成的新有机物 (写出完整的有机物) | 反应类型 |
| ① | (a) | (b) | 取代反应 |
| ② | H2、催化剂、加热 | (c) | 加成反应 |
(6)参照上述合成路线,以乙酸和
 为原料,设计合成
为原料,设计合成 的路线
的路线
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】氨是重要的化工原料,用途广泛。
(1)合成氨工厂常用醋酸二氨合铜(由[Cu(NH3)2]+ 和CH3COO-构成)溶液吸收对氨合成催化剂有毒害的CO气体。
①醋酸二氨合铜所含的元素中,第一电离能最大的是____________ 。
②醋酸二氨合铜所含元素的单质,所属的晶体类型有________ (填序号)。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
③第4周期中,基态原子与基态Cu原子未成对电子数目相同的元素有____ 种(不含Cu)。
④铜单质为面心立方晶体,其晶胞边长a nm。列式表示铜单质的密度_____ g·cm-3。
(2)BF3气体与NH3相遇立即生成一种白色晶体:BF3+NH3=F3B—NH3。
①晶体F3B—NH3中,B原子的杂化轨道类型为______________ 。
②写出两种与BF3具有相同空间构型的阴离子_____________ 。
(3)NH3可用于合成尿素、硫酸铵等氮肥。某化肥厂从生产的硫酸铵中检出一种组成为N4H4(SO4)2的物质。该物质在水溶液中以SO42-和N4H44+两种正四面体构型的离子存在。N4H44+遇碱生成一种形似白磷的N4分子。
①下列相关说法中,正确的是_____________ (填序号)。
a.N4是N2的同分异构体
b.1 mol N4分解生成N2,形成了4 molπ键
c.白磷的沸点比N4高,是因为P—P键键能比N—N键大
d.白磷的化学性质比N2活泼,说明P的非金属性比N强
②画出N4H44+的结构(标明其中的配位键)___________ 。
(1)合成氨工厂常用醋酸二氨合铜(由[Cu(NH3)2]+ 和CH3COO-构成)溶液吸收对氨合成催化剂有毒害的CO气体。
①醋酸二氨合铜所含的元素中,第一电离能最大的是
②醋酸二氨合铜所含元素的单质,所属的晶体类型有
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
③第4周期中,基态原子与基态Cu原子未成对电子数目相同的元素有
④铜单质为面心立方晶体,其晶胞边长a nm。列式表示铜单质的密度
(2)BF3气体与NH3相遇立即生成一种白色晶体:BF3+NH3=F3B—NH3。
①晶体F3B—NH3中,B原子的杂化轨道类型为
②写出两种与BF3具有相同空间构型的阴离子
(3)NH3可用于合成尿素、硫酸铵等氮肥。某化肥厂从生产的硫酸铵中检出一种组成为N4H4(SO4)2的物质。该物质在水溶液中以SO42-和N4H44+两种正四面体构型的离子存在。N4H44+遇碱生成一种形似白磷的N4分子。
①下列相关说法中,正确的是
a.N4是N2的同分异构体
b.1 mol N4分解生成N2,形成了4 molπ键
c.白磷的沸点比N4高,是因为P—P键键能比N—N键大
d.白磷的化学性质比N2活泼,说明P的非金属性比N强
②画出N4H44+的结构(标明其中的配位键)
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】大力推广锂电池新能源汽车对实现“碳达峰”和“碳中和”具有重要意义。 与
与 都是锂离子电池的电极材料,可利用钛铁矿(主要成分为
都是锂离子电池的电极材料,可利用钛铁矿(主要成分为 ,还有少量
,还有少量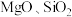 等杂质)来制备,工艺流程如下:
等杂质)来制备,工艺流程如下:
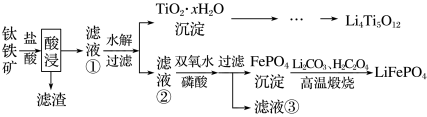
已知:“酸浸”后,钛主要以 形式存在。
形式存在。
回答下列问题:
(1)滤渣的主要成分是______ 。
(2)写出由 经水解制备
经水解制备 的离子方程式
的离子方程式______ 。
(3)在制备 的过程中会生成
的过程中会生成 (
( 为+4价),则
为+4价),则 中过氧键的数目为
中过氧键的数目为______ 。
(4)滤液②加双氧水的目的是______ 。
(5)写出制备 的化学方程式
的化学方程式______ 。
(6) 的晶胞结构示意图如(a)所示,晶胞参数为
的晶胞结构示意图如(a)所示,晶胞参数为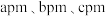 。其中
。其中 围绕
围绕 和
和 分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。电池充电时,
分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。电池充电时, [图(a)]脱出部分
[图(a)]脱出部分 ,转化为
,转化为 [图(b)],最终转化为
[图(b)],最终转化为 [图(c)]。则
[图(c)]。则 的晶胞密度为
的晶胞密度为______  ,充电过程
,充电过程 转化为转化为
转化为转化为 的电极反应式
的电极反应式______ 。

 与
与 都是锂离子电池的电极材料,可利用钛铁矿(主要成分为
都是锂离子电池的电极材料,可利用钛铁矿(主要成分为 ,还有少量
,还有少量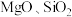 等杂质)来制备,工艺流程如下:
等杂质)来制备,工艺流程如下:
已知:“酸浸”后,钛主要以
 形式存在。
形式存在。回答下列问题:
(1)滤渣的主要成分是
(2)写出由
 经水解制备
经水解制备 的离子方程式
的离子方程式(3)在制备
 的过程中会生成
的过程中会生成 (
( 为+4价),则
为+4价),则 中过氧键的数目为
中过氧键的数目为(4)滤液②加双氧水的目的是
(5)写出制备
 的化学方程式
的化学方程式(6)
 的晶胞结构示意图如(a)所示,晶胞参数为
的晶胞结构示意图如(a)所示,晶胞参数为 。其中
。其中 围绕
围绕 和
和 分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。电池充电时,
分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。电池充电时, [图(a)]脱出部分
[图(a)]脱出部分 ,转化为
,转化为 [图(b)],最终转化为
[图(b)],最终转化为 [图(c)]。则
[图(c)]。则 的晶胞密度为
的晶胞密度为 ,充电过程
,充电过程 转化为转化为
转化为转化为 的电极反应式
的电极反应式
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】B、N、Co均为新型材料的重要组成元素。请回答下列问题:
(1)下列状态的氮中,电离最外层一个电子所需能量最大的是_______ (填标号)。
A.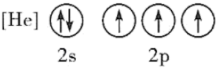 B.
B.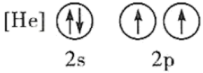
C.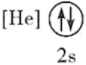 D.
D.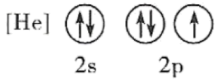
(2) 能形成
能形成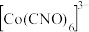 。
。
①该离子中含有 键的数目为
键的数目为_______ 。
②与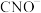 互为等电子体的分子为
互为等电子体的分子为_______ (任写一种,填化学式)。
(3)往 溶液中加入过量氨水,可生成
溶液中加入过量氨水,可生成 配离子,已知
配离子,已知 和
和 的空间构型都是三角锥形,但
的空间构型都是三角锥形,但 不易与
不易与 形成配离子,其原因是
形成配离子,其原因是_______ 。
(4)分子中的大π键可用符号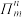 表示,其中m表示形成大π键的原子数,n表示参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m表示形成大π键的原子数,n表示参与形成大π键的电子数(如苯分子中的大π键可表示为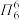 )。则
)。则 中的大π键应表示为
中的大π键应表示为_______ 。
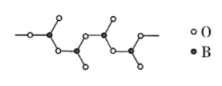
(5)多硼酸根的结构之一为链状如图所示,其化学式为_______ 。
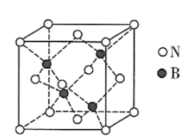
(6)氮化硼晶体有多种结构,其中立方氮化硼具有金刚石的结构如图所示。若晶胞边长为 ,晶胞中B原子位于N原子所形成的正四面体的体心,则
,晶胞中B原子位于N原子所形成的正四面体的体心,则 键的键长为
键的键长为_______  ,这种氮化硼晶体的密度为
,这种氮化硼晶体的密度为_______  (用含有a和
(用含有a和 的代数式表示)。
的代数式表示)。
(1)下列状态的氮中,电离最外层一个电子所需能量最大的是
A.
 B.
B.
C.
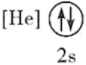 D.
D.
(2)
 能形成
能形成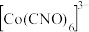 。
。①该离子中含有
 键的数目为
键的数目为②与
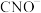 互为等电子体的分子为
互为等电子体的分子为(3)往
 溶液中加入过量氨水,可生成
溶液中加入过量氨水,可生成 配离子,已知
配离子,已知 和
和 的空间构型都是三角锥形,但
的空间构型都是三角锥形,但 不易与
不易与 形成配离子,其原因是
形成配离子,其原因是(4)分子中的大π键可用符号
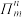 表示,其中m表示形成大π键的原子数,n表示参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m表示形成大π键的原子数,n表示参与形成大π键的电子数(如苯分子中的大π键可表示为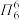 )。则
)。则 中的大π键应表示为
中的大π键应表示为(5)多硼酸根的结构之一为链状如图所示,其化学式为

(6)氮化硼晶体有多种结构,其中立方氮化硼具有金刚石的结构如图所示。若晶胞边长为
 ,晶胞中B原子位于N原子所形成的正四面体的体心,则
,晶胞中B原子位于N原子所形成的正四面体的体心,则 键的键长为
键的键长为 ,这种氮化硼晶体的密度为
,这种氮化硼晶体的密度为 (用含有a和
(用含有a和 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】锰及其化合物用途非常广泛,请回答下列问题:
(1)Mn3+在水溶液中容易歧化为MnO2和Mn2+,下列说法合理的是________
A.Mn3+的价电子构型为3d4,不属于较稳定的电子构型
B.根据Mn2+的电子构型可知,Mn4+中不含成对电子
C.Mn2+易被氧化,可能是因为Mn2+轨道内有大量自旋方向相同的电子
D.Mn2+与Fe3+具有相同的价电子构型,所以它们的化学性质相似
(2)锰的一种配合物的化学式为[ Mn( CO)5( CH3CN)]。配体CH3CN与中心原子形成配位键时,提供孤对电子的原子是_________ 原子(填写元素名称),该分子中碳原子的杂化方式为___________ 。
(3)研究发现,在成甲醇反应(CO2 +3H2=CH3OH +H2O)中,CO氧化物负载的Mn氧化物纳米粒子催化剂具有高活性。反应所涉及的4种物质中,沸点从高到低的顺序为___________ ,原因是________________ ,硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在______ ,NO 的空间构型是
的空间构型是______________ (用文字描述)。
(4)某锰氧化物的晶胞结构如图所示,该锰氧化物的化学式为___________ ,该晶体中Mn的配位数是_______ ,该晶体中Mn之间的最近距离为_____ cm(用含a、b的代数式表示)。
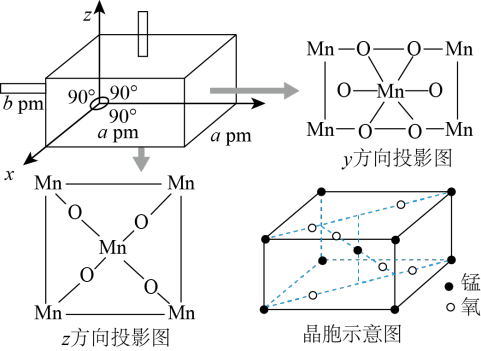
(1)Mn3+在水溶液中容易歧化为MnO2和Mn2+,下列说法合理的是
A.Mn3+的价电子构型为3d4,不属于较稳定的电子构型
B.根据Mn2+的电子构型可知,Mn4+中不含成对电子
C.Mn2+易被氧化,可能是因为Mn2+轨道内有大量自旋方向相同的电子
D.Mn2+与Fe3+具有相同的价电子构型,所以它们的化学性质相似
(2)锰的一种配合物的化学式为[ Mn( CO)5( CH3CN)]。配体CH3CN与中心原子形成配位键时,提供孤对电子的原子是
(3)研究发现,在成甲醇反应(CO2 +3H2=CH3OH +H2O)中,CO氧化物负载的Mn氧化物纳米粒子催化剂具有高活性。反应所涉及的4种物质中,沸点从高到低的顺序为
 的空间构型是
的空间构型是(4)某锰氧化物的晶胞结构如图所示,该锰氧化物的化学式为

您最近一年使用:0次



