高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
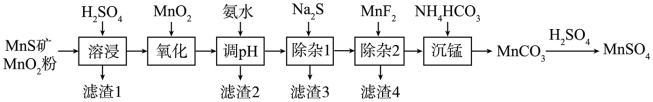
相关金属离子[c0(Mn+)=0.1 mol·L−1]形成氢氧化物沉淀的 pH 范围如下:
(1)“溶浸”中二氧化锰与硫化锰可以发生氧化还原反应,推测“滤渣1”含有___________ 和SiO2;
(2)“调pH”除铁和铝,溶液的pH范围应调节范围是________________ 之间。
(3)“除杂1”的目的是除去Zn2+和Ni2+,写出除Zn2+的方程式:__________________ 。
(4)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高对沉淀Mg2+完全的影响是__________________ (有利、不利、无影响)。
(5)在溶浸前,先把矿石研磨成粉末的原因:_______________________ 。

相关金属离子[c0(Mn+)=0.1 mol·L−1]形成氢氧化物沉淀的 pH 范围如下:
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
| 开始沉淀的 pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的 pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“溶浸”中二氧化锰与硫化锰可以发生氧化还原反应,推测“滤渣1”含有
(2)“调pH”除铁和铝,溶液的pH范围应调节范围是
(3)“除杂1”的目的是除去Zn2+和Ni2+,写出除Zn2+的方程式:
(4)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高对沉淀Mg2+完全的影响是
(5)在溶浸前,先把矿石研磨成粉末的原因:
19-20高二下·北京海淀·期末 查看更多[3]
河北省石家庄市第四中学2022-2023学年高三上学期十月月考化学试题(已下线)第三单元 金属及其化合物测试题-2021年高考化学一轮复习名师精讲练北京市海淀区十九中2019-2020学年高二下学期期末考试化学试题
更新时间:2020-07-03 15:18:28
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
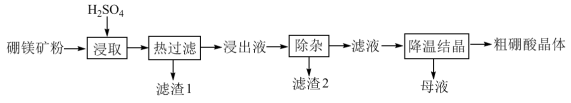
【推荐1】硼酸( )在食品、医药领域应用广泛,以硼铁矿(含
)在食品、医药领域应用广泛,以硼铁矿(含 、
、 及少量
及少量 、
、 )为原料生产硼酸的工艺流程如下:
)为原料生产硼酸的工艺流程如下:
已知: 在
在 、
、 、
、 、
、 时的溶解度依次为
时的溶解度依次为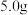 、
、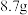 、
、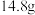 、
、 。
。 、
、 、
、 和
和 以氢氧化物形式完全沉淀时,溶液的
以氢氧化物形式完全沉淀时,溶液的 分别为3.2、4.7、9.0和12.4。
分别为3.2、4.7、9.0和12.4。
(1)写出 与硫酸反应的化学方程式
与硫酸反应的化学方程式____________ 。“浸取”后,采用“热过滤”的目的是__________ 。
(2)滤渣1的主要成分是____________ 。为检验浸出液中是否含有 ,可选用的化学试剂是
,可选用的化学试剂是_________ 。
(3)“除杂”时先向浸出液中加入适量 ,然后调节溶液的
,然后调节溶液的 约为5。
约为5。 的作用是
的作用是____________ (用离子方程式表示),“除杂”除去的杂质离子是__________ 。
(4)根据 在水溶液中的电离反应:
在水溶液中的电离反应: ,写出硼酸与过量
,写出硼酸与过量 溶液反应的离子方程式
溶液反应的离子方程式___________ 。
(5)“粗硼酸晶体”中的主要杂质是_________ 。
(6)以硼酸为原料可以制得 ,其电子式为
,其电子式为__________ 。
 )在食品、医药领域应用广泛,以硼铁矿(含
)在食品、医药领域应用广泛,以硼铁矿(含 、
、 及少量
及少量 、
、 )为原料生产硼酸的工艺流程如下:
)为原料生产硼酸的工艺流程如下:
已知:
 在
在 、
、 、
、 、
、 时的溶解度依次为
时的溶解度依次为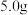 、
、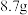 、
、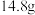 、
、 。
。 、
、 、
、 和
和 以氢氧化物形式完全沉淀时,溶液的
以氢氧化物形式完全沉淀时,溶液的 分别为3.2、4.7、9.0和12.4。
分别为3.2、4.7、9.0和12.4。(1)写出
 与硫酸反应的化学方程式
与硫酸反应的化学方程式(2)滤渣1的主要成分是
 ,可选用的化学试剂是
,可选用的化学试剂是(3)“除杂”时先向浸出液中加入适量
 ,然后调节溶液的
,然后调节溶液的 约为5。
约为5。 的作用是
的作用是(4)根据
 在水溶液中的电离反应:
在水溶液中的电离反应: ,写出硼酸与过量
,写出硼酸与过量 溶液反应的离子方程式
溶液反应的离子方程式(5)“粗硼酸晶体”中的主要杂质是
(6)以硼酸为原料可以制得
 ,其电子式为
,其电子式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】某课外小组研究铝土矿中 的含量。已知铝土矿的主要成分是
的含量。已知铝土矿的主要成分是 ,杂质是
,杂质是 、
、 等。从铝土矿中提取
等。从铝土矿中提取 的过程如下:
的过程如下:
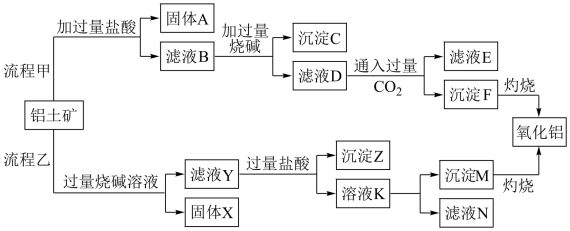
(1)图中涉及分离溶液与沉淀的实验方法是___________ (填操作名称)。
(2)固体 是
是__________ 、
__________ (填化学式)。
(3)固体 的主要用途有(写出1条即可)
的主要用途有(写出1条即可)______________________________ 。
(4)流程甲中加入盐酸后生成 的离子方程式为
的离子方程式为______________________________ 。
(5)流程乙中,向铝土矿中加入过量烧碱溶液后,发生反应的离子方程式是__________ 、__________ 。
(6)溶液 中通入过量
中通入过量 生成沉淀
生成沉淀 的离子方程式为
的离子方程式为_____________________ 。
(7)由溶液 生成沉淀
生成沉淀 的离子方程式是
的离子方程式是______________________________ 。
(8)流程乙中,将实验过程中所得固体精确称量,发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中 的质量分数是
的质量分数是__________ 。(保留一位小数)
 的含量。已知铝土矿的主要成分是
的含量。已知铝土矿的主要成分是 ,杂质是
,杂质是 、
、 等。从铝土矿中提取
等。从铝土矿中提取 的过程如下:
的过程如下:
(1)图中涉及分离溶液与沉淀的实验方法是
(2)固体
 是
是
(3)固体
 的主要用途有(写出1条即可)
的主要用途有(写出1条即可)(4)流程甲中加入盐酸后生成
 的离子方程式为
的离子方程式为(5)流程乙中,向铝土矿中加入过量烧碱溶液后,发生反应的离子方程式是
(6)溶液
 中通入过量
中通入过量 生成沉淀
生成沉淀 的离子方程式为
的离子方程式为(7)由溶液
 生成沉淀
生成沉淀 的离子方程式是
的离子方程式是(8)流程乙中,将实验过程中所得固体精确称量,发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中
 的质量分数是
的质量分数是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】金属及其化合物在工农业生产、生活中具有广泛应用。
(1)工业上常用铝土矿(含SiO2等杂质)生产铝。从Na2SiO3和NaAlO2混合溶液中制得Al(OH)3,需要从下列试剂中选择两种,选用的试剂组合最好是__ 。
a.NaOH溶液 b.氨水 c.CO2 d.盐酸
(2)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有__ 。
a.KCl b.KClO3 c.MnO2 d.Mg
(3)某CuSO4溶液中混有少量FeSO4和Fe(SO4)3杂质。
①为了除去杂质,通常是加入H2O2再调节溶液pH,其中加入H2O2的作用是__ ,与其他试剂相比,使用H2O2的优点是__ (答出两点即可)。
②除去杂质、过滤后,由滤液获得CuSO4·5H2O晶体的操作步骤依次是__ 。
(4)滴定法测定某胆矾样品中CuSO4含量:取ag试样配成250mL溶液,每次取25.00mL,消除干扰离子后,用cmol/LEDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL。滴定反应为:Cu2++H2Y2-=CuY2-+2H+
①测得CuSO4的质量分数为o=__ (用含a、b.c的代数式表示)。②下列操作会导致CuSO4含量的测定结果偏高的是__ 。
a.锥形瓶中有残留的蒸馏水,未干燥
b.滴定前滴定管尖嘴处有气泡,滴定后消失
c.未除净可与EDTA反应的干扰离子
d.滴定前仰视读数,滴定后俯视读数
(1)工业上常用铝土矿(含SiO2等杂质)生产铝。从Na2SiO3和NaAlO2混合溶液中制得Al(OH)3,需要从下列试剂中选择两种,选用的试剂组合最好是
a.NaOH溶液 b.氨水 c.CO2 d.盐酸
(2)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有
a.KCl b.KClO3 c.MnO2 d.Mg
(3)某CuSO4溶液中混有少量FeSO4和Fe(SO4)3杂质。
①为了除去杂质,通常是加入H2O2再调节溶液pH,其中加入H2O2的作用是
②除去杂质、过滤后,由滤液获得CuSO4·5H2O晶体的操作步骤依次是
(4)滴定法测定某胆矾样品中CuSO4含量:取ag试样配成250mL溶液,每次取25.00mL,消除干扰离子后,用cmol/LEDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL。滴定反应为:Cu2++H2Y2-=CuY2-+2H+
①测得CuSO4的质量分数为o=
a.锥形瓶中有残留的蒸馏水,未干燥
b.滴定前滴定管尖嘴处有气泡,滴定后消失
c.未除净可与EDTA反应的干扰离子
d.滴定前仰视读数,滴定后俯视读数
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
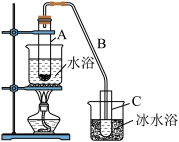
【推荐1】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯。
已知: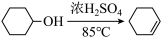 +H2O
+H2O
(1)制备粗品
将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是_______ ,导管B除了导气外还具有的作用是_______________________ 。
②试管C置于冰水浴中的目的是_______________________ 。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_____ 层(填“上”或“下”),分液后用__________ (填编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
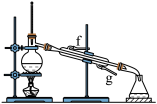
②再将环己烯按下图装置蒸馏,冷却水从_____ 口进入(填“f”或“g”)。蒸馏时要加入生石灰,目的是____________________________________ 。
③收集产品时,控制的温度应在_______ 左右,实验制得的环己烯精品质量低于理论产量,可能的原因是____________ (填字母序号,下同)。
a.蒸馏时从70 ℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是____________ 。
a.用酸性高锰酸钾溶液
b.用金属钠
c.测定沸点

已知:
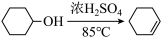 +H2O
+H2O密度(g·cm-3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是
②试管C置于冰水浴中的目的是
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按下图装置蒸馏,冷却水从

③收集产品时,控制的温度应在
a.蒸馏时从70 ℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是
a.用酸性高锰酸钾溶液
b.用金属钠
c.测定沸点
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】粗食盐中除含有钙离子、少量镁离子、硫酸根离子等可溶性杂质外,还含有泥沙等不溶性杂质。我们食用的精盐是用粗盐提纯而得到的。通过教材中“粗盐的提纯”及你做过的该实验完成下列问题:
(1)如何运用最简单的方法检验溶液中有无SO42—________ 。如果有,应该如何除去SO42—__________ 。
(2)在除净SO42—且过滤后的溶液中滴加饱和Na2CO3溶液,直至不再产生沉淀为止。请问这步操作的目的是_________ 。
(3)将经过操作(2)后的溶液过滤。请问这一操作哪些杂质离子不能除净?____________ 。
(1)如何运用最简单的方法检验溶液中有无SO42—
(2)在除净SO42—且过滤后的溶液中滴加饱和Na2CO3溶液,直至不再产生沉淀为止。请问这步操作的目的是
(3)将经过操作(2)后的溶液过滤。请问这一操作哪些杂质离子不能除净?
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】氯化铜、氯化亚铜是重要的化工原料,广泛地用作有机合成催化剂。
I.实验室中以粗铜(含杂质Fe)为原料制备铜的氯化物。现用如图所示的实验仪器及药品来制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹、酒精灯已省略)。按要求回答下列问题:
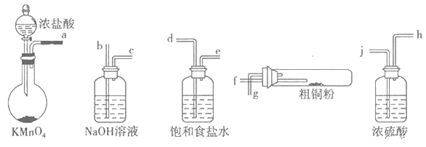
(1)按气流方向连接各仪器接口顺序是:a
______________________________ 。
(2)写出加热时硬质试管中发生化学反应的方程式是______________________________ 。
(3)反应后,盛有NaOH溶液的广口瓶中溶液具有漂白、消毒作用,若用钢铁(含Fe、C)制品盛装该溶液会发生电化腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效。该电化腐蚀过程中正极反应式是_______________________________ 。
II.将上述实验制得的固体产物按如下流程操作,试回答下列问题:
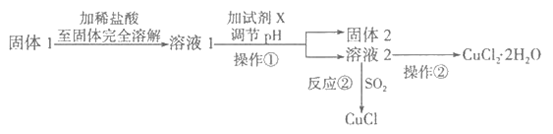
(1)检验溶液2中是否含有杂质离子的试剂是__________________ 。
(2)某同学用实验制得的CuCl2·2H2O晶体配制500mL0.1 mol·L-1的CuCl2溶液,在称量出CuCl2·2H2O晶体后,溶解该晶体的具体操作为_________________________________ ,分析以下操作对配制的溶液浓度造成的影响,影响偏高的是___________________________ 。
①蒸馏水洗完容量瓶后没有烘干 ②转移溶液过程中出现漏液
③砝码生锈 ④定容时俯视
(3)溶液l可加试剂X用于调节pH以除去杂质,X可选用下列试剂中的(填序号)_________ 。
a.NaOH b.NH3·H2O c.CuO d.CuSO4 e.Cu2(OH)2CO3
(4)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀。写出制备CuCl的离子方程式:_________________________________________________________ 。
I.实验室中以粗铜(含杂质Fe)为原料制备铜的氯化物。现用如图所示的实验仪器及药品来制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹、酒精灯已省略)。按要求回答下列问题:

(1)按气流方向连接各仪器接口顺序是:a
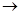
(2)写出加热时硬质试管中发生化学反应的方程式是
(3)反应后,盛有NaOH溶液的广口瓶中溶液具有漂白、消毒作用,若用钢铁(含Fe、C)制品盛装该溶液会发生电化腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效。该电化腐蚀过程中正极反应式是
II.将上述实验制得的固体产物按如下流程操作,试回答下列问题:

(1)检验溶液2中是否含有杂质离子的试剂是
(2)某同学用实验制得的CuCl2·2H2O晶体配制500mL0.1 mol·L-1的CuCl2溶液,在称量出CuCl2·2H2O晶体后,溶解该晶体的具体操作为
①蒸馏水洗完容量瓶后没有烘干 ②转移溶液过程中出现漏液
③砝码生锈 ④定容时俯视
(3)溶液l可加试剂X用于调节pH以除去杂质,X可选用下列试剂中的(填序号)
a.NaOH b.NH3·H2O c.CuO d.CuSO4 e.Cu2(OH)2CO3
(4)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀。写出制备CuCl的离子方程式:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】作为长沙的传统小吃,臭豆腐深受市民喜爱,而用硫酸亚铁着色是长沙臭豆腐制作的传统工艺。在发酵过程中硫酸亚铁发生自然反应,从而使臭豆腐变成黑色,按照国家标准使用并无危害。某化学兴趣小组利用某工业废铁屑制备食品添加剂FeSO4·7H2O,流程图如下:
请回答下列问题:
(1)溶液C中的溶质为___________ (填化学式)。
(2)“酸浸”时需加入试剂的化学式为___________ ,请写出该过程中属于非氧化还原反应的离子方程式:___________ 。
(3)“灼烧”操作选择下列哪一种仪器最合适___________(填字母)。
(4)请设计实验方案检验溶液B中含有Fe2+:___________ 。
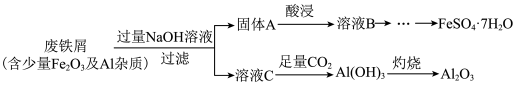
(5)下图为某浓度FeSO4溶液放置在空气中时的色度随时间变化的图象(溶液的颜色越深,色度越大)。其中在第300s时加入了一定量的维生素C溶液。则维生素C使溶液色度下降的原因是___________ 。
(6)该实验需要用到0.5mol/L NaOH溶液240mL,现用固体NaOH进行配制。
①配制时需用托盘天平称量___________ g NaOH固体。
②下列说法正确的是___________ (填字母)。
A.容量瓶经蒸馏水洗涤后,有少量蒸馏水残留,不影响使用
B.容量瓶在实验室中可用于长期存放试剂
C.配制时,NaOH固体溶解后,立即用玻璃棒引流至容量瓶中,然后缓慢加水至刻度线1-2cm处,再滴加蒸馏水至刻度线
D.定容时若俯视刻度线,则会使所配溶液的浓度偏低
E.称取的NaOH固体中若含有Na2O杂质,会导致所配溶液的浓度偏高

请回答下列问题:
(1)溶液C中的溶质为
(2)“酸浸”时需加入试剂的化学式为
(3)“灼烧”操作选择下列哪一种仪器最合适___________(填字母)。
A. | B. | C. | D. |
(4)请设计实验方案检验溶液B中含有Fe2+:
(5)下图为某浓度FeSO4溶液放置在空气中时的色度随时间变化的图象(溶液的颜色越深,色度越大)。其中在第300s时加入了一定量的维生素C溶液。则维生素C使溶液色度下降的原因是

(6)该实验需要用到0.5mol/L NaOH溶液240mL,现用固体NaOH进行配制。
①配制时需用托盘天平称量
②下列说法正确的是
A.容量瓶经蒸馏水洗涤后,有少量蒸馏水残留,不影响使用
B.容量瓶在实验室中可用于长期存放试剂
C.配制时,NaOH固体溶解后,立即用玻璃棒引流至容量瓶中,然后缓慢加水至刻度线1-2cm处,再滴加蒸馏水至刻度线
D.定容时若俯视刻度线,则会使所配溶液的浓度偏低
E.称取的NaOH固体中若含有Na2O杂质,会导致所配溶液的浓度偏高
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】从某矿渣【成分为NiFe2O4(铁酸)、NiO、FeO、CaO、SiO2等】中回收NiSO4的工艺流程如下:
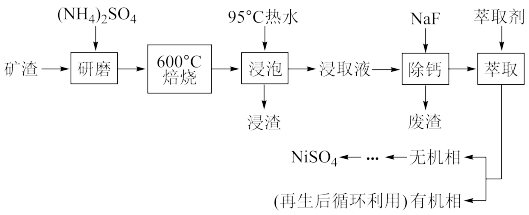
已知(NH4)2SO4在350℃分解生成NH3和H2SO4;NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3。回答下列问题:
(1)矿渣中部分FeO在空气焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为__________
(2)“浸渣”的成分除 Fe2O3,FeO(OH)、CaSO4外还含有_____ (填化学式)。
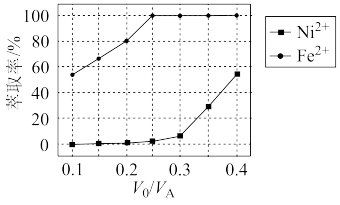
(3)萃取可用于对溶液中的金属离子进行富集与分离: Fe2+(水相)+2RH(有机相) FeR2(有机相)+2H+(水相)萃取剂与溶液的体积比(V0/VA)对溶液中 Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳值为
FeR2(有机相)+2H+(水相)萃取剂与溶液的体积比(V0/VA)对溶液中 Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳值为______ 。在_______ (填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。

已知(NH4)2SO4在350℃分解生成NH3和H2SO4;NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3。回答下列问题:
(1)矿渣中部分FeO在空气焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为
(2)“浸渣”的成分除 Fe2O3,FeO(OH)、CaSO4外还含有
(3)萃取可用于对溶液中的金属离子进行富集与分离: Fe2+(水相)+2RH(有机相)
 FeR2(有机相)+2H+(水相)萃取剂与溶液的体积比(V0/VA)对溶液中 Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳值为
FeR2(有机相)+2H+(水相)萃取剂与溶液的体积比(V0/VA)对溶液中 Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳值为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】碳酸锰(MnCO3)是制造电信器材的软磁铁氧体,也用作脱硫的催化剂,瓷釉、涂料和清漆的颜料。工业上利用软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如下图所示:
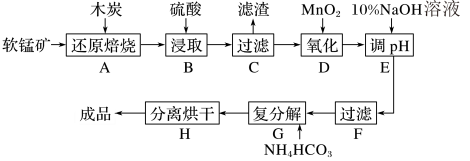
已知:还原焙烧的主反应为2MnO2+C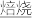 2MnO+CO2↑。
2MnO+CO2↑。
可能用到的数据如下:
根据要求回答下列问题:
(1)在实验室进行步骤A操作时,需要用到的主要仪器名称为___________ 。
(2)步骤C中得到的滤渣成分有CaSO4、CaCO3、C和___________ ,步骤D中氧化剂与还原剂的物质的量之比为___________ 。
(3)步骤E中调节pH的范围为___________ ,其目的是___________ 。
(4)步骤G发生的离子方程式为___________ ,若Mn2+恰好沉淀完全时测得溶液中 的浓度为2.2×10-6mol·L-1,则Ksp(MnCO3)=
的浓度为2.2×10-6mol·L-1,则Ksp(MnCO3)=___________ 。
(5)实验室可以用Na2S2O8溶液来检验Mn2+是否完全发生反应,原理为___________Mn2++___________S2O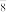 +___________H2O→___________H++___________SO
+___________H2O→___________H++___________SO +___________MnO
+___________MnO 。试配平该离子方程式。
。试配平该离子方程式。___________

已知:还原焙烧的主反应为2MnO2+C
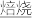 2MnO+CO2↑。
2MnO+CO2↑。可能用到的数据如下:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 1.5 | 6.5 | 4.2 | 8.3 |
| 沉淀完全pH | 3.7 | 9.7 | 7.4 | 9.8 |
根据要求回答下列问题:
(1)在实验室进行步骤A操作时,需要用到的主要仪器名称为
(2)步骤C中得到的滤渣成分有CaSO4、CaCO3、C和
(3)步骤E中调节pH的范围为
(4)步骤G发生的离子方程式为
 的浓度为2.2×10-6mol·L-1,则Ksp(MnCO3)=
的浓度为2.2×10-6mol·L-1,则Ksp(MnCO3)=(5)实验室可以用Na2S2O8溶液来检验Mn2+是否完全发生反应,原理为___________Mn2++___________S2O
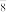 +___________H2O→___________H++___________SO
+___________H2O→___________H++___________SO +___________MnO
+___________MnO 。试配平该离子方程式。
。试配平该离子方程式。
您最近一年使用:0次



