一氧化碳可用于制甲酸钠,也可以在冶金工业中作还原剂,还可以作气体燃料,如水煤气(一氧化碳和氢气等气体的混合物)。在恒温恒容密闭容器中发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g)。请回答下列问题:
CO2(g)+H2(g)。请回答下列问题:
(1)加快该反应速率的措施是___ (写两条)。
(2)已知化学键的键能(E)数据如下表:
由此计算生成1mol CO2___ (吸收或放出)能量___ kJ。
(3)判断该反应达到平衡的依据是__ 。
A.正、逆反应速率都为零
B.容器内压强不再变化
C.CO、H2O、CO2、H2的浓度都不再发生变化
D.单位时间内生成1molH2,同时生成1mol CO
(4)若该容器的容积为2L,加入0.2mol的CO和0.2mol的H2O(g),在一定条件下发生反应,反应中CO2的浓度随时间变化情况如图所示:
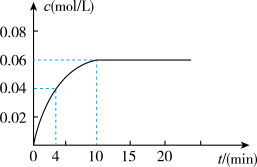
①反应到4min时,H2O(g)的转化率=___ 。
②根据该图数据,反应开始至达到平衡时,CO的平均反应速率v(CO)=___ ;反应达平衡时,H2的体积分数=__ 。
 CO2(g)+H2(g)。请回答下列问题:
CO2(g)+H2(g)。请回答下列问题:(1)加快该反应速率的措施是
(2)已知化学键的键能(E)数据如下表:
| 化学键 | H-H | C=O | C≡O(CO) | H-O |
| E/(kJ/mol) | 436 | 750 | 1076 | 463 |
由此计算生成1mol CO2
(3)判断该反应达到平衡的依据是
A.正、逆反应速率都为零
B.容器内压强不再变化
C.CO、H2O、CO2、H2的浓度都不再发生变化
D.单位时间内生成1molH2,同时生成1mol CO
(4)若该容器的容积为2L,加入0.2mol的CO和0.2mol的H2O(g),在一定条件下发生反应,反应中CO2的浓度随时间变化情况如图所示:

①反应到4min时,H2O(g)的转化率=
②根据该图数据,反应开始至达到平衡时,CO的平均反应速率v(CO)=
更新时间:2020-09-03 12:43:51
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】工业生产中含硫废水的排放会污染环境,需要对含硫废水进行处理与利用。
(1)某制革厂含硫废水中主要含有物是Na2S。
①测得该废水溶液pH=12,用离子方程式解释溶液呈碱性的原因_____ 。
②含硫废水的处理过程中可以采用纯氧将Na2S转化为Na2SO4,则反应中还原剂与氧化剂的物质的量之比为_____ 。已知1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s) + 4H2(g) Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H
Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______ 0(填“>”“=”或“<”)。
(2)含硫燃料中间体废水中主要含有物为Na2SO3,回收废水中的硫化物,以减少资源的浪费,可采用以下方法:

①中和含酸废水工业常用的试剂x是_____ 。
②写出H2S气体与足量NaOH溶液反应的化学方程式____ 。
③铁屑与石墨能形成微型原电池,SO32-在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO32-在酸性条件下放电生成H2S的电极反应式:____ 。
④已知:2H2S(g)+O2(g) =2S(s) +2H2O(l) △H=-632.8kJ/mol
SO2 (g) =S(s)+ O2(g) △H= +269.8kJ/mol
H2S与O2反应生成SO2和H2O的热化学方程式为_____ 。
(1)某制革厂含硫废水中主要含有物是Na2S。
①测得该废水溶液pH=12,用离子方程式解释溶液呈碱性的原因
②含硫废水的处理过程中可以采用纯氧将Na2S转化为Na2SO4,则反应中还原剂与氧化剂的物质的量之比为
 Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H
Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H(2)含硫燃料中间体废水中主要含有物为Na2SO3,回收废水中的硫化物,以减少资源的浪费,可采用以下方法:

①中和含酸废水工业常用的试剂x是
②写出H2S气体与足量NaOH溶液反应的化学方程式
③铁屑与石墨能形成微型原电池,SO32-在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO32-在酸性条件下放电生成H2S的电极反应式:
④已知:2H2S(g)+O2(g) =2S(s) +2H2O(l) △H=-632.8kJ/mol
SO2 (g) =S(s)+ O2(g) △H= +269.8kJ/mol
H2S与O2反应生成SO2和H2O的热化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】完成下列问题
(1)土壤中的微生物可将大气中的 经两步反应氧化成
经两步反应氧化成 ,第一步反应的能量变化如图1所示。
,第一步反应的能量变化如图1所示。
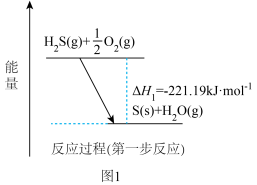
已知: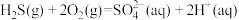
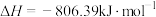
写出第二步反应的热化学方程式:___________ 。
(2)①远洋轮船的钢铁船体在海水中易发生电化学腐蚀中的___________ 腐蚀。
②利用如图2装置,可以模拟铁的电化学防护。若X为碳棒,为减缓铁的腐蚀,开关K应置于___________ 处。若X为锌,开关K置于M处,该电化学防护法称为___________ 。
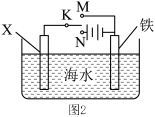
(3)以反应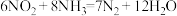 为原理设计电池(如图3所示,a、b电极均为惰性电极),既能有效消除氮氧化物的排放,减小环境污染,又能充分利用化学资源。(阳离子交换膜只允许阳离子通过)
为原理设计电池(如图3所示,a、b电极均为惰性电极),既能有效消除氮氧化物的排放,减小环境污染,又能充分利用化学资源。(阳离子交换膜只允许阳离子通过)

①电池工作时,电解质溶液中的 穿过阳离子交换膜向
穿过阳离子交换膜向___________ (填“a”或“b”)电极移动。
②b电极上的电极反应式为___________ 。
③电池工作一段时间后转移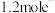 ,左侧工作室溶液的pH
,左侧工作室溶液的pH___________ (填“变大”、“变小”或“不变”),处理的 体积为
体积为___________ L(标准状况下)。
(1)土壤中的微生物可将大气中的
 经两步反应氧化成
经两步反应氧化成 ,第一步反应的能量变化如图1所示。
,第一步反应的能量变化如图1所示。
已知:
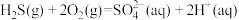
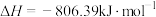
写出第二步反应的热化学方程式:
(2)①远洋轮船的钢铁船体在海水中易发生电化学腐蚀中的
②利用如图2装置,可以模拟铁的电化学防护。若X为碳棒,为减缓铁的腐蚀,开关K应置于

(3)以反应
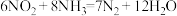 为原理设计电池(如图3所示,a、b电极均为惰性电极),既能有效消除氮氧化物的排放,减小环境污染,又能充分利用化学资源。(阳离子交换膜只允许阳离子通过)
为原理设计电池(如图3所示,a、b电极均为惰性电极),既能有效消除氮氧化物的排放,减小环境污染,又能充分利用化学资源。(阳离子交换膜只允许阳离子通过)
①电池工作时,电解质溶液中的
 穿过阳离子交换膜向
穿过阳离子交换膜向②b电极上的电极反应式为
③电池工作一段时间后转移
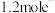 ,左侧工作室溶液的pH
,左侧工作室溶液的pH 体积为
体积为
您最近一年使用:0次
【推荐3】通过生物柴油副产物甘油制取H2正成为将其高值化利用的一个重要研究方向。生物甘油水蒸气重整制氢的主要反应原理如下:
I.C3H8O3(g)⇌3CO(g)+4H2(g) ΔH1=+251kJ·mol-1
II.CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH2=-41kJ·mol-1
回答下列问题:
(1)反应I能够自发进行的条件是___________ (填“高温”“低温”或“任何温度”)。
(2)重整总反应C3H8O3(g)+3H2O(g)⇌3CO2(g)+7H2(g)的ΔH1=___________ kJ·mol-1
(3)反应II是水汽变换反应。
①若在Au/CeO2表面反应,反应II的机理如下:

该反应过程第一步得到的物质是_______ (填标号);产生*CO2的反应是_______ (吸附态用*表示,如*OH)。
②在TK时,反应II的平衡常数为1,起始时水碳比分别为n(H2O)/(CO)=9和n(H2O)/(CO)=3时,CO的平衡转化率之比为___________ 。
(4)甘油水蒸气重整制氢时,其他条件不变,在不同水醇比m[m=n(H2O):n(C3H8O3)]时H2的平衡产率与温度的关系如下图所示。

①水醇比从大到小的顺序是___________ ;在水醇比不变时H2的平衡产率随温度的升高先增大后又减小的主要原因是___________ 。
②该工艺中CO、CO2与H2反应生成甲烷是主要副反应(均为放热反应),实际生产中为抑制CH4的生成提高氢气的产率,可采取的措施有(不考虑压强的影响___________ (列举2条)。
I.C3H8O3(g)⇌3CO(g)+4H2(g) ΔH1=+251kJ·mol-1
II.CO(g)+H2O(g)⇌CO2(g)+H2(g) ΔH2=-41kJ·mol-1
回答下列问题:
(1)反应I能够自发进行的条件是
(2)重整总反应C3H8O3(g)+3H2O(g)⇌3CO2(g)+7H2(g)的ΔH1=
(3)反应II是水汽变换反应。
①若在Au/CeO2表面反应,反应II的机理如下:

该反应过程第一步得到的物质是
②在TK时,反应II的平衡常数为1,起始时水碳比分别为n(H2O)/(CO)=9和n(H2O)/(CO)=3时,CO的平衡转化率之比为
(4)甘油水蒸气重整制氢时,其他条件不变,在不同水醇比m[m=n(H2O):n(C3H8O3)]时H2的平衡产率与温度的关系如下图所示。

①水醇比从大到小的顺序是
②该工艺中CO、CO2与H2反应生成甲烷是主要副反应(均为放热反应),实际生产中为抑制CH4的生成提高氢气的产率,可采取的措施有(不考虑压强的影响
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】完成下列问题。
(1)二氧化氯 是黄绿色、易溶于水的气体,具有强氧化性,可用于烟气中
是黄绿色、易溶于水的气体,具有强氧化性,可用于烟气中 和NO的脱除。研究表明:
和NO的脱除。研究表明: 氧化
氧化 和NO的反应历程与下列反应有关。
和NO的反应历程与下列反应有关。
实验测得: 分别对纯
分别对纯 、纯NO以及同时氧化的氧化率随时间的变化情况如图所示。据此分析:
、纯NO以及同时氧化的氧化率随时间的变化情况如图所示。据此分析:

①其它因素都相同,判断 氧化
氧化 的活化能
的活化能_______ (填“>”或“<”) 氧化NO的活化能;
氧化NO的活化能;
②NO的存在_______ (填“会”或“不会”)催化 氧化
氧化 。请结合ⅰ、ⅲ、ⅳ的速率常数分析原因:
。请结合ⅰ、ⅲ、ⅳ的速率常数分析原因:_______ 。
(2)一定时间内,NaClO溶液在不同温度下对硫、硝脱除率影响曲线如图。
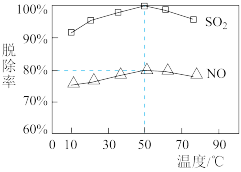
① 脱除率高于NO,可能的原因是
脱除率高于NO,可能的原因是_______ (写两条)。
②烟气中 和NO体积比为4∶1,烟气与50℃时的吸收液转化生成的
和NO体积比为4∶1,烟气与50℃时的吸收液转化生成的
_______ 。
(1)二氧化氯
 是黄绿色、易溶于水的气体,具有强氧化性,可用于烟气中
是黄绿色、易溶于水的气体,具有强氧化性,可用于烟气中 和NO的脱除。研究表明:
和NO的脱除。研究表明: 氧化
氧化 和NO的反应历程与下列反应有关。
和NO的反应历程与下列反应有关。| 序号 | 反应机理 | 反应热 | 速率常数 | |
| 脱硝 | ⅰ |  |  | 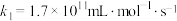 |
| ⅱ | 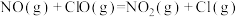 |  | 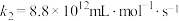 | |
| 脱硫 | ⅲ | 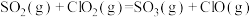 |  |  |
| ⅳ |  |  | 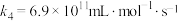 |
实验测得:
 分别对纯
分别对纯 、纯NO以及同时氧化的氧化率随时间的变化情况如图所示。据此分析:
、纯NO以及同时氧化的氧化率随时间的变化情况如图所示。据此分析:
①其它因素都相同,判断
 氧化
氧化 的活化能
的活化能 氧化NO的活化能;
氧化NO的活化能;②NO的存在
 氧化
氧化 。请结合ⅰ、ⅲ、ⅳ的速率常数分析原因:
。请结合ⅰ、ⅲ、ⅳ的速率常数分析原因:(2)一定时间内,NaClO溶液在不同温度下对硫、硝脱除率影响曲线如图。

①
 脱除率高于NO,可能的原因是
脱除率高于NO,可能的原因是②烟气中
 和NO体积比为4∶1,烟气与50℃时的吸收液转化生成的
和NO体积比为4∶1,烟气与50℃时的吸收液转化生成的
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】牙齿上的牙釉质主要由矿物羟基磷灰石Ca10(PO4)6(OH)2组成,是人体最坚硬的物质,但口腔内残留食物会发酵使口腔呈酸性,羟基磷灰石溶解导致牙齿受损,从而形成蛀牙。
Ca10(PO4)6(OH)2(s)+8H+(aq) 10Ca2+(aq)+6HPO
10Ca2+(aq)+6HPO (aq)+2H2O(l)
(aq)+2H2O(l)
完成下列填空:
(1)该反应的平衡常数表达式为___________ 。当喝下碳酸饮料时,平衡向___________ 反应方向移动,平衡常数___________ (选填:增大、减少或不变)。
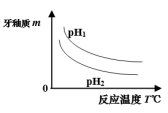
(2)牙釉质的质量与反应温度、pH关系如图所示,则该反应为___________ 反应(选填:放热或吸热),pH1___________ pH2(选填:>、<或=)。
(3)能说明达到平衡状态的是___________。(选填字母)
(4)为模拟酸对牙釉质的影响,在一密闭容器中加入牙釉质和盐酸,经过5h后,发现溶液的pH由3变化为4,则Ca2+的平均反应速率为___________ 。
(5)氟磷灰石(Ca10(PO4)6F2)比羟基磷灰石溶解度更小,质地更坚固。
①氟化钠溶液呈碱性,溶液中:c(F−)+ c(OH−)___________ c(H+),c(HF)___________ c(OH−)(均选填:>,<或=)。
②已知羟基磷灰石在水中存在如下溶解平衡:Ca10(PO4)6(OH)2(s) 10Ca2+(aq)+6PO
10Ca2+(aq)+6PO (aq)+2OH- (aq)。某品牌牙膏中配有氟化钠添加剂,请结合离子方程式解释氟化钠添加剂能够防治龋齿的原因
(aq)+2OH- (aq)。某品牌牙膏中配有氟化钠添加剂,请结合离子方程式解释氟化钠添加剂能够防治龋齿的原因___________ 。
Ca10(PO4)6(OH)2(s)+8H+(aq)
 10Ca2+(aq)+6HPO
10Ca2+(aq)+6HPO (aq)+2H2O(l)
(aq)+2H2O(l)完成下列填空:
(1)该反应的平衡常数表达式为
(2)牙釉质的质量与反应温度、pH关系如图所示,则该反应为

(3)能说明达到平衡状态的是___________。(选填字母)
| A.各离子浓度相等 | B.pH维持稳定 |
C.5 V正(Ca2+)=3 V逆(HPO ) ) | D.羟基磷灰石的质量不发生变化 |
(5)氟磷灰石(Ca10(PO4)6F2)比羟基磷灰石溶解度更小,质地更坚固。
①氟化钠溶液呈碱性,溶液中:c(F−)+ c(OH−)
②已知羟基磷灰石在水中存在如下溶解平衡:Ca10(PO4)6(OH)2(s)
 10Ca2+(aq)+6PO
10Ca2+(aq)+6PO (aq)+2OH- (aq)。某品牌牙膏中配有氟化钠添加剂,请结合离子方程式解释氟化钠添加剂能够防治龋齿的原因
(aq)+2OH- (aq)。某品牌牙膏中配有氟化钠添加剂,请结合离子方程式解释氟化钠添加剂能够防治龋齿的原因
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】回答下列问题
(1)工业上用二氧化碳催化加氢可合成乙醇,其反应原理为:
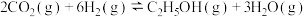
 。
。
通过表格中的数值可以推断:该反应的
______ 0(填“>”、“<”、或“=”),其正反应在______ (填“高温”、“低温”或“任何温度”)下能自发进行。若达到平衡时,液化分离出 ,反应速率将
,反应速率将______ (填“增大”、“减小”或“不变”)。
(2)工业上也可以利用 和
和 合成甲醇:
合成甲醇: 。某1 L恒温恒容密闭容器中充入1 mol
。某1 L恒温恒容密闭容器中充入1 mol  和3 mol
和3 mol  发生反应,测得
发生反应,测得 和
和 浓度随时间变化如图所示:
浓度随时间变化如图所示:

①0∼3 min内, 的平均反应速率为
的平均反应速率为______ ,该温度下的平衡常数为
______ (单位可忽略)。若达平衡时,保持温度不变,向容器中再充入 、
、 、
、 和
和 各0.25 mol,则此时Q
各0.25 mol,则此时Q______ K,v正______ v逆(填“>”、“<”、或“=”)。
②下列说法能说明反应达到化学平衡状态的是______
A. 的消耗速率与
的消耗速率与 的消耗速率之比为3∶1
的消耗速率之比为3∶1
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D. 和
和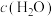 的浓度相等时
的浓度相等时
(1)工业上用二氧化碳催化加氢可合成乙醇,其反应原理为:
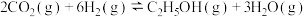
 。
。| 温度/ | 400 | 500 |
| 平衡常数K | 9 | 5.3 |

 ,反应速率将
,反应速率将(2)工业上也可以利用
 和
和 合成甲醇:
合成甲醇: 。某1 L恒温恒容密闭容器中充入1 mol
。某1 L恒温恒容密闭容器中充入1 mol  和3 mol
和3 mol  发生反应,测得
发生反应,测得 和
和 浓度随时间变化如图所示:
浓度随时间变化如图所示:
①0∼3 min内,
 的平均反应速率为
的平均反应速率为
 、
、 、
、 和
和 各0.25 mol,则此时Q
各0.25 mol,则此时Q②下列说法能说明反应达到化学平衡状态的是
A.
 的消耗速率与
的消耗速率与 的消耗速率之比为3∶1
的消耗速率之比为3∶1B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.
 和
和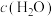 的浓度相等时
的浓度相等时
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】NO2、NO、CO、NO2-等是常见大气污染物和水污染物,研究NO2、NO、CO、NO2-等的处理对建设美丽中国具有重要意义。
已知:①NO2+CO CO2+NO,该反应的平衡常数为K1(下同)。断开1mol下列物质的所有化学键时所消耗能量分别为:
CO2+NO,该反应的平衡常数为K1(下同)。断开1mol下列物质的所有化学键时所消耗能量分别为:
② N2(g)+
N2(g)+  O2(g)
O2(g) NO(g) △H= +89.75kJ/mol,K2
NO(g) △H= +89.75kJ/mol,K2
③2NO(g)+O2(g) 2NO2(g) △H=-112.3kJ/mol,K3
2NO2(g) △H=-112.3kJ/mol,K3
写出NO与CO反应生成无污染气体的热化学方程式:_____________ ,此热化学方程式的平衡常数K=_______ (用K1、K2、K3表示)
(2) 污染性气体NO2与CO 在一定条件下的反应为2NO2+4CO 4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡,容器的压强变为原来的
4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡,容器的压强变为原来的 ,则反应开始到平衡时CO 的平均反应速率v(CO)=
,则反应开始到平衡时CO 的平均反应速率v(CO)=_______ 。若此温度下,某时刻则得NO2、CO、CO2、N2的浓度分别为a mol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围为________ 。
(3) 研究发现: NOx是雾霾的主要成分之一,NH3催化还原氮氧化物(SCR) 技术是目前应用最广泛的烟气氮氧化物脱除技术。已知:4NH3(g)+6NO(g)=5N2(g)+6H2O(g) △H=-1810kJ/mol
①相同条件下,在2L恒容密闭容器中,选用不同的催化剂,上述反应产生N2的物质的量随时间变化的情况如图所示。

a.在催化剂A作用下,反应达到平衡的标志是_____ (填序号)。
A.4v(NH3)正=6v(H2O)逆
B.容器内总压强不再改变
C.容器内密度不再改变
D.NO 和H2O(g)浓度相等
E.容器内平均摩尔质量不再改变
b.在A、B,C 三种催化剂下,清除氮氧化物反应的活化能分别表示为Ea(A)、Ea(B)、Ea(C),根据图甲所示曲线,判断三种催化剂条件下,活化能由大到小的顺序为________ 。
②在氨气足量时,反应在催化剂A 作用下,经过相同时间,测得脱氮潮殖反应温度的变化情况如图乙所示,据图可知,自相同的时间内,温度对脱氮率的影响及可他的原因是________ 。(已知A、B催化剂在此温度范围内不失效)。
已知:①NO2+CO
 CO2+NO,该反应的平衡常数为K1(下同)。断开1mol下列物质的所有化学键时所消耗能量分别为:
CO2+NO,该反应的平衡常数为K1(下同)。断开1mol下列物质的所有化学键时所消耗能量分别为:| NO2 | CO | CO2 | NO |
| 812kJ | 1076kJ | 1490kJ | 632kJ |
②
 N2(g)+
N2(g)+  O2(g)
O2(g) NO(g) △H= +89.75kJ/mol,K2
NO(g) △H= +89.75kJ/mol,K2③2NO(g)+O2(g)
 2NO2(g) △H=-112.3kJ/mol,K3
2NO2(g) △H=-112.3kJ/mol,K3写出NO与CO反应生成无污染气体的热化学方程式:
(2) 污染性气体NO2与CO 在一定条件下的反应为2NO2+4CO
 4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡,容器的压强变为原来的
4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡,容器的压强变为原来的 ,则反应开始到平衡时CO 的平均反应速率v(CO)=
,则反应开始到平衡时CO 的平均反应速率v(CO)=(3) 研究发现: NOx是雾霾的主要成分之一,NH3催化还原氮氧化物(SCR) 技术是目前应用最广泛的烟气氮氧化物脱除技术。已知:4NH3(g)+6NO(g)=5N2(g)+6H2O(g) △H=-1810kJ/mol
①相同条件下,在2L恒容密闭容器中,选用不同的催化剂,上述反应产生N2的物质的量随时间变化的情况如图所示。

a.在催化剂A作用下,反应达到平衡的标志是
A.4v(NH3)正=6v(H2O)逆
B.容器内总压强不再改变
C.容器内密度不再改变
D.NO 和H2O(g)浓度相等
E.容器内平均摩尔质量不再改变
b.在A、B,C 三种催化剂下,清除氮氧化物反应的活化能分别表示为Ea(A)、Ea(B)、Ea(C),根据图甲所示曲线,判断三种催化剂条件下,活化能由大到小的顺序为
②在氨气足量时,反应在催化剂A 作用下,经过相同时间,测得脱氮潮殖反应温度的变化情况如图乙所示,据图可知,自相同的时间内,温度对脱氮率的影响及可他的原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】二甲醚(CH3OCH3)被称为21世纪的新型燃料,25℃,101kPa时呈气态,它清洁、高效、具有优良的环保性能。92g气态二甲醚25℃,101kPa时燃烧放热2910kJ。
(1)写出二甲醚燃烧热的热化学方程式_______________________________________________ ;当燃烧放出582kJ热量时,转移的电子数为_______________ 。
(2)已知H2(g)和C(s)的燃烧热分别是285.8kJ/mol、393.5kJ/mo;计算反应4C(s)+6H2(g)+O2(g)═2CH3OCH3(g)的反应热为______________________________ ;
(3)工业上利用H2和CO2合成二甲醚的反应如下:
6H2(g)+2CO2(g) CH3OCH3(g)+3H2O(g)△H<0
CH3OCH3(g)+3H2O(g)△H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应.下列能判断反应达到化学平衡状态的是______________________________ (选填字母编号)
A. c(H2)与c(H2O)的比值保持不变
B.单位时间内有2mol H2消耗时有1mol H2O生成
C.容器中气体密度不再改变
D.容器中气体压强不再改变
E.反应产生的热量不再变化
②温度升高,该化学平衡移动后到达新的平衡,CH3OCH3的产量将_______________ (填“变大”、“变小”或“不变”,下同),混合气体的平均摩尔质量将_______________ 。
(1)写出二甲醚燃烧热的热化学方程式
(2)已知H2(g)和C(s)的燃烧热分别是285.8kJ/mol、393.5kJ/mo;计算反应4C(s)+6H2(g)+O2(g)═2CH3OCH3(g)的反应热为
(3)工业上利用H2和CO2合成二甲醚的反应如下:
6H2(g)+2CO2(g)
 CH3OCH3(g)+3H2O(g)△H<0
CH3OCH3(g)+3H2O(g)△H<0①一定温度下,在一个固定体积的密闭容器中进行该反应.下列能判断反应达到化学平衡状态的是
A. c(H2)与c(H2O)的比值保持不变
B.单位时间内有2mol H2消耗时有1mol H2O生成
C.容器中气体密度不再改变
D.容器中气体压强不再改变
E.反应产生的热量不再变化
②温度升高,该化学平衡移动后到达新的平衡,CH3OCH3的产量将
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=______
(2)该反应为______ 反应(选填“吸热”“放热”).
(3)能判断该反应是否达到化学平衡状态的依据是______ .
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为______ ℃.在此温度下2L密闭容器中进行反应CO2(g)+H2(g)⇌CO(g)+H2O(g),CO2(g)和H2(g)的起始量均为2.0mol,达到平衡时CO2的转化率为 ______ .
(5)在密闭容器中进行反应①Fe(s)+CO2(g)⇌FeO(s)+CO(g)△H1=akJ•mol-1
反应②2CO(g)+O2(g)⇌2CO2(g)△H2=b kJ•mol-1
反应③2Fe(s)+O2(g)⇌2FeO(s)△H3
则△H3=______ (用含a、b的代数式表示).
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=
(2)该反应为
(3)能判断该反应是否达到化学平衡状态的依据是
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为
(5)在密闭容器中进行反应①Fe(s)+CO2(g)⇌FeO(s)+CO(g)△H1=akJ•mol-1
反应②2CO(g)+O2(g)⇌2CO2(g)△H2=b kJ•mol-1
反应③2Fe(s)+O2(g)⇌2FeO(s)△H3
则△H3=
您最近一年使用:0次



