光刻技术需利用深紫外激光,我国是唯一掌握通过非线性光学晶体变频来获得深紫外激光技术的国家。目前唯一实用化的晶体是KBBF(含K、B、Be、O、F元素)。回答下列有关问题:
(1)元素Be的名称为______ ,在元素周期表中的位置为______ 。一群均处于激发态1s22s13s1的Be原子,若都回到基态,最多可能发出______ 种波长不同的光。
a.1 b.2 c.3 d.4
(2)Be和B都容易与配体形成配位键,如[BeF4]2一、[B(OH)4]一等,从原子结构分析其原因是______ 。写出Be(OH)2溶于氢氧化钠溶液的离子方程式______ 。
(3)氟硼酸钾是制备KBeBF的原料之一,高温下分解为KF和BF3。KF的沸点比BF3的高,原因是______ 。
(4)BF3易水解得到H3BO3(硼酸)和氢氟酸。氢氟酸浓溶液中因F一与HF结合形成 使酸性大大增强。
使酸性大大增强。 的结构式为
的结构式为______ ;H3BO3和 中,B原子的杂化类型分别为
中,B原子的杂化类型分别为______ 、______ 。
(1)元素Be的名称为
a.1 b.2 c.3 d.4
(2)Be和B都容易与配体形成配位键,如[BeF4]2一、[B(OH)4]一等,从原子结构分析其原因是
(3)氟硼酸钾是制备KBeBF的原料之一,高温下分解为KF和BF3。KF的沸点比BF3的高,原因是
(4)BF3易水解得到H3BO3(硼酸)和氢氟酸。氢氟酸浓溶液中因F一与HF结合形成
 使酸性大大增强。
使酸性大大增强。 的结构式为
的结构式为 中,B原子的杂化类型分别为
中,B原子的杂化类型分别为
更新时间:2020-07-11 09:46:21
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】云阳龙缸云端廊桥曾被詟为“世界第一悬挑玻璃景观廊桥”,所用钢化玻璃因其优良的性能广泛应用于日常生活,但由于制作玻璃时里面含有极少量硫化镍,使得钢化玻璃在极限条件下的使用受到限制.
(1)基态硫原子价层电子的轨道表达式(电子排布图)为____________ ,基态镍原子中核外电子占据最高能层的符号为_____________ .
(2)Ni(CO)4常用于制备纯镍,溶于乙醇、CCl4、苯等有机溶剂,为___________ 晶体,Ni(CO)4空间构型与甲烷相同,中心原子的杂化轨道类型为___________ ,写出与配体互为等电子体的阴离子__________________________________________________________ (任写一种).
(3)与硫同族的硒元素有两种常见的二元含氧酸,请比较它们酸性强弱 > (填化学式)______ ,理由是_______________________________________________________________ .
(4)H2S的键角__________ (填“大于”“小于””等于”)H2O的键角,请从电负性的角度说明理由___________________________________________________ .
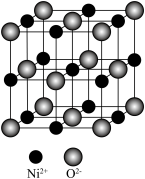
(5)NiO与NaCl的晶胞结构相似,如图所示,阴离子采取面心立方堆积,阳离子填充在位于阴离子构成的空隙__________ 中,已知Ni2+半径为69nm,O2-半径为140nm,阿伏伽德罗常数为NA,NiO晶体的密度为________ g/cm3(只列出计算式).
(1)基态硫原子价层电子的轨道表达式(电子排布图)为
(2)Ni(CO)4常用于制备纯镍,溶于乙醇、CCl4、苯等有机溶剂,为
(3)与硫同族的硒元素有两种常见的二元含氧酸,请比较它们酸性强弱 > (填化学式)
(4)H2S的键角
(5)NiO与NaCl的晶胞结构相似,如图所示,阴离子采取面心立方堆积,阳离子填充在位于阴离子构成的空隙

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】NaN3是一种易溶于水(NaN3=Na++N3-)的白色固体,可用于有机合成和汽车安全气囊的产气药等。钠法(液氨法)制备NaN3的工艺流程如下:
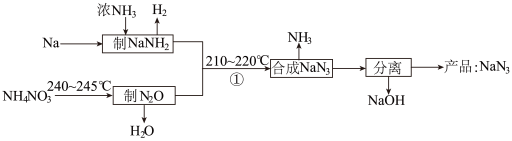
(1)钠元素位于周期表第______ 周期______ 族。
(2)NaNH2中氮元素的化合价为_______ ;Na+的结构示意图为_____ 。
(3)NaOH的电子式为______ 。
(4)反应NH4NO3 N2O↑+2H2O↑中,每生成1molN2O转移电子数为
N2O↑+2H2O↑中,每生成1molN2O转移电子数为_____ 个。
(5)反应①的化学方程式为______ 。
(6)销毁NaN3可用NaClO溶液,该销毁反应的离子方程式为______ (N3-被氧化为N2)。

(1)钠元素位于周期表第
(2)NaNH2中氮元素的化合价为
(3)NaOH的电子式为
(4)反应NH4NO3
 N2O↑+2H2O↑中,每生成1molN2O转移电子数为
N2O↑+2H2O↑中,每生成1molN2O转移电子数为(5)反应①的化学方程式为
(6)销毁NaN3可用NaClO溶液,该销毁反应的离子方程式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】卤族元素的单质和化合物很多,利用所学物质结构与性质的知识去认识和理解它们。
(1)溴的核外电子排布式为__ 。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在。使氢氟酸分子缔合作用力是___ 。
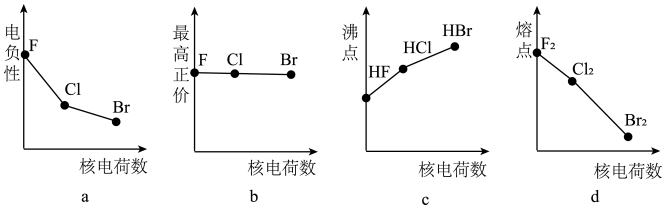
(3)下列曲线表示卤族元素某种性质随核电荷数递增的变化趋势,正确的是___ 。
(4)已知高碘酸有两种形式,化学式分别为H5IO6(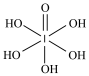 )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6___ HIO4(填“>”、“<”或“=”)。IO 的VSEPR模型为
的VSEPR模型为__ 。
(5)铜与氯形成化合物的晶胞如附图所示(黑点代表铜粒子)。
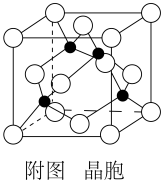
①该晶体的化学式为__ 。
②一定条件下,Cu2O比CuO更稳定的原因是__ 。
③已知该晶体的密度为ρg·cm-3,阿伏加 德罗常数为NA,则该晶体的边长为__ pm。(用含ρ、NA的式子表示)
(1)溴的核外电子排布式为
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在。使氢氟酸分子缔合作用力是
(3)下列曲线表示卤族元素某种性质随核电荷数递增的变化趋势,正确的是

(4)已知高碘酸有两种形式,化学式分别为H5IO6(
 )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6 的VSEPR模型为
的VSEPR模型为(5)铜与氯形成化合物的晶胞如附图所示(黑点代表铜粒子)。

①该晶体的化学式为
②一定条件下,Cu2O比CuO更稳定的原因是
③已知该晶体的密度为ρg·cm-3,阿伏加 德罗常数为NA,则该晶体的边长为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】NaCl是重要的化工原料。回答下列问题:
(1)元素Na的焰色反应呈___ 色。价电子被激发到相邻高能级后形成的激发态Na原子,其价电子轨道表示式为___ 。
(2)KBr具有NaCl型的晶体结构,但其熔点比NaCl低,原因是___ 。
(3)在适当的条件下,电解NaCl水溶液可制得NaClO3。
①NaCl水溶液中,不存在的微粒间作用力有___ 。
A.离子键 B.极性键 C.配位键 D.氢键 E.范德华力
②ClO3-离子的几何构型为___ ,中心原子的杂化方式为___ 。
(4)NaCl晶体在50~300GPa的高压下和Cl2反应,可以形成一种新晶体,其立方晶胞如图所示(大球为Cl,小球为Na)。
①若A的原子坐标为(0,0,0),B的原子坐标为( ,0,
,0,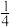 ),则C的原子坐标为
),则C的原子坐标为___ 。
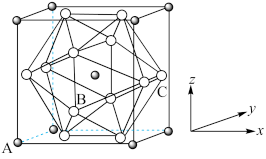
②晶体中,Cl构成的多面体包含___ 个三角形的面,与Cl紧邻的Na个数为___ 。
(1)元素Na的焰色反应呈
(2)KBr具有NaCl型的晶体结构,但其熔点比NaCl低,原因是
(3)在适当的条件下,电解NaCl水溶液可制得NaClO3。
①NaCl水溶液中,不存在的微粒间作用力有
A.离子键 B.极性键 C.配位键 D.氢键 E.范德华力
②ClO3-离子的几何构型为
(4)NaCl晶体在50~300GPa的高压下和Cl2反应,可以形成一种新晶体,其立方晶胞如图所示(大球为Cl,小球为Na)。
①若A的原子坐标为(0,0,0),B的原子坐标为(
 ,0,
,0,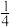 ),则C的原子坐标为
),则C的原子坐标为
②晶体中,Cl构成的多面体包含
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】有X、Y、Z、Q、E、M、G原子序数依次递增的七种元素,除G元素外其余均为短周期主族元素。X的原子中没有成对电子,Y元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子数相同,Z元素原子的外围电子层排布式为nsnnpn+1,Q的基态原子核外成对电子数是成单电子数的3倍,E与Q同周期,M元素的第一电离能在同周期主族元素中从大到小排第三位,G原子最外电子层只有未成对电子,其内层所有轨道全部充满,但并不是第ⅠA族元素。回答下列问题:
(1)基态G原子的价电子排布式为____________ ,写出第三周期基态原子未成对电子数与G相同且电负性最大的元素是________ (填元素名称)。GQ受热分解生成G2Q和Q2,请从G的原子结构来说明GQ受热易分解的原因:__________________________________ 。
(2)Z、Q、M三种元素的第一电离能从大到小的顺序为_______________ (用元素符号表示)。
(3)M的氢化物(H2M)分子的立体构型为________ ,稳定性:H2Q____ H2M。 H2Q2中Q的杂化类型为________ ,为_______ 分子。
(4)Z、M、E所形成的简单离子的半径由大到小顺序为_________________ (用离子符号表示)。
(5)X、Y、Z、Q的电负性由大到小的顺序为________________________ (用元素符号表示)。
(6)G的氯化物与氨水反应可形成配合物[G(NH3)4]Cl2,1 mol该配合物中含有σ键的物质的量为________ mol。
(1)基态G原子的价电子排布式为
(2)Z、Q、M三种元素的第一电离能从大到小的顺序为
(3)M的氢化物(H2M)分子的立体构型为
(4)Z、M、E所形成的简单离子的半径由大到小顺序为
(5)X、Y、Z、Q的电负性由大到小的顺序为
(6)G的氯化物与氨水反应可形成配合物[G(NH3)4]Cl2,1 mol该配合物中含有σ键的物质的量为
您最近一年使用:0次
【推荐3】碳中和的目标是减少含碳气体的排放。CH4与CO2都能引起温室效应,将二者联合处理不仅可以减缓温室气体排放,还可以转化为CH3OH、CH3COOH、H2等高附加值产品。
(1)CH4与CO2在一定条件下能发生如下两个反应:
Ⅰ.CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH1=+247kJ/mol
2CO(g)+2H2(g) ΔH1=+247kJ/mol
Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41kJ/mol
CO(g)+H2O(g) ΔH2=+41kJ/mol
若CH4与CO2按物质的量之比1∶3投料在某恒容密闭容器中发生上述反应,一定时间内CH4与CO2的转化率随温度的变化如图所示,其中CO2在1000℃时的平衡转化率为60%,CH4在1000℃时的平衡转化率几乎为100%。_______ 下能自发进行(填“高温”或“低温”)。
②温度高于700℃ 时,随温度升高,平衡产物中H2O的体积分数_______ (填“增大”“减小”或“不变”)。
③1000℃时反应Ⅱ 的平衡常数K=_______ (保留3位有效数字,下同),平衡时CO的体积分数为_______ 。
(2)CH4与CO2在催化剂作用下反应可生成CH3COOH,其反应机理如图所示。_______ 。
②转化过程中经历了i→ii的变化,该变化过程_______ (填“吸热”或“放热”)。产物CH3COOH中碳原子的杂化方式为_______ 。
③甲醇(CH3OH)与氧气形成的燃料电池是新能源汽车等领域常用的电池。通常以石墨为电极,KOH溶液为电解质溶液,该电池放电时,负极反应式为_______ 。
(1)CH4与CO2在一定条件下能发生如下两个反应:
Ⅰ.CH4(g)+CO2(g)
 2CO(g)+2H2(g) ΔH1=+247kJ/mol
2CO(g)+2H2(g) ΔH1=+247kJ/molⅡ.CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=+41kJ/mol
CO(g)+H2O(g) ΔH2=+41kJ/mol若CH4与CO2按物质的量之比1∶3投料在某恒容密闭容器中发生上述反应,一定时间内CH4与CO2的转化率随温度的变化如图所示,其中CO2在1000℃时的平衡转化率为60%,CH4在1000℃时的平衡转化率几乎为100%。
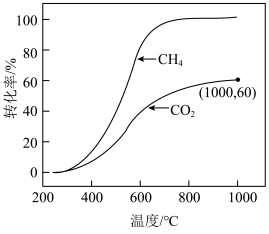
②温度高于700℃ 时,随温度升高,平衡产物中H2O的体积分数
③1000℃时反应Ⅱ 的平衡常数K=
(2)CH4与CO2在催化剂作用下反应可生成CH3COOH,其反应机理如图所示。
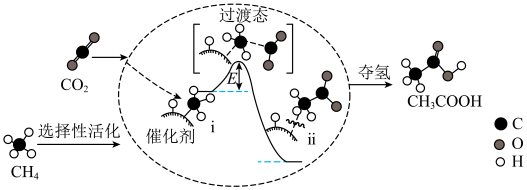
②转化过程中经历了i→ii的变化,该变化过程
③甲醇(CH3OH)与氧气形成的燃料电池是新能源汽车等领域常用的电池。通常以石墨为电极,KOH溶液为电解质溶液,该电池放电时,负极反应式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】太阳能电池的发展已经进入了第三代。第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜钢镓硒 (
( 中掺入
中掺入 )等化合物薄膜太阳能电池以及薄膜
)等化合物薄膜太阳能电池以及薄膜 系太阳能电池。
系太阳能电池。
(1)亚铜离子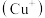 基态时的价电子排布式表示为
基态时的价电子排布式表示为___________ 。
(2)硒为第四周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为___________ (用元素符号表示)。
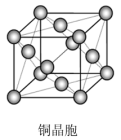
(3) 晶体的堆积方式是
晶体的堆积方式是___________ (填堆积名称),其配位数为___________ ;往 的硫酸盐溶液中加入过量氨水,可生成
的硫酸盐溶液中加入过量氨水,可生成 ,下列说法正确的是
,下列说法正确的是___________ 。
A. 中所含的化学键有离子键、极性键和配位键
中所含的化学键有离子键、极性键和配位键
B.在 中
中 给出孤电子对,
给出孤电子对, 提供空轨道
提供空轨道
C. 组成元素中第一电离能最大的是氧元素
组成元素中第一电离能最大的是氧元素
D. 与
与 互为等电子体,空间构型均为正四面体形
互为等电子体,空间构型均为正四面体形
(4)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸( )溶于水显弱酸性,但它却只是一元酸,可以用硼酸在水溶液中的电离平衡解释它只是一元弱酸的原因。
)溶于水显弱酸性,但它却只是一元酸,可以用硼酸在水溶液中的电离平衡解释它只是一元弱酸的原因。
① 中B的原子杂化类型为
中B的原子杂化类型为___________ 杂化;
②写出硼酸在水溶液中的电离方程式___________ 。
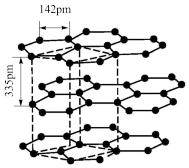
(5)硅与碳是同一主族元素,其中石墨为混合型晶体,已知石墨的层间距为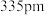 ,
,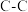 键长为
键长为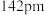 ,计算石墨晶体密度=
,计算石墨晶体密度=___________  (结果保留两位有效数字,
(结果保留两位有效数字, 为
为 )。
)。
 (
( 中掺入
中掺入 )等化合物薄膜太阳能电池以及薄膜
)等化合物薄膜太阳能电池以及薄膜 系太阳能电池。
系太阳能电池。(1)亚铜离子
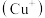 基态时的价电子排布式表示为
基态时的价电子排布式表示为(2)硒为第四周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为
(3)
 晶体的堆积方式是
晶体的堆积方式是 的硫酸盐溶液中加入过量氨水,可生成
的硫酸盐溶液中加入过量氨水,可生成 ,下列说法正确的是
,下列说法正确的是
A.
 中所含的化学键有离子键、极性键和配位键
中所含的化学键有离子键、极性键和配位键B.在
 中
中 给出孤电子对,
给出孤电子对, 提供空轨道
提供空轨道C.
 组成元素中第一电离能最大的是氧元素
组成元素中第一电离能最大的是氧元素D.
 与
与 互为等电子体,空间构型均为正四面体形
互为等电子体,空间构型均为正四面体形(4)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(
 )溶于水显弱酸性,但它却只是一元酸,可以用硼酸在水溶液中的电离平衡解释它只是一元弱酸的原因。
)溶于水显弱酸性,但它却只是一元酸,可以用硼酸在水溶液中的电离平衡解释它只是一元弱酸的原因。①
 中B的原子杂化类型为
中B的原子杂化类型为②写出硼酸在水溶液中的电离方程式
(5)硅与碳是同一主族元素,其中石墨为混合型晶体,已知石墨的层间距为
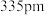 ,
,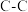 键长为
键长为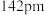 ,计算石墨晶体密度=
,计算石墨晶体密度= (结果保留两位有效数字,
(结果保留两位有效数字, 为
为 )。
)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】Mg、Zn、S、B等元素在医药、国防、材料领域应用广泛。请回答下列问题:
(1)Zn元素在周期表中的位置为____ ;基态硫原子核外电子的空间运动状态有____ 种。
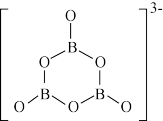
(2)氨硼烷(H3BNH3)是一种安全、高效的储氢材料,H3BNH3分子的结构与乙烷相似,与N原子相连的H呈正电性,与B原子相连的H呈负电性,则氨硼烷分子中原子的电负性从小到大的顺序为____ 。NH3BH3分子中,N—B化学键称为____ 键,其电子对由____ 提供。氨硼烷在催化剂作用下水解释放氢气:3NH3BH3+6H2O=3NH3+B3O +9H2,B3O
+9H2,B3O 的结构如图所示,在该反应中,B原子的杂化轨道类型由
的结构如图所示,在该反应中,B原子的杂化轨道类型由____ 变为____ 。
(3)三氯化硼是一种重要的化工原料。制备BCl3的原理为B2O3+3C+3Cl2=2BCl3+3CO,BCl3分子的空间构型为____ ,形成BCl3分子时,基态B原子价电子层上的电子先进行激发,再进行杂化,激发时B原子的价电子轨道表示式为____ (填序号)。
A.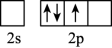 B.
B.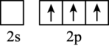 C.
C. D.
D.
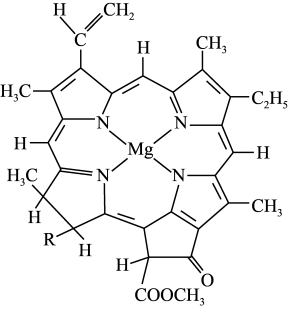
(4)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。卟啉配合物叶绿素是一种,其结构如图所示,其中C原子的杂化方式为____ 。叶绿素的中心离子无论是Mg2+还是Cu2+,都能形成稳定结构,其中稳定性相对较高的是____ (填“Mg2+”或“Cu2+”)。
(1)Zn元素在周期表中的位置为
(2)氨硼烷(H3BNH3)是一种安全、高效的储氢材料,H3BNH3分子的结构与乙烷相似,与N原子相连的H呈正电性,与B原子相连的H呈负电性,则氨硼烷分子中原子的电负性从小到大的顺序为
 +9H2,B3O
+9H2,B3O 的结构如图所示,在该反应中,B原子的杂化轨道类型由
的结构如图所示,在该反应中,B原子的杂化轨道类型由
(3)三氯化硼是一种重要的化工原料。制备BCl3的原理为B2O3+3C+3Cl2=2BCl3+3CO,BCl3分子的空间构型为
A.
 B.
B. C.
C. D.
D.
(4)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。卟啉配合物叶绿素是一种,其结构如图所示,其中C原子的杂化方式为

您最近一年使用:0次
【推荐3】卤素及其化合物广泛存在于自然界中。回答下列问题:
(1)光气(COCl2)是一种重要的有机中间体,在农药、医药、工程塑料、聚氨酯材料以及军事上都有许多用途。光气的分子立体构型为______________ ,其三种元素的电负性由小到大的顺序为______________ 。与COCl2互为等电子体的分子和离子(各写一种)__________ 。
(2)日常生活中,看到的许多可见光,如霓虹灯,试从原子结构角度解释这一现象?____________________________ 。
(3)区分晶态二氧化硅和非晶态二氧化硅最可靠的科学方法是_____________ 。
(4)一种铜的溴化物晶胞结构如图所示,若将图中的Cu去掉,再把所有的Br换成Cu,得到晶体铜的晶胞结构,则晶体铜的堆积方式为___________ ,某同学将基态铜原子价电子错误的写为3d94s2,违背了核外电子排布规律中的______ 。
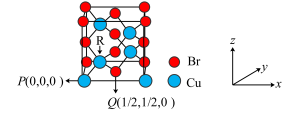
(5)下列关于上述铜的溴化物晶胞结构说法正确的是_________ (选填字母序号)。
A.该化合物的化学式为CuBr2
B.铜的配位数为8
C.与每个Br紧邻的Br有12个
D.由图中P点和Q点的原子坐标参数,确定R点的原子坐标参数为(1/4,1/4,1/4)
(6)若图中P点和R点的原子核间距为a cm,NA为阿伏伽德罗常数的值,则该晶胞密度为______ g/cm3。(列出计算式即可)
(1)光气(COCl2)是一种重要的有机中间体,在农药、医药、工程塑料、聚氨酯材料以及军事上都有许多用途。光气的分子立体构型为
(2)日常生活中,看到的许多可见光,如霓虹灯,试从原子结构角度解释这一现象?
(3)区分晶态二氧化硅和非晶态二氧化硅最可靠的科学方法是
(4)一种铜的溴化物晶胞结构如图所示,若将图中的Cu去掉,再把所有的Br换成Cu,得到晶体铜的晶胞结构,则晶体铜的堆积方式为

(5)下列关于上述铜的溴化物晶胞结构说法正确的是
A.该化合物的化学式为CuBr2
B.铜的配位数为8
C.与每个Br紧邻的Br有12个
D.由图中P点和Q点的原子坐标参数,确定R点的原子坐标参数为(1/4,1/4,1/4)
(6)若图中P点和R点的原子核间距为a cm,NA为阿伏伽德罗常数的值,则该晶胞密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】2017年科学工作若研究的两项最新成果如下:
I.4-一二甲氨基吡啶(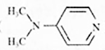 )能高效催化醋酸酐和磺胺的反应。
)能高效催化醋酸酐和磺胺的反应。
II.钙钛矿制作的一种新材料推进了人工光合作用的进程。
请回答以下问题:
(1)基态钛原子的价电子排布式为_____________________ 。
(2) ①构成4 —二甲氨基吡啶分子的各原子电负性由大到小的顺序为_____________ ,其中元素第一电离能最大的是_________________ 。
②1mol4—二甲氨基吡啶分子中所含σ键的数目为_____________ ,其中C原子的杂化形式为____________ 。(3)乙酰氯(CH3COCl)和乙酸钠(CH3COONa)反应可以制备醋酸酐。这两种反应物中熔点更高的是_____ ,原因是_______________________________ 。
(4)自然界中除钙钛矿外,碳酸钙、硫酸钙也都是钙元素形成的常见物质。请比较键角的大小:CO32-_____ SO42-(填“>”“<”或“=”),推断依据是_________________________________ 。
(5)钙钛矿有多种晶胞结构,其中一种晶胞结构如图所示
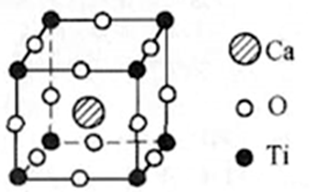
①此钙钛矿晶胞中,Ca2+周围距离最近且相等的Ca2+个数为__________________________ 。
②已知该晶胞的密度为d g/cm3,NA表示阿伏伽德罗常数的值。计算晶胞参数a=_______ pm。(写出表达式,不需要进行计算)
I.4-一二甲氨基吡啶(
 )能高效催化醋酸酐和磺胺的反应。
)能高效催化醋酸酐和磺胺的反应。II.钙钛矿制作的一种新材料推进了人工光合作用的进程。
请回答以下问题:
(1)基态钛原子的价电子排布式为
(2) ①构成4 —二甲氨基吡啶分子的各原子电负性由大到小的顺序为
②1mol4—二甲氨基吡啶分子中所含σ键的数目为
(4)自然界中除钙钛矿外,碳酸钙、硫酸钙也都是钙元素形成的常见物质。请比较键角的大小:CO32-
(5)钙钛矿有多种晶胞结构,其中一种晶胞结构如图所示

①此钙钛矿晶胞中,Ca2+周围距离最近且相等的Ca2+个数为
②已知该晶胞的密度为d g/cm3,NA表示阿伏伽德罗常数的值。计算晶胞参数a=
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】第四周期中的18种元素具有重要的用途,在现代工业中备受青睐。
(1)铬是一种硬而脆、抗腐蚀性强的金属,常用于电镀和制造特种钢。基态Cr原子中,电子占据最高能层的符号为________ ,该能层上具有的原子轨道数为______ ,电子数为______ 。
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,30Zn与31Ga的第一电离能不符合这一规律原因是______________ 。
(3)与As同主族的短周期元素是N、P。AsH3中心原子杂化的类型________ ;一定压强下将AsH3和NH3、PH3的混合气体降温时首先液化的是________ ,理由是____________ 。
(4) H2SeO4酸性大于H2SeO3的原因是____________________________ 。
(5) 已知Ti3+可形成配位数为6,颜色不同的两种配合物晶体,一种为紫色,另一种为绿色。两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a 分别取等质量的两种配合物晶体的样品配成待测溶液;
b 分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c 沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液得到的白色沉淀质量为原紫色晶体的水溶液得到的沉淀质量的2/3。则绿色晶体配合物的化学式为_______________ 。
(1)铬是一种硬而脆、抗腐蚀性强的金属,常用于电镀和制造特种钢。基态Cr原子中,电子占据最高能层的符号为
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,30Zn与31Ga的第一电离能不符合这一规律原因是
(3)与As同主族的短周期元素是N、P。AsH3中心原子杂化的类型
(4) H2SeO4酸性大于H2SeO3的原因是
(5) 已知Ti3+可形成配位数为6,颜色不同的两种配合物晶体,一种为紫色,另一种为绿色。两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a 分别取等质量的两种配合物晶体的样品配成待测溶液;
b 分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c 沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液得到的白色沉淀质量为原紫色晶体的水溶液得到的沉淀质量的2/3。则绿色晶体配合物的化学式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】铍主要用于原子能反应堆材料,宇航工程材料,各种合金,X射线透射窗等。
(1)基态Be核外电子排布式为___________ ,其电子占据的最高能级的形状是___________ 形。
(2)有如下反应:
ⅰ.
ⅱ.在 溶液或
溶液或 溶液中加入
溶液中加入 溶液均能生成
溶液均能生成 沉淀
沉淀
则下列说法中正确的是___________。
(3) 可以与相应酸反应制得
可以与相应酸反应制得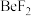 和
和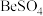 等含铍物质。
等含铍物质。
①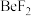 属于共价化合物,属于
属于共价化合物,属于___________ (填“极性”或“非极性”)分子,它能与 反应得到阴阳离子比例为
反应得到阴阳离子比例为 的配合物,该配合物中存在配位键的微粒是
的配合物,该配合物中存在配位键的微粒是___________ 。
②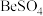 的晶胞是长方体,如图所示(边长
的晶胞是长方体,如图所示(边长 ,高
,高 ;三种球表示三种不同原子,其中
;三种球表示三种不同原子,其中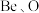 未标出):
未标出): 中心原子杂化类型是
中心原子杂化类型是___________ ; 原子位于晶胞的
原子位于晶胞的___________ (填“棱”、“面”或“体内”);
ⅱ.阿伏加德罗常数为 ,其密度的表达式为
,其密度的表达式为___________  (列计算式)。
(列计算式)。
(4)铍的金属有机化合物是研究的热点。某课题组报道了二茂二铍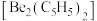 的合成和结构,结构如下。
的合成和结构,结构如下。___________ 个电子的大 键,有
键,有___________ 个原子共平面。
(1)基态Be核外电子排布式为
(2)有如下反应:
ⅰ.

ⅱ.在
 溶液或
溶液或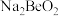 溶液中加入
溶液中加入 溶液均能生成
溶液均能生成 沉淀
沉淀则下列说法中正确的是___________。
A. 属于两性氢氧化物 属于两性氢氧化物 |
B. 水溶液的导电性强,因此 水溶液的导电性强,因此 是离子化合物 是离子化合物 |
C. 和 和 分别与 分别与 溶液反应均可得到 溶液反应均可得到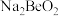 溶液 溶液 |
| D.ⅱ中反应均和水解相关 |
(3)
 可以与相应酸反应制得
可以与相应酸反应制得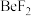 和
和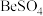 等含铍物质。
等含铍物质。①
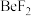 属于共价化合物,属于
属于共价化合物,属于 反应得到阴阳离子比例为
反应得到阴阳离子比例为 的配合物,该配合物中存在配位键的微粒是
的配合物,该配合物中存在配位键的微粒是②
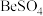 的晶胞是长方体,如图所示(边长
的晶胞是长方体,如图所示(边长 ,高
,高 ;三种球表示三种不同原子,其中
;三种球表示三种不同原子,其中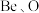 未标出):
未标出):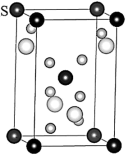
 中心原子杂化类型是
中心原子杂化类型是 原子位于晶胞的
原子位于晶胞的ⅱ.阿伏加德罗常数为
 ,其密度的表达式为
,其密度的表达式为 (列计算式)。
(列计算式)。(4)铍的金属有机化合物是研究的热点。某课题组报道了二茂二铍
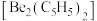 的合成和结构,结构如下。
的合成和结构,结构如下。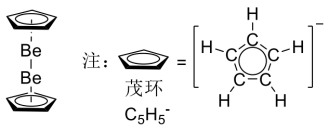
 键,有
键,有
您最近一年使用:0次



