察尔汗盐湖是我国最大的钾肥生成基地,生产钾肥过程中会产生大量的水氯镁石(MgCl2·6H2O)。为实现资源综合利用,以水氯镁石为原料制轻质氧化镁。其工艺如下:
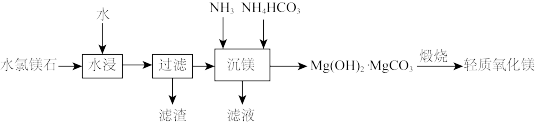
按要求回答问题:
(1)锂与镁元素性质相似,写出向Li2SO4溶液中滴加Na2CO3溶液的离子方程式为________ 。
(2)为了提高水浸速率,可采取的措施有_________ 。
(3)“沉镁”的离子方程式为_________ ,“沉镁”采用的温度为90~95 ℃,温度不宜超过95 ℃的理由是 _________ 。
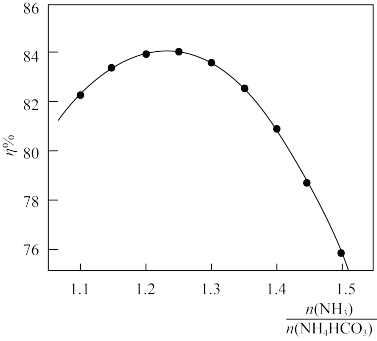
(4)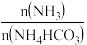 (NH 3与NH4HCO3的物质的量之比)与沉镁效率()的关系如图所示,指出沉镁的
(NH 3与NH4HCO3的物质的量之比)与沉镁效率()的关系如图所示,指出沉镁的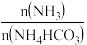 最佳范围为
最佳范围为 _________ 。
(5)试说明 “煅烧”后得到疏松多孔的MgO的原因_________ 。
(6)“滤液”中的主要成分为_________ ,可用于 _________ (写出一种生活生产的应用)。

按要求回答问题:
(1)锂与镁元素性质相似,写出向Li2SO4溶液中滴加Na2CO3溶液的离子方程式为
(2)为了提高水浸速率,可采取的措施有
(3)“沉镁”的离子方程式为
(4)
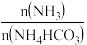 (NH 3与NH4HCO3的物质的量之比)与沉镁效率()的关系如图所示,指出沉镁的
(NH 3与NH4HCO3的物质的量之比)与沉镁效率()的关系如图所示,指出沉镁的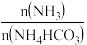 最佳范围为
最佳范围为 
(5)试说明 “煅烧”后得到疏松多孔的MgO的原因
(6)“滤液”中的主要成分为
更新时间:2020-10-18 21:10:38
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】纯橄岩为含镁的硅酸盐矿物,并含有MnO、Fe2O3、FeO、SiO2和一些有机物等杂质。工业上利用纯橄岩制备一水硫酸镁(MgSO4·H2O)的工艺流程如图:
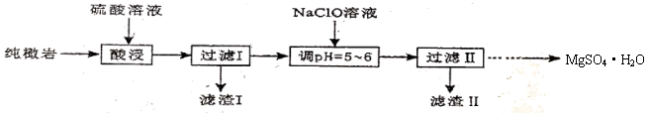
(1)酸浸时温度控制在90℃~100℃之间,并且要连续搅拌2小时。
①连续搅拌2小时的目的是___ 。
②酸浸时适宜的酸度及用量对酸浸工艺十分重要,浓度过低,浸取不完全,浓度过高(>5mol/L)造成浆料黏度过大,出现“包团现象”,根据酸浸反应原理分析,造成浆料黏度过大的物质是___ (填名称)。
(2)已知硫酸镁的溶解度随温度变化的曲线如图,且溶液的沸点随压强增大而升高。为了从滤液中充分回收MgSO4·H2O,采取将滤液蒸发浓缩、加压升温的方法结晶,需要加压升温的原因是___ 。


(1)酸浸时温度控制在90℃~100℃之间,并且要连续搅拌2小时。
①连续搅拌2小时的目的是
②酸浸时适宜的酸度及用量对酸浸工艺十分重要,浓度过低,浸取不完全,浓度过高(>5mol/L)造成浆料黏度过大,出现“包团现象”,根据酸浸反应原理分析,造成浆料黏度过大的物质是
(2)已知硫酸镁的溶解度随温度变化的曲线如图,且溶液的沸点随压强增大而升高。为了从滤液中充分回收MgSO4·H2O,采取将滤液蒸发浓缩、加压升温的方法结晶,需要加压升温的原因是

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】碳酸镁晶须是一种新型吸波隐形材料中的增强剂。某工厂以MgCl2(含少量杂质FeCl2、FeCl3)为原料制备碳酸镁晶须(MgCO3·H2O)的工艺流程如下:
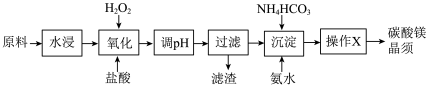
已知:Fe3+、Fe2+、Mg2+生成氢氧化物沉淀时的pH
注:Fe(OH)2沉淀呈絮状,不易从溶液中除去。
(1)写出“氧化”过程中发生的离子反应方程式_______________ 。
(2)pH调节的范围___________ ,滤渣的主要成分___________ (填化学式)。
(3)操作X包括过滤、洗涤、烘干,证明碳酸镁晶须已经洗涤干净的方法______________ 。
(4)水浸后溶液中Fe2+、Fe3+含量的测定
①取水浸后溶液100.00 mL,测得Cl-的浓度为0.455 mol·L-1,向其中缓缓通入氯气使Fe2+恰好完全转化为Fe3+,测得此时溶液中Cl-的浓度为0.460 mol·L-1(溶液体积变化忽略不计)。
②另取水浸后溶液100.00 mL,向其中加入过量的1 mol·L-1 NaOH溶液,充分反应后过滤、洗涤、灼烧,冷却后,称得固体粉末的质量为0.96 g。试通过计算确定水浸后溶液中Fe2+、Fe3+的物质的量浓度(写出计算过程)。_______________________

已知:Fe3+、Fe2+、Mg2+生成氢氧化物沉淀时的pH
注:Fe(OH)2沉淀呈絮状,不易从溶液中除去。
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mg(OH)2 | 9.9 | 11.0 |
(2)pH调节的范围
(3)操作X包括过滤、洗涤、烘干,证明碳酸镁晶须已经洗涤干净的方法
(4)水浸后溶液中Fe2+、Fe3+含量的测定
①取水浸后溶液100.00 mL,测得Cl-的浓度为0.455 mol·L-1,向其中缓缓通入氯气使Fe2+恰好完全转化为Fe3+,测得此时溶液中Cl-的浓度为0.460 mol·L-1(溶液体积变化忽略不计)。
②另取水浸后溶液100.00 mL,向其中加入过量的1 mol·L-1 NaOH溶液,充分反应后过滤、洗涤、灼烧,冷却后,称得固体粉末的质量为0.96 g。试通过计算确定水浸后溶液中Fe2+、Fe3+的物质的量浓度(写出计算过程)。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】无水MgBr2可用作催化剂.实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图1,主要步骤如下:
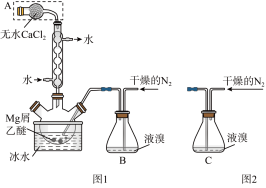
步骤1 三颈瓶中装入10g镁屑和150mL无水乙醚;装置B中加入15mL液溴.
步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中.
步骤3 反应完毕后恢复至常温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚溴化镁粗品.
步骤4 室温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品.
已知:①Mg与Br2反应剧烈放热;MgBr2具有强吸水性.
②MgBr2+3C2H5OC2H5⇌MgBr2•3C2H5OC2H5
请回答:
(1)仪器A的名称是______ .实验中不能用干燥空气代替干燥N2,原因是______________
(2)如将装置B改为装置C(图2),可能会导致的后果是___________________
(3)步骤3中,第一次过滤除去的物质是_________________ .
(4)有关步骤4的说法,正确的是__________________ .
A、可用95%的乙醇代替苯溶解粗品
B、洗涤晶体可选用0℃的苯
C、加热至160℃的主要目的是除去苯
D、该步骤的目的是除去乙醚和可能残留的溴
(5)为测定产品的纯度,可用EDTA(简写为Y)标准溶液滴定,反应的离子方程式:Mg2++Y4﹣═MgY2﹣①滴定管洗涤前的操作是_____________________________ .
②测定时,先称取0.2500g无水MgBr2产品,溶解后,用0.0500mol•L﹣1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液25.00mL,则测得无水MgBr2产品的纯度是__________________ (以质量分数表示).

步骤1 三颈瓶中装入10g镁屑和150mL无水乙醚;装置B中加入15mL液溴.
步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中.
步骤3 反应完毕后恢复至常温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚溴化镁粗品.
步骤4 室温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品.
已知:①Mg与Br2反应剧烈放热;MgBr2具有强吸水性.
②MgBr2+3C2H5OC2H5⇌MgBr2•3C2H5OC2H5
请回答:
(1)仪器A的名称是
(2)如将装置B改为装置C(图2),可能会导致的后果是
(3)步骤3中,第一次过滤除去的物质是
(4)有关步骤4的说法,正确的是
A、可用95%的乙醇代替苯溶解粗品
B、洗涤晶体可选用0℃的苯
C、加热至160℃的主要目的是除去苯
D、该步骤的目的是除去乙醚和可能残留的溴
(5)为测定产品的纯度,可用EDTA(简写为Y)标准溶液滴定,反应的离子方程式:Mg2++Y4﹣═MgY2﹣①滴定管洗涤前的操作是
②测定时,先称取0.2500g无水MgBr2产品,溶解后,用0.0500mol•L﹣1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液25.00mL,则测得无水MgBr2产品的纯度是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】CuCl是一种重要化工原料,常用作催化剂、杀菌剂。化学小组利用下图装置(部分夹持装置略去)制备氯化亚铜。

已知:①CuCl为白色固体,微溶于水,不溶于酒精,在空气中能被迅速氧化。
②CuCl能溶于氨水,[Cu(NH3)2]+无色
实验步骤:
I.向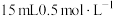 的CuCl2溶液中,加入
的CuCl2溶液中,加入 的NaOH溶液30mL;打开A中分液漏斗的活塞产生SO2气体,一段时间后C中产生白色固体。
的NaOH溶液30mL;打开A中分液漏斗的活塞产生SO2气体,一段时间后C中产生白色固体。
II.将C中混合物过滤、洗涤、干燥得CuCl产品。
回答下列问题:
(1)仪器a的名称_____ ,装置B的作用是_____ 。
(2)步骤I中通入SO2发生反应的离子方程式____ 。
(3)步骤II采用抽滤法快速过滤,防止滤渣被空气氧化为Cu2(OH)3Cl。CuCl被氧化为Cu2(OH)3Cl的化学方程式为___ ;用95%的乙醇代替蒸馏水洗涤的优点是____ 。
(4)判断CuCl沉淀洗涤干净的实验方案是___ 。
(5)CuCl样品加氨水溶解后露置于空气中迅速得到深蓝色溶液,深蓝色是由于溶液中阳离子__ (填化学式)呈现的。
(6)准确称取所制备的氯化亚铜样品mg,将其置于过量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用amol·L-1的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液bmL,反应中 被还原为Cr3+(该条件下Cl-不反应),样品中CuCl的质量分数为
被还原为Cr3+(该条件下Cl-不反应),样品中CuCl的质量分数为___ 。

已知:①CuCl为白色固体,微溶于水,不溶于酒精,在空气中能被迅速氧化。
②CuCl能溶于氨水,[Cu(NH3)2]+无色
实验步骤:
I.向
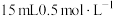 的CuCl2溶液中,加入
的CuCl2溶液中,加入 的NaOH溶液30mL;打开A中分液漏斗的活塞产生SO2气体,一段时间后C中产生白色固体。
的NaOH溶液30mL;打开A中分液漏斗的活塞产生SO2气体,一段时间后C中产生白色固体。II.将C中混合物过滤、洗涤、干燥得CuCl产品。
回答下列问题:
(1)仪器a的名称
(2)步骤I中通入SO2发生反应的离子方程式
(3)步骤II采用抽滤法快速过滤,防止滤渣被空气氧化为Cu2(OH)3Cl。CuCl被氧化为Cu2(OH)3Cl的化学方程式为
(4)判断CuCl沉淀洗涤干净的实验方案是
(5)CuCl样品加氨水溶解后露置于空气中迅速得到深蓝色溶液,深蓝色是由于溶液中阳离子
(6)准确称取所制备的氯化亚铜样品mg,将其置于过量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用amol·L-1的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液bmL,反应中
 被还原为Cr3+(该条件下Cl-不反应),样品中CuCl的质量分数为
被还原为Cr3+(该条件下Cl-不反应),样品中CuCl的质量分数为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】某废铁铬催化剂含Fe3O4、Cr2O3、MgO、Al2O3及少量不溶性杂质)回收铁的工艺流程如下图所示:
ii.Cr(OH)3+OH-= +2H2O
+2H2O
iii.已知Cr的金属性强于Fe
(1)铁元素位于元素周期表的___________ 区;基态Cr原子的价层电子排布式为___________ ;SO2的空间结构名称为___________ 。
(2)加入铁粉后,调节pH的范围为___________ 。
(3)由滤渣1得到滤液3发生反应的离子方程式为___________ 。
(4)滤渣3主要成分的化学式为___________ ;回收铬时,铬的存在形式为___________ (填化学式)。
(5)由滤液2得到结晶水合物的操作是___________ 、过滤、洗涤、干燥。
(6)滤渣2与FeS2混合后隔绝空气焙烧,总反应的化学方程式为32Fe(OH)3+FeS2 11Fe3O4+2SO2↑+48H2O,实际生产过程中还要加入适量CaO,目的是
11Fe3O4+2SO2↑+48H2O,实际生产过程中还要加入适量CaO,目的是___________ 。

| 金属离子 | Fe3+ | Al3+ | Cr3+ | Fe2+ | Mg2+ |
| 开始沉淀的pH | 1.5 | 4.0 | 4.6 | 7.6 | 9.5 |
| 沉淀完全的pH | 2.8 | 5.2 | 6.8 | 9.7 | 11.1 |
| 金属氢氧化物 | Al(OH)3 | Cr(OH)3 | |||
| 开始溶解的pH | 7.8 | 12 | |||
| 溶解完全的pH | 10.8 | >14 | |||
 +2H2O
+2H2Oiii.已知Cr的金属性强于Fe
(1)铁元素位于元素周期表的
(2)加入铁粉后,调节pH的范围为
(3)由滤渣1得到滤液3发生反应的离子方程式为
(4)滤渣3主要成分的化学式为
(5)由滤液2得到结晶水合物的操作是
(6)滤渣2与FeS2混合后隔绝空气焙烧,总反应的化学方程式为32Fe(OH)3+FeS2
 11Fe3O4+2SO2↑+48H2O,实际生产过程中还要加入适量CaO,目的是
11Fe3O4+2SO2↑+48H2O,实际生产过程中还要加入适量CaO,目的是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】以黄铁矿(主要成分 )为原料生产硫酸,应将产出的炉渣和尾气进行资源化综合利用,减轻对环境的污染。其中一种流程如下图所示。
)为原料生产硫酸,应将产出的炉渣和尾气进行资源化综合利用,减轻对环境的污染。其中一种流程如下图所示。
(1)黄铁矿中硫元素的化合价为___________ 。
(2)“氧化”时,反应的化学方程式为___________ 。
(3)工业上,吸收 时宜选用的试剂X为
时宜选用的试剂X为___________ (填“水”或“浓硫酸”)。
(4) 高温灼烧时,火焰呈
高温灼烧时,火焰呈___________ 色。
(5) 在保存过程中发生
在保存过程中发生___________ (填“氧化”或“还原”)反应,导致商品 中不可避免地存在
中不可避免地存在 ,欲检验其中的
,欲检验其中的 ,可取少量样品溶于水中,
,可取少量样品溶于水中,___________ ,说明含有 。
。
(6)一般用K2Cr2O7滴定分析法测定还原铁粉纯度。实验步骤:称取一定量样品,用过量稀硫酸溶解,用已知浓度的K2Cr2O7溶液测定其中的Fe2+。反应原理为___________Cr2O +___________Fe2++___________H+=___________Cr3++___________Fe3++___________H2O。
+___________Fe2++___________H+=___________Cr3++___________Fe3++___________H2O。
①配平上述离子反应方程式___________ 。
②某次实验称取0.2800g样品,测定时消耗浓度为0.03000mol·L-1的K2Cr2O7溶液25.10mL,则样品中铁含量为___________ %(保留至小数点后第一位)。
 )为原料生产硫酸,应将产出的炉渣和尾气进行资源化综合利用,减轻对环境的污染。其中一种流程如下图所示。
)为原料生产硫酸,应将产出的炉渣和尾气进行资源化综合利用,减轻对环境的污染。其中一种流程如下图所示。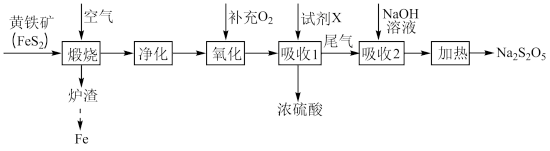
(1)黄铁矿中硫元素的化合价为
(2)“氧化”时,反应的化学方程式为
(3)工业上,吸收
 时宜选用的试剂X为
时宜选用的试剂X为(4)
 高温灼烧时,火焰呈
高温灼烧时,火焰呈(5)
 在保存过程中发生
在保存过程中发生 中不可避免地存在
中不可避免地存在 ,欲检验其中的
,欲检验其中的 ,可取少量样品溶于水中,
,可取少量样品溶于水中, 。
。(6)一般用K2Cr2O7滴定分析法测定还原铁粉纯度。实验步骤:称取一定量样品,用过量稀硫酸溶解,用已知浓度的K2Cr2O7溶液测定其中的Fe2+。反应原理为___________Cr2O
 +___________Fe2++___________H+=___________Cr3++___________Fe3++___________H2O。
+___________Fe2++___________H+=___________Cr3++___________Fe3++___________H2O。①配平上述离子反应方程式
②某次实验称取0.2800g样品,测定时消耗浓度为0.03000mol·L-1的K2Cr2O7溶液25.10mL,则样品中铁含量为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】某工厂的废金属屑中的主要成分为 、
、 和
和 ,此外还含有少量
,此外还含有少量 和
和 ,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的废金属屑制取氯化铝、绿矾晶体(
,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的废金属屑制取氯化铝、绿矾晶体(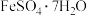 )和胆矾晶体。
)和胆矾晶体。

请回答下列问题:
(1)写出步骤Ⅰ发生反应的离子方程式:________________________________ 。
(2)试剂 是
是_________________ ,溶液 是
是________________ 。
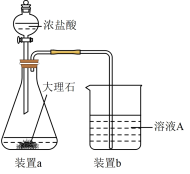
(3)步骤Ⅱ中,用如图装置制取 并通入溶液
并通入溶液 中,一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体
中,一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体 减少,可采取的改进措施是
减少,可采取的改进措施是________________________________________________ 。
(4)由固体 制取硫酸铜溶液,通常有两种方案:
制取硫酸铜溶液,通常有两种方案:
方案一:将固体 在加热条件下与浓硫酸反应[
在加热条件下与浓硫酸反应[ 与浓硫酸在加热条件下反应的化学方程式为
与浓硫酸在加热条件下反应的化学方程式为 ];
];
方案二:将固体 投入热的稀硫酸中,然后通入氧气。
投入热的稀硫酸中,然后通入氧气。
方案一的缺点是_____________________________________________________________________________ 。
 、
、 和
和 ,此外还含有少量
,此外还含有少量 和
和 ,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的废金属屑制取氯化铝、绿矾晶体(
,为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用该工厂的废金属屑制取氯化铝、绿矾晶体(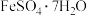 )和胆矾晶体。
)和胆矾晶体。
请回答下列问题:
(1)写出步骤Ⅰ发生反应的离子方程式:
(2)试剂
 是
是 是
是(3)步骤Ⅱ中,用如图装置制取
 并通入溶液
并通入溶液 中,一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体
中,一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体 减少,可采取的改进措施是
减少,可采取的改进措施是
(4)由固体
 制取硫酸铜溶液,通常有两种方案:
制取硫酸铜溶液,通常有两种方案:方案一:将固体
 在加热条件下与浓硫酸反应[
在加热条件下与浓硫酸反应[ 与浓硫酸在加热条件下反应的化学方程式为
与浓硫酸在加热条件下反应的化学方程式为 ];
];方案二:将固体
 投入热的稀硫酸中,然后通入氧气。
投入热的稀硫酸中,然后通入氧气。方案一的缺点是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】环己烯是重要的化工原料。其实验室制备流程如下:

回答下列问题:
Ⅰ.环己烯的制备与提纯
(1)原料环己醇中若含苯酚杂质,检验试剂为____________ ,现象为__________________ 。
(2)操作1的装置如图所示(加热和夹持装置已略去)。
①烧瓶A中进行的可逆反应化学方程式为___________________ ,浓硫酸也可作该反应的催化剂,选择FeCl3•6H2O而不用浓硫酸的原因为________________ (填序号)。
a.浓硫酸易使原料炭化并产生SO2
b. FeCl3•6H2O污染小、可循环使用,符合绿色化学理念
c.同等条件下,用FeCl3•6H2O比浓硫酸的平衡转化率高
②仪器B的作用为____________ 。
(3)操作2用到的玻璃仪器是____________ 。
(4)将操作3(蒸馏)的步骤补齐:安装蒸馏装置,加入待蒸馏的物质和沸石,____________ ,弃去前馏分,收集83℃的馏分。
Ⅱ.环己烯含量的测定
在一定条件下,向ag环己烯样品中加入定量制得的bmolBr2,与环己烯充分反应后,剩余的Br2与足量KI作用生成I2,用cmol•L-1的Na2S2O3标准溶液滴定,终点时消耗Na2S2O3标准溶液vml (以上数据均已扣除干扰因素)。
测定过程中,发生的反应如下:
①Br2+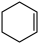 →
→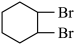
②
③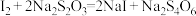
(5)样品中环己烯的质量分数为___________ (用字母表示)。
(6)下列情况会导致测定结果偏低的是____________ (填序号)。
a.样品中含有苯酚杂质
b.在测定过程中部分环己烯挥发
c. Na2S2O3标准溶液部分被氧化

回答下列问题:
Ⅰ.环己烯的制备与提纯
(1)原料环己醇中若含苯酚杂质,检验试剂为
(2)操作1的装置如图所示(加热和夹持装置已略去)。

①烧瓶A中进行的可逆反应化学方程式为
a.浓硫酸易使原料炭化并产生SO2
b. FeCl3•6H2O污染小、可循环使用,符合绿色化学理念
c.同等条件下,用FeCl3•6H2O比浓硫酸的平衡转化率高
②仪器B的作用为
(3)操作2用到的玻璃仪器是
(4)将操作3(蒸馏)的步骤补齐:安装蒸馏装置,加入待蒸馏的物质和沸石,
Ⅱ.环己烯含量的测定
在一定条件下,向ag环己烯样品中加入定量制得的bmolBr2,与环己烯充分反应后,剩余的Br2与足量KI作用生成I2,用cmol•L-1的Na2S2O3标准溶液滴定,终点时消耗Na2S2O3标准溶液vml (以上数据均已扣除干扰因素)。
测定过程中,发生的反应如下:
①Br2+
 →
→
②

③
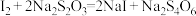
(5)样品中环己烯的质量分数为
(6)下列情况会导致测定结果偏低的是
a.样品中含有苯酚杂质
b.在测定过程中部分环己烯挥发
c. Na2S2O3标准溶液部分被氧化
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
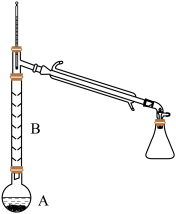
【推荐3】化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。某化学兴趣小组用氯气和金属铁反应制备无水三氯化铁,该化合物呈棕红色、易潮解(易与水反应生成氢氧化铁),受热易升华。装置如下:

(1)仪器a的名称是_______ 。
(2)A中反应的离子方程式是_______ ,D中反应的化学方程式是_______ 。
(3)反应开始时,先点燃_______ 处的酒精灯(填“A”或“D”)。
(4)若无B、C两装置,所得产物中可能含有的杂质是_______ (写化学式)。
(5)F中碱石灰的作用是_______ 。
(6)某学习小组用图E装置收集产品,其缺点为:_______ 。


(1)仪器a的名称是
(2)A中反应的离子方程式是
(3)反应开始时,先点燃
(4)若无B、C两装置,所得产物中可能含有的杂质是
(5)F中碱石灰的作用是
(6)某学习小组用图E装置收集产品,其缺点为:

您最近一年使用:0次



