电镀污泥中常含大量的铬(Cr),回收电镀污泥中的铬的方法很多。以电镀污泥[含Cr(OH)3及Al、Cu、Ni、Zn、Fe的金属阳离子等]为原料制备铬酸铅(PbCrO4)的某工艺流程如图:

已知:①"焙烧"后,Al、Zn的存在形式为NaAlO2、Na2ZnO2,Cu、Fe以最高价氧化物的形式存在。
②2CrO +2H+
+2H+ Cr2O
Cr2O +H2O。
+H2O。
③当溶液的pH为6~7时,铅主要以铅离子形式存在;氢氧化锌和氢氧化铝均为两性氢氧化物,相关数据如下:
回答下列问题:
(1)"焙烧"时,Cr(OH)3发生反应的化学方程式为__ ,反应中被还原的元素与被氧化的元素的质量之比为__ 。
(2)"浸取"时不选用NaOH溶液浸取的原因为__ 。
(3)“过滤Ⅰ”后为了防止铬的流失需洗涤"滤渣Ⅰ",并将洗涤液与滤液合并,实验室洗涤的具体操作为___ ,洗涤后的"滤查Ⅰ"中,含NiO、__ (填化学式)。
(4)“除铝和锌"时,为了较好地达到目的,该步骤应注意__ 。
(5)向“滤液2”中加稀盐酸的目的是__ 。
(6)"过液3"中存在的金属阳离子主要为要为__ (填离子符号)。

已知:①"焙烧"后,Al、Zn的存在形式为NaAlO2、Na2ZnO2,Cu、Fe以最高价氧化物的形式存在。
②2CrO
 +2H+
+2H+ Cr2O
Cr2O +H2O。
+H2O。③当溶液的pH为6~7时,铅主要以铅离子形式存在;氢氧化锌和氢氧化铝均为两性氢氧化物,相关数据如下:
| 金属阳离子 | 完全沉淀pH | 沉淀开始溶解pH |
| 锌离子 | 8.0 | 10.5 |
| 铝离子 | 5.2 | 7.8 |
回答下列问题:
(1)"焙烧"时,Cr(OH)3发生反应的化学方程式为
(2)"浸取"时不选用NaOH溶液浸取的原因为
(3)“过滤Ⅰ”后为了防止铬的流失需洗涤"滤渣Ⅰ",并将洗涤液与滤液合并,实验室洗涤的具体操作为
(4)“除铝和锌"时,为了较好地达到目的,该步骤应注意
(5)向“滤液2”中加稀盐酸的目的是
(6)"过液3"中存在的金属阳离子主要为要为
更新时间:2020-11-03 03:23:40
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】研究化学反应原理对生产、生活及环境保护具有重要意义。请回答下列问题:
(1)燃煤会产生CO2、CO、SO2等大气污染物。燃煤脱硫的相关反应的热化学方程式如下:
反应I:CaO(s)+3CO(g)+SO2(g) CaS(S)+3CO2(g) △H1=-455.8kJ·mol-1
CaS(S)+3CO2(g) △H1=-455.8kJ·mol-1
反应Ⅱ:CaSO4(s)+4CO(g) CaS(s)+4CO2(g) △H2=-174.4kJ·mol-1
CaS(s)+4CO2(g) △H2=-174.4kJ·mol-1
计算反应CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g)∆H=
CaO(s)+SO2(g)+CO2(g)∆H=__ 。
(2)甲醇是重要的化工原料,又可作燃料,工业上可利用CO2来生产燃料甲醇。已知制备甲醇的有关反应的化学方程式及其在不同温度下的化学平衡常数如表所示:
①500℃时测得反应i在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度分别为1mol·L-1、0.1mol·L-1、0.3mol·L-1、0.15mol·L-1,则此时v(正)__ (填“>”“=”或“<”)v(逆)。
②下列措施能使反应i的平衡体系中n(CH3OH)增大的__ (填序号)。
A.将H2O(g)从体系中分离出去 B.恒容时充人He(g),使体系压强增大
C.升高温度 D.恒容时再充入1molH2(g)
③如图是二氧化碳合成CH3OH反应中温度对CH3OH、CO的产率影响曲线,700℃时副反应ii的平衡常数__ 1(填“>”或“<”)。增大反应体系的压强,合成甲醇的反应速率__ (填“增大”“减小”或“不变”)。

(3)利用“Na—CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na—CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2 2Na2CO3+C。放电时该电池吸入CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池吸入CO2,其工作原理如图所示:

已知:碳酸钠在该电解质中不溶解,若生成的Na2CO3和C全部沉积在电极表面,则放电时正极的电极反应式为___ 。
(1)燃煤会产生CO2、CO、SO2等大气污染物。燃煤脱硫的相关反应的热化学方程式如下:
反应I:CaO(s)+3CO(g)+SO2(g)
 CaS(S)+3CO2(g) △H1=-455.8kJ·mol-1
CaS(S)+3CO2(g) △H1=-455.8kJ·mol-1反应Ⅱ:CaSO4(s)+4CO(g)
 CaS(s)+4CO2(g) △H2=-174.4kJ·mol-1
CaS(s)+4CO2(g) △H2=-174.4kJ·mol-1计算反应CaSO4(s)+CO(g)
 CaO(s)+SO2(g)+CO2(g)∆H=
CaO(s)+SO2(g)+CO2(g)∆H=(2)甲醇是重要的化工原料,又可作燃料,工业上可利用CO2来生产燃料甲醇。已知制备甲醇的有关反应的化学方程式及其在不同温度下的化学平衡常数如表所示:
| 化学反应 | 化学平衡常数 | 温度(℃) | ||
| 500 | 700 | 800 | ||
i.3H2(g)+CO2(g) CH3OH(g)+H2O(g) △H1 CH3OH(g)+H2O(g) △H1 | K1 | 2.5 | 0.58 | 0.38 |
ii.H2(g)+CO2(g) H2O(g)+CO(g) △H2 H2O(g)+CO(g) △H2 | K2 | 1 | ||
①500℃时测得反应i在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度分别为1mol·L-1、0.1mol·L-1、0.3mol·L-1、0.15mol·L-1,则此时v(正)
②下列措施能使反应i的平衡体系中n(CH3OH)增大的
A.将H2O(g)从体系中分离出去 B.恒容时充人He(g),使体系压强增大
C.升高温度 D.恒容时再充入1molH2(g)
③如图是二氧化碳合成CH3OH反应中温度对CH3OH、CO的产率影响曲线,700℃时副反应ii的平衡常数

(3)利用“Na—CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na—CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2
 2Na2CO3+C。放电时该电池吸入CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池吸入CO2,其工作原理如图所示:
已知:碳酸钠在该电解质中不溶解,若生成的Na2CO3和C全部沉积在电极表面,则放电时正极的电极反应式为
您最近一年使用:0次
【推荐2】李克强总理在十二届全国人大五次会议上作政府工作报告时强调,坚决打好蓝天保卫战。今年二氧化硫、氮氧化物排放量要分别下降3%,重点地区细颗粒物(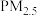 )浓度明显下降。其中二氧化硫、氮氧化物等的排放与工业燃烧煤、石油等化石燃料有很大的关系,所以对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
)浓度明显下降。其中二氧化硫、氮氧化物等的排放与工业燃烧煤、石油等化石燃料有很大的关系,所以对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
I.脱硝:
(1)催化剂存在下, 还原
还原 生成水蒸气和另一种无毒气体的化学方程式为
生成水蒸气和另一种无毒气体的化学方程式为_______
II.脱碳:一定条件下 会和
会和 反应合成
反应合成 。方程式为:
。方程式为: 。现向
。现向 恒容密闭容器中加入
恒容密闭容器中加入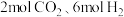 ,在恒温下发生反应。后反应达到平衡,此时容器内
,在恒温下发生反应。后反应达到平衡,此时容器内 的浓度为
的浓度为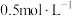 ,请回答以下问题:
,请回答以下问题:
(2)前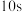 内的平均反应速率
内的平均反应速率
_______ 。
(3)下列叙述能说明原反应达到平衡状态的是_______ 。
a.单位时间内消耗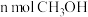 的同时生成
的同时生成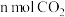
b.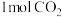 生成的同时有
生成的同时有 键断裂
键断裂
c. 和
和 的浓度保持不变
的浓度保持不变
d.容器内压强保持不变
e. 和
和 的物质的量之比保持不变
的物质的量之比保持不变
III.脱硫:燃煤的烟气脱硫技术是当前应用最广、效率最高的脱硫技术。其更多的是利用碱溶液与烟道气相遇,烟道气中 溶解在水中,形成一种稀酸溶液,然后与
溶解在水中,形成一种稀酸溶液,然后与 浊液等发生中和反应。
浊液等发生中和反应。
(4)已知中和反应为常见的放热反应,下列有关反应放热、吸热的说法正确的是_______
a.可燃物燃烧一般都需要加热,所以都是吸热反应
b.化学键的断裂要吸收能量
c.当反应物的总能量低于生成物的总能量时,据能量守恒定律可知反应会放热
d.已知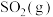 与
与 反应生成
反应生成 为放热反应,则
为放热反应,则 分解生成
分解生成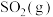 与
与 的反应为吸热反应
的反应为吸热反应
(5)请写出脱硫过程发生的主要化学方程式:_______
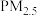 )浓度明显下降。其中二氧化硫、氮氧化物等的排放与工业燃烧煤、石油等化石燃料有很大的关系,所以对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
)浓度明显下降。其中二氧化硫、氮氧化物等的排放与工业燃烧煤、石油等化石燃料有很大的关系,所以对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。I.脱硝:
(1)催化剂存在下,
 还原
还原 生成水蒸气和另一种无毒气体的化学方程式为
生成水蒸气和另一种无毒气体的化学方程式为II.脱碳:一定条件下
 会和
会和 反应合成
反应合成 。方程式为:
。方程式为: 。现向
。现向 恒容密闭容器中加入
恒容密闭容器中加入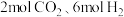 ,在恒温下发生反应。后反应达到平衡,此时容器内
,在恒温下发生反应。后反应达到平衡,此时容器内 的浓度为
的浓度为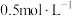 ,请回答以下问题:
,请回答以下问题:(2)前
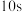 内的平均反应速率
内的平均反应速率
(3)下列叙述能说明原反应达到平衡状态的是
a.单位时间内消耗
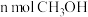 的同时生成
的同时生成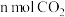
b.
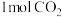 生成的同时有
生成的同时有 键断裂
键断裂c.
 和
和 的浓度保持不变
的浓度保持不变d.容器内压强保持不变
e.
 和
和 的物质的量之比保持不变
的物质的量之比保持不变III.脱硫:燃煤的烟气脱硫技术是当前应用最广、效率最高的脱硫技术。其更多的是利用碱溶液与烟道气相遇,烟道气中
 溶解在水中,形成一种稀酸溶液,然后与
溶解在水中,形成一种稀酸溶液,然后与 浊液等发生中和反应。
浊液等发生中和反应。(4)已知中和反应为常见的放热反应,下列有关反应放热、吸热的说法正确的是
a.可燃物燃烧一般都需要加热,所以都是吸热反应
b.化学键的断裂要吸收能量
c.当反应物的总能量低于生成物的总能量时,据能量守恒定律可知反应会放热
d.已知
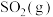 与
与 反应生成
反应生成 为放热反应,则
为放热反应,则 分解生成
分解生成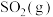 与
与 的反应为吸热反应
的反应为吸热反应(5)请写出脱硫过程发生的主要化学方程式:
您最近一年使用:0次
【推荐3】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:
已知:H2的燃烧热为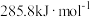
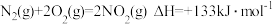
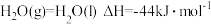
(1)催化剂存在下,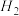 还原NO2生成水蒸气和其他无毒物质的热化学方程式为
还原NO2生成水蒸气和其他无毒物质的热化学方程式为___________ 。
Ⅱ.脱碳:
(2)向2L密闭容器中加入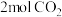 和
和 ,在适当的催化剂作用下,发生反应:
,在适当的催化剂作用下,发生反应: 。
。
①该反应自发进行的条件是___________ (填“低温”“高温”或“任意温度”)。
②下列叙述能说明此反应达到平衡状态的是___________ (填字母)。
a.混合气体的平均相对分子质量保持不变b. 和H2的体积分数保持不变
和H2的体积分数保持不变
c. 和H2的转化率相等d.混合气体的密度保持不变
和H2的转化率相等d.混合气体的密度保持不变
e. 生成的同时有
生成的同时有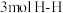 键断裂
键断裂
③ 的浓度随时间(
的浓度随时间( )变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出
)变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出 时间段
时间段 浓度随时间的变化。
浓度随时间的变化。___________

(3)改变温度,使反应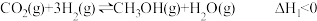 中的所有物质都为气态。起始温度、体积相同(T1℃、2密闭容器)。反应过程中部分数据见下表:
中的所有物质都为气态。起始温度、体积相同(T1℃、2密闭容器)。反应过程中部分数据见下表:
①达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(Ⅰ)___________ K(Ⅱ)(填“>”“<”或“=”,下同);平衡时 的浓度c(Ⅰ)
的浓度c(Ⅰ)___________ c(Ⅱ)。
②对反应Ⅰ,前10min内的平均反应速率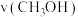 =
=___________ ;在其他条件不变的情况下,若30min时只改变温度至T2℃,此时 的物质的量为3.2mol,则T1
的物质的量为3.2mol,则T1___________ (填“>”<”或“=”) T2。若30min时只向容器中再充入 和
和 ,则平衡
,则平衡___________ (填“正向”“逆向”或“不”)移动。
Ⅰ.脱硝:
已知:H2的燃烧热为
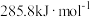
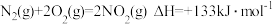
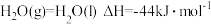
(1)催化剂存在下,
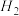 还原NO2生成水蒸气和其他无毒物质的热化学方程式为
还原NO2生成水蒸气和其他无毒物质的热化学方程式为Ⅱ.脱碳:
(2)向2L密闭容器中加入
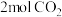 和
和 ,在适当的催化剂作用下,发生反应:
,在适当的催化剂作用下,发生反应: 。
。①该反应自发进行的条件是
②下列叙述能说明此反应达到平衡状态的是
a.混合气体的平均相对分子质量保持不变b.
 和H2的体积分数保持不变
和H2的体积分数保持不变c.
 和H2的转化率相等d.混合气体的密度保持不变
和H2的转化率相等d.混合气体的密度保持不变e.
 生成的同时有
生成的同时有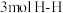 键断裂
键断裂③
 的浓度随时间(
的浓度随时间( )变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出
)变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出 时间段
时间段 浓度随时间的变化。
浓度随时间的变化。
(3)改变温度,使反应
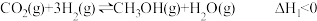 中的所有物质都为气态。起始温度、体积相同(T1℃、2密闭容器)。反应过程中部分数据见下表:
中的所有物质都为气态。起始温度、体积相同(T1℃、2密闭容器)。反应过程中部分数据见下表:| 反应时间(min) |  (mol) (mol) |  (mol) (mol) |  (mol) (mol) |  (mol) (mol) | |
| 反应Ⅰ:恒温恒容 | 0 | 2 | 6 | 0 | 0 |
| 10 | 4.5 | ||||
| 20 | 1 | ||||
| 30 | 1 | ||||
| 反应Ⅱ:绝热恒容 | 0 | 0 | 0 | 2 | 2 |
①达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(Ⅰ)
 的浓度c(Ⅰ)
的浓度c(Ⅰ)②对反应Ⅰ,前10min内的平均反应速率
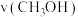 =
= 的物质的量为3.2mol,则T1
的物质的量为3.2mol,则T1 和
和 ,则平衡
,则平衡
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
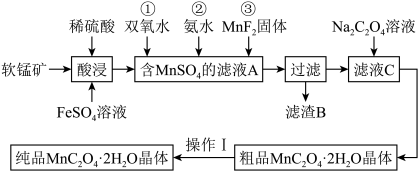
【推荐1】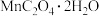 是一种常见的化学试剂,是制备其他含锰化合物的重要原料。某课外化学兴趣小组利用软锰矿
是一种常见的化学试剂,是制备其他含锰化合物的重要原料。某课外化学兴趣小组利用软锰矿 主要成分为
主要成分为 ,含少量
,含少量 、
、 和
和 制备
制备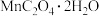 ,设计流程如图:
,设计流程如图: 注:试剂①②③按编号顺序加入
注:试剂①②③按编号顺序加入
已知:常温时部分难溶化合物的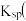 近似值
近似值 如表:
如表:
(1)该小组同学在酸浸之前,先将软锰矿粉碎,其目的是________ 。
(2)“酸浸”过程中 发生反应的离子方程式为
发生反应的离子方程式为________ 。
(3)加入 固体的作用是
固体的作用是________ ,甲同学提出将上述流程中的氨水换成氢氧化钠溶液,乙同学觉得不妥,乙同学的理由是________ 。
(4)丙同学认为向滤液C中滴加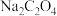 溶液的过程中可能会生成
溶液的过程中可能会生成 沉淀,并提出可能的原因为
沉淀,并提出可能的原因为 ,常温时,该反应的平衡常数
,常温时,该反应的平衡常数
________  填数值
填数值 。
。 已知
已知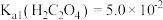 ,
,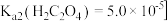 。
。
(5)操作Ⅰ的名称为________ 。
(6)如图是小组同学将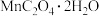 晶体放在坩埚里加热分解时,固体失重质量分数随温度
晶体放在坩埚里加热分解时,固体失重质量分数随温度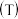 变化的曲线
变化的曲线 已知草酸锰不稳定,但其中锰元素的化合价在
已知草酸锰不稳定,但其中锰元素的化合价在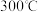 以下不变
以下不变 。
。
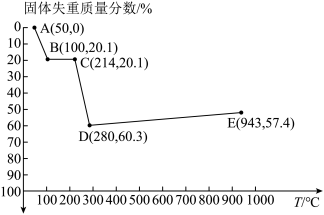
试根据各点的坐标 近似值
近似值 回答下列问题:
回答下列问题:
① 的化学方程式为
的化学方程式为________ 。
②从D点到E点过程中固体失重的质量分数下降的原因是________ 。
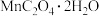 是一种常见的化学试剂,是制备其他含锰化合物的重要原料。某课外化学兴趣小组利用软锰矿
是一种常见的化学试剂,是制备其他含锰化合物的重要原料。某课外化学兴趣小组利用软锰矿 主要成分为
主要成分为 ,含少量
,含少量 、
、 和
和 制备
制备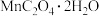 ,设计流程如图:
,设计流程如图: 注:试剂①②③按编号顺序加入
注:试剂①②③按编号顺序加入

已知:常温时部分难溶化合物的
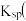 近似值
近似值 如表:
如表:| 物质 | 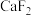 |  | 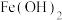 | 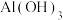 | 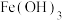 |
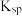 | 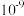 |  | 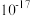 |  | 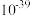 |
(2)“酸浸”过程中
 发生反应的离子方程式为
发生反应的离子方程式为(3)加入
 固体的作用是
固体的作用是(4)丙同学认为向滤液C中滴加
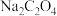 溶液的过程中可能会生成
溶液的过程中可能会生成 沉淀,并提出可能的原因为
沉淀,并提出可能的原因为 ,常温时,该反应的平衡常数
,常温时,该反应的平衡常数
 填数值
填数值 。
。 已知
已知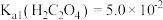 ,
,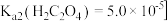 。
。(5)操作Ⅰ的名称为
(6)如图是小组同学将
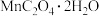 晶体放在坩埚里加热分解时,固体失重质量分数随温度
晶体放在坩埚里加热分解时,固体失重质量分数随温度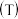 变化的曲线
变化的曲线 已知草酸锰不稳定,但其中锰元素的化合价在
已知草酸锰不稳定,但其中锰元素的化合价在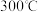 以下不变
以下不变 。
。
试根据各点的坐标
 近似值
近似值 回答下列问题:
回答下列问题:①
 的化学方程式为
的化学方程式为②从D点到E点过程中固体失重的质量分数下降的原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】由硫铁矿“烧渣”(主要成分:Fe3O4、Fe2O3和FeO)制备绿矾(FeSO4·7H2O))的流程如图:
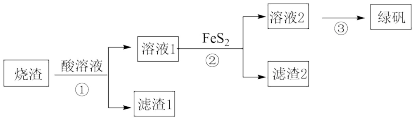
已知:①FeS2(S的化合价为-1)难溶于水。②FeS2+7Fe2(SO4)3+8H2O =15FeSO4+8H2SO4
(1)①中加入的酸为________ ,滤渣2的主要成分是 __________ 。
(2)①中生成Fe3+的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O、___________ 。
(3)检验②中Fe3+已经完全转化成Fe2+的实验方法:取适量溶液2,________ 。
(4)通过③得到绿矾晶体的实验操作:____________ 、过滤、洗涤、干燥。

已知:①FeS2(S的化合价为-1)难溶于水。②FeS2+7Fe2(SO4)3+8H2O =15FeSO4+8H2SO4
(1)①中加入的酸为
(2)①中生成Fe3+的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O、
(3)检验②中Fe3+已经完全转化成Fe2+的实验方法:取适量溶液2,
(4)通过③得到绿矾晶体的实验操作:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】信息时代给人们的生活带来了极大的便利,但同时也产生了大量的电子垃圾。某化学兴趣小组将一批废弃的线路板简单处理后,得到了主要含Cu、Al及少量Fe、Au等金属的混合物,并设计了如下制备硫酸铜晶体和硫酸铝晶体的路线:

部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)过滤操作中用到的玻璃仪器有___________________________ 。
(2)Cu可溶于稀硫酸与H2O2的混合溶液,其离子方程式是_____________ 。
(3)滤渣a的主要成分是______________ 。
(4)步骤③中X的取值范围是_____________ 。
(5)假设制得的CuSO4·5H2O中只含Na2SO4杂质,若用该样品进行“硫酸铜晶体结晶水含量的测定”实验,测得结晶水含量___________ (填“偏低”、“偏高”或“无影响”)。乙同学取1.280 g该样品,加热至恒重称得质量变为0.830 g,则此样品的纯度为___________ 。(用小数表示,保留三位有效数字)

部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 1.1 | 4.0 | 5.4 |
| 完全沉淀 | 3.2 | 5.2 | 6.7 |
(2)Cu可溶于稀硫酸与H2O2的混合溶液,其离子方程式是
(3)滤渣a的主要成分是
(4)步骤③中X的取值范围是
(5)假设制得的CuSO4·5H2O中只含Na2SO4杂质,若用该样品进行“硫酸铜晶体结晶水含量的测定”实验,测得结晶水含量
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】钯(Pd)是一种贵金属,性质类似铂(Pt)。活性炭载钯催化剂广泛应用于石油化工、制药等工业,但使用过程中因生成难溶于酸的PdO而失活。一种从废钯催化剂(杂质主要含有机物、活性炭、及少量Fe、Cu、Al等元素)中回收海绵钯的工艺流程如图:

已知:I.阴、阳离子交换树脂的基本工作原理分别为R-C1+M- R- M+Cl-;R-Na+N+
R- M+Cl-;R-Na+N+ R- N+Na+(R-表示树脂的有机成分)。
R- N+Na+(R-表示树脂的有机成分)。
II.“沉钯”时得到氯钯酸铵[(NH4)2PdCl4]固体,不溶于冷水,可溶于稀盐酸。
(1)“焙烧”的目的是___________ 。
(2)温度、固液比对浸取率的影响如图,则“浸取”的最佳条件为___________ 。

(3)“浸取”时,加入试剂A的目的为将焙烧过程中产生的PdO还原为Pd,若试剂A为甲酸,该反应的化学方程式为___________ 。
(4)“浸取”时,加入NaClO3有利于Pd的溶解,生成的四氯合钯(II)酸(H2PdCl4)为二元强酸。加入浓盐酸和NaClO3后主要反应的离子方程式:___________ 。
(5)“离子交换除杂”应使用___________ (填“阳离子”或“阴离子”)树脂,“洗脱”时应使用的洗脱液为___________ (填标号)。
A.硫酸B.盐酸C.无水乙醇
(6)“还原”过程N2H4转化为N2,在反应器出口处器壁内侧有白色晶体生成,该过程还产生的副产物为___________ ,且该产物可循环利用至___________ 环节(填环节名称)。
(7)PdO晶体属于四方晶系,其结构示意图如下。

①若A1、A2的分数坐标分别为(0,0,0)、( ,
, ,
, ),则B的分数坐标为
),则B的分数坐标为___________ 。
②已知:NA为阿伏加德罗常数的值。晶胞底面是边长为apm的正方形,晶胞的密度为8.0g·cm-3,则晶胞的高为___________ 。pm (用含a、NA的式子表示,并化至最简)。

已知:I.阴、阳离子交换树脂的基本工作原理分别为R-C1+M-
 R- M+Cl-;R-Na+N+
R- M+Cl-;R-Na+N+ R- N+Na+(R-表示树脂的有机成分)。
R- N+Na+(R-表示树脂的有机成分)。II.“沉钯”时得到氯钯酸铵[(NH4)2PdCl4]固体,不溶于冷水,可溶于稀盐酸。
(1)“焙烧”的目的是
(2)温度、固液比对浸取率的影响如图,则“浸取”的最佳条件为

(3)“浸取”时,加入试剂A的目的为将焙烧过程中产生的PdO还原为Pd,若试剂A为甲酸,该反应的化学方程式为
(4)“浸取”时,加入NaClO3有利于Pd的溶解,生成的四氯合钯(II)酸(H2PdCl4)为二元强酸。加入浓盐酸和NaClO3后主要反应的离子方程式:
(5)“离子交换除杂”应使用
A.硫酸B.盐酸C.无水乙醇
(6)“还原”过程N2H4转化为N2,在反应器出口处器壁内侧有白色晶体生成,该过程还产生的副产物为
(7)PdO晶体属于四方晶系,其结构示意图如下。

①若A1、A2的分数坐标分别为(0,0,0)、(
 ,
, ,
, ),则B的分数坐标为
),则B的分数坐标为②已知:NA为阿伏加德罗常数的值。晶胞底面是边长为apm的正方形,晶胞的密度为8.0g·cm-3,则晶胞的高为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】以MnO2粉(含少量Fe3O4、CaO、MgO等杂质)和MnS(溶于酸,不溶于水)为原料制备MnSO4•H2O的过程如下:
(1)反应:将一定量MnO2粉和稀硫酸加入到如图所示实验装置的三颈烧瓶中,加热到90℃后开始加入MnS,并不断搅拌,充分反应。

①三颈烧瓶中MnO2与MnS反应转化为Mn2+和S的离子方程式为_____ 。
②装置X中是NaOH溶液,作用是_____ 。
(2)除杂。查阅资料可知:
I.常温下Ka(HF)=7.4×10-4。
II.常温下Ksp(CaF2)=2.7×10−11,Ksp(MgF2)=6.5×10−9。
将三颈烧瓶中的混合物过滤,加入MnF2将滤液中的Ca2+、Mg2+转化为沉淀除去。在Ca2+、Mg2+浓度相同的条件下,pH变化对钙镁去除率的影响如图所示。

Mg2+去除率曲线为_____ (填写“甲”或“乙”)。随pH减小,钙镁去除率下降的原因是_____ 。
(3)测定。准确称取0.3850gMnSO4•H2O样品置于锥形瓶中,加入H3PO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+,用0.1000mol•L-1硫酸亚铁铵[Fe(NH4)2(SO4)2]标准溶液滴定至终点(滴定过程中Mn3+被还原为Mn2+),消耗标准溶液20.00mL。计算MnSO4•H2O样品的纯度(请写出计算过程,注意计算结果的有效数字和题目一致)_____ 。
(1)反应:将一定量MnO2粉和稀硫酸加入到如图所示实验装置的三颈烧瓶中,加热到90℃后开始加入MnS,并不断搅拌,充分反应。

①三颈烧瓶中MnO2与MnS反应转化为Mn2+和S的离子方程式为
②装置X中是NaOH溶液,作用是
(2)除杂。查阅资料可知:
I.常温下Ka(HF)=7.4×10-4。
II.常温下Ksp(CaF2)=2.7×10−11,Ksp(MgF2)=6.5×10−9。
将三颈烧瓶中的混合物过滤,加入MnF2将滤液中的Ca2+、Mg2+转化为沉淀除去。在Ca2+、Mg2+浓度相同的条件下,pH变化对钙镁去除率的影响如图所示。

Mg2+去除率曲线为
(3)测定。准确称取0.3850gMnSO4•H2O样品置于锥形瓶中,加入H3PO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+,用0.1000mol•L-1硫酸亚铁铵[Fe(NH4)2(SO4)2]标准溶液滴定至终点(滴定过程中Mn3+被还原为Mn2+),消耗标准溶液20.00mL。计算MnSO4•H2O样品的纯度(请写出计算过程,注意计算结果的有效数字和题目一致)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】二氧化氯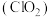 是一种高效消毒剂,易溶于水,沸点为11.0℃,浓度高时极易爆炸。
是一种高效消毒剂,易溶于水,沸点为11.0℃,浓度高时极易爆炸。
(1)实验室在60℃的条件下用闪锌矿(主要成份ZnS)与 溶液、
溶液、 溶液制备二氧化氯,同时生成硫酸锌。
溶液制备二氧化氯,同时生成硫酸锌。___________ 。
②用如图所示的装置制备二氧化氯。则闪锌矿、 溶液、
溶液、 溶液三种反应物的加料方式是
溶液三种反应物的加料方式是___________ 。
③若闪锌矿加料过量太多,生成 的量明显减少的原因是
的量明显减少的原因是___________ 。
④反应过程中通入 的作用是
的作用是___________ 。
(2)工业上常用ZnS去除废水中 。反应为
。反应为 ,该反应的平衡常数K的数值为
,该反应的平衡常数K的数值为___________ 。已知: ,
,
(3)某同学测定自来水厂经 处理后的水中
处理后的水中 的浓度。步骤如下:取水样1.0L,用稀硫酸调节溶液
的浓度。步骤如下:取水样1.0L,用稀硫酸调节溶液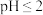 ,加入足量KI晶体,摇匀,在暗处静置30min。取20.00mL加入锥形瓶中,以淀粉溶液作指示剂,用0.0010
,加入足量KI晶体,摇匀,在暗处静置30min。取20.00mL加入锥形瓶中,以淀粉溶液作指示剂,用0.0010
 溶液滴定至终点(反应原理:
溶液滴定至终点(反应原理: ,
, 未配平),消耗
未配平),消耗 溶液10.00mL。则水样中
溶液10.00mL。则水样中 的浓度为
的浓度为___________  。
。
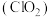 是一种高效消毒剂,易溶于水,沸点为11.0℃,浓度高时极易爆炸。
是一种高效消毒剂,易溶于水,沸点为11.0℃,浓度高时极易爆炸。(1)实验室在60℃的条件下用闪锌矿(主要成份ZnS)与
 溶液、
溶液、 溶液制备二氧化氯,同时生成硫酸锌。
溶液制备二氧化氯,同时生成硫酸锌。
②用如图所示的装置制备二氧化氯。则闪锌矿、
 溶液、
溶液、 溶液三种反应物的加料方式是
溶液三种反应物的加料方式是③若闪锌矿加料过量太多,生成
 的量明显减少的原因是
的量明显减少的原因是④反应过程中通入
 的作用是
的作用是(2)工业上常用ZnS去除废水中
 。反应为
。反应为 ,该反应的平衡常数K的数值为
,该反应的平衡常数K的数值为 ,
,
(3)某同学测定自来水厂经
 处理后的水中
处理后的水中 的浓度。步骤如下:取水样1.0L,用稀硫酸调节溶液
的浓度。步骤如下:取水样1.0L,用稀硫酸调节溶液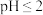 ,加入足量KI晶体,摇匀,在暗处静置30min。取20.00mL加入锥形瓶中,以淀粉溶液作指示剂,用0.0010
,加入足量KI晶体,摇匀,在暗处静置30min。取20.00mL加入锥形瓶中,以淀粉溶液作指示剂,用0.0010
 溶液滴定至终点(反应原理:
溶液滴定至终点(反应原理: ,
, 未配平),消耗
未配平),消耗 溶液10.00mL。则水样中
溶液10.00mL。则水样中 的浓度为
的浓度为 。
。
您最近一年使用:0次



