某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
请回答:
(1)根据上表中的实验数据,可以得到的结论是___________________________________ 。
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)=_____________________ 。
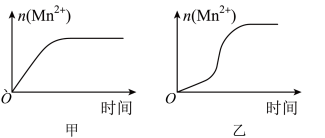
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图甲所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图乙所示。该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究。______________________________ 。
②请你帮助该小组同学完成实验方案,并填写表中空白。
③若该小组同学提出的假设成立,应观察到的现象是_____________________________ 。
【实验原理】2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液 颜色褪至无色 所需时间/min | |||
| 0.6 mol · L-1 H2C2O4溶液 | H2O | 0.2 mol · L-1 KMnO4溶液 | 3 mol · L-1 稀硫酸 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
(1)根据上表中的实验数据,可以得到的结论是
(2)利用实验1中数据计算,用KMnO4的浓度变化表示的反应速率v(KMnO4)=
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图甲所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图乙所示。该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究。
②请你帮助该小组同学完成实验方案,并填写表中空白。
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6mol/LH2C2O4溶液 | H2O | 0.2mol/LKMnO4溶液 | 3mol/L稀硫酸 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | t | |
③若该小组同学提出的假设成立,应观察到的现象是
11-12高二·安徽安庆·阶段练习 查看更多[11]
河南省南阳市邓州市第一高级中学校2023-2024学年高一下学期第一次月考化学试题B卷福建省福州重点中学2022-2023学年高一下学期期中考试化学试题(已下线)考点33 物质的定性与定量分析-备战2022年高考化学一轮复习考点帮(浙江专用)黑龙江省哈尔滨市宾县一中2020-2021学年高一下学期第二次月考化学试题安徽省黄山市屯溪第一中学、中科大附中2020-2021学年高一下学期期中联考化学试题山东省济宁市曲阜市第一中学2020-2021学年高二上学期阶段性检测(9月月考)化学试题高一必修第二册(人教2019版)第六章 第二节 化学反应的速率与限度 课时1 化学反应的速率河南省郑州市高新区一中2019-2020学年高二上学期期中考试化学试题【全国百强校】山东省济南外国语学校三箭分校2018-2019学年高二上学期期中考试化学试题湖南省醴陵二中、醴陵四中2017-2018学年高二上学期期中联考化学试题(已下线)2012-2013学年安徽省宿松县复兴中学高二第一次月考化学试卷
更新时间:2020-10-12 20:08:51
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】一种“碘钟实验”是将浓度均为 的
的 、
、 、
、 、
、 溶液及淀粉混合,一定时间后溶液变为蓝色。某小组同学在室温下对该实验原理进行探究。资料:该实验的总反应为
溶液及淀粉混合,一定时间后溶液变为蓝色。某小组同学在室温下对该实验原理进行探究。资料:该实验的总反应为 。反应分两步进行,第i步:
。反应分两步进行,第i步: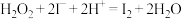 ,第ii步:
,第ii步:
(1)对于总反应, 的作用相当于
的作用相当于_______ ;
(2)为探究溶液变蓝快慢的影响因素,进行实验Ⅰ、实验Ⅱ(溶液浓度均为 )。
)。
①实验Ⅱ中,x、y、z所对应的数值分别是_______ ;
②对比实验Ⅰ、实验Ⅱ,可得出的实验结论是_______ 。
 的
的 、
、 、
、 、
、 溶液及淀粉混合,一定时间后溶液变为蓝色。某小组同学在室温下对该实验原理进行探究。资料:该实验的总反应为
溶液及淀粉混合,一定时间后溶液变为蓝色。某小组同学在室温下对该实验原理进行探究。资料:该实验的总反应为 。反应分两步进行,第i步:
。反应分两步进行,第i步: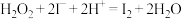 ,第ii步:
,第ii步:
(1)对于总反应,
 的作用相当于
的作用相当于(2)为探究溶液变蓝快慢的影响因素,进行实验Ⅰ、实验Ⅱ(溶液浓度均为
 )。
)。| 实验序号 |  溶液 溶液 |  溶液 溶液 |  溶液 溶液 |  溶液(含淀粉) 溶液(含淀粉) |  | 变蓝时间 |
| 实验Ⅰ |  | 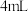 |  |  | 0 |  |
| 实验Ⅱ |  |  |  |  |  |  |
②对比实验Ⅰ、实验Ⅱ,可得出的实验结论是
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
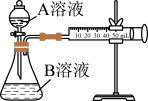
【推荐2】用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如表,(KMnO4溶液用稀硫酸酸化),实验装置如下图:
(1)该反应的离子方程式为_______
(2)该实验探究的是_______ 因素对化学反应速率的影响。
(3)若实验①在2min末收集了2.24mLCO2(标准状况下),则在2min末, =
=_______  。(假设混合溶液体积为50mL)
。(假设混合溶液体积为50mL)
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定_______ 来比较化学反应速率。(一条即可)
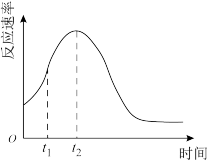
(5)小组同学发现反应速率随时间的变化如图所示,其中t1~t2时间内速率变快的主要原因可能是:_______ 。

| 实验序号 | A溶液 | B溶液 |
| ① | 20mL0.1 H2C2O4溶液 H2C2O4溶液 | 30mL0.0l KMnO4溶液 KMnO4溶液 |
| ② | 20mL0.2 H2C2O4溶液 H2C2O4溶液 | 30mL0.01 KMnO4溶液 KMnO4溶液 |
(2)该实验探究的是
(3)若实验①在2min末收集了2.24mLCO2(标准状况下),则在2min末,
 =
= 。(假设混合溶液体积为50mL)
。(假设混合溶液体积为50mL)(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定
(5)小组同学发现反应速率随时间的变化如图所示,其中t1~t2时间内速率变快的主要原因可能是:

您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】乙酸乙酯是重要化工原料,沸点约77 ℃。其水解反应方程式为CH3COOCH2CH3+H2O CH3COOH+CH3CH2OH。
CH3COOH+CH3CH2OH。
酸和碱均可用作该反应的催化剂。某兴趣小组对NaOH溶液催化乙酸乙酯水解进行了探究。
实验步骤:
向试管中加入8 mL NaOH溶液,再加入2 mL乙酸乙酯,用直尺量出乙酸乙酯的高度。再把试管放入70 ℃的水浴中,每隔1 min将其取出,振荡,静置,立即测量并记录剩余酯层的高度,再迅速放回水浴中继续加热,如此反复进行。改变NaOH溶液的浓度,重复实验。
数据记录:
乙酸乙酯水解后剩余的高度/mm
回答下列问题:
(1)完成上述对比实验时,每组实验都必须控制不变的因素有________ 、________ 、________ 、反应时间、试管规格、操作流程等;
(2)分析上述数据,得到乙酸乙酯水解速率的结论是:
①NaOH溶液浓度越大,水解速率越___________________________________ ;
②______________________________________________________________ ;
(3)结论②的理论解释是______________________________________________ ;
(4)欲使乙酸乙酯完全水解,可采取的措施是_____________________________________________ ;
(5)有同学认为有必要用蒸馏水代替NaOH溶液重复实验,对上述数据进行修正,主要原因是_______________________________________________________________ 。
 CH3COOH+CH3CH2OH。
CH3COOH+CH3CH2OH。酸和碱均可用作该反应的催化剂。某兴趣小组对NaOH溶液催化乙酸乙酯水解进行了探究。
实验步骤:
向试管中加入8 mL NaOH溶液,再加入2 mL乙酸乙酯,用直尺量出乙酸乙酯的高度。再把试管放入70 ℃的水浴中,每隔1 min将其取出,振荡,静置,立即测量并记录剩余酯层的高度,再迅速放回水浴中继续加热,如此反复进行。改变NaOH溶液的浓度,重复实验。
数据记录:
乙酸乙酯水解后剩余的高度/mm
组别 | c(NaOH)/ mol·L-1 | 时间/min | ||||||||
0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
1 | 0.5 | 10.0 | 9.0 | 8.0 | 7.5 | 7.0 | 6.5 | 6.5 | 6.5 | 6.5 |
2 | 1.0 | 10.0 | 8.5 | 7.0 | 6.0 | 5.0 | 4.5 | 4.5 | 4.5 | 4.5 |
3 | 2.0 | 10.0 | 8.0 | 6.0 | 4.5 | 3.0 | 2.0 | 1.5 | 1.5 | 1.5 |
(1)完成上述对比实验时,每组实验都必须控制不变的因素有
(2)分析上述数据,得到乙酸乙酯水解速率的结论是:
①NaOH溶液浓度越大,水解速率越
②
(3)结论②的理论解释是
(4)欲使乙酸乙酯完全水解,可采取的措施是
(5)有同学认为有必要用蒸馏水代替NaOH溶液重复实验,对上述数据进行修正,主要原因是
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】CH4既是一种重要的能源,也是一种重要的化工原料。
(1)甲烷的结构式为________
(2)甲烷高温分解生成氢气和碳。在密闭容器中进行此反应时要通入适量空气使部分甲烷燃烧,其目的是_________ 。
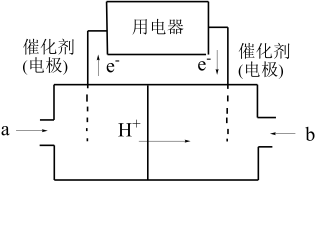
(3)以CH4为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理下图所示,则通入a气体的电极名称为_____ ,通入b气体的电极反应式_______ .(质子交换膜只允许H+通过)
(4)在一定温度和催化剂作用下,CH4与CO2可直接转化成乙酸,这是实现“减排”的一种研究方向。
①在不同温度下,催化剂的催化效率与乙酸的生成速率如下图所示,则该反应的最佳温度应控制在_________ 左右。

②该反应催化剂的有效成分为偏铝酸亚铜(CuAlO2,难溶物)。将CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,其离子方程式为_________
(5)CH4还原法是处理NOx气体的一种方法。已知一定条件下CH4与NOx反应转化为N2和CO2,若标准状况下8.96LCH4可处理22.4LNOx,则x值为________ .
(1)甲烷的结构式为
(2)甲烷高温分解生成氢气和碳。在密闭容器中进行此反应时要通入适量空气使部分甲烷燃烧,其目的是
(3)以CH4为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理下图所示,则通入a气体的电极名称为

(4)在一定温度和催化剂作用下,CH4与CO2可直接转化成乙酸,这是实现“减排”的一种研究方向。
①在不同温度下,催化剂的催化效率与乙酸的生成速率如下图所示,则该反应的最佳温度应控制在

②该反应催化剂的有效成分为偏铝酸亚铜(CuAlO2,难溶物)。将CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,其离子方程式为
(5)CH4还原法是处理NOx气体的一种方法。已知一定条件下CH4与NOx反应转化为N2和CO2,若标准状况下8.96LCH4可处理22.4LNOx,则x值为
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】某化学小组利用H2O2的分解探究外界条件对化学反应速率的影响。请回答下列问题:
(1)探究H2O2分解因素的实验方案和测得氧气的压强p(O2)如下:

①实验I和实验II探究目的是_______ ;相同条件下,实验I与实验II相比,实验_______ 的反应速率大。
②实验I和实验IV得出的结论是_______ 。
(2)为进一步研究催化剂对H2O2分解反应速率的影响,化学小组同学又做了下列实验:
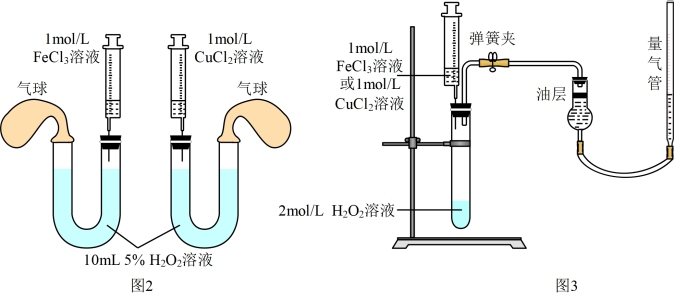
①定性研究:小组同学用图2装置进行实验,在注射器中分别加入相同体积的1mol/LFeCl3溶液和1 mol/L CuCl2溶液,可通过观察_______ ,确定反应速率的大小。某同学提出用相同体积1 mol/L CuSO4溶液代替1 mol/L CuCl2溶液做实验,你认为是否合理及理由是_______ 。
②定量研究:为了更精确地研究催化剂对反应速率的影响,小组同学利用图3装置进行定量实验。向大试管中加入100 mL 2 mol/L的H2O2溶液,向注射器中分别加入1 mL 1 mol/L CuCl2溶液和1 mL 1 mol/L FeCl3溶液,平行进行两次实验,测定的数据是_______ ,比较催化剂对反应速率的影响。若5min末得到气体1. 12 L(已换算为标准状况,溶液体积按100 mL计算),则H2O2的分解速率为_______ 。
(1)探究H2O2分解因素的实验方案和测得氧气的压强p(O2)如下:

| 实验序号 | 实验方案 |
| I | 25°C,10 mL 5% H2O2溶液 |
| II | 50°C,10 mL 5% H2O2溶液 |
| III | 25°C,10 mL 30% H2O2溶液 |
| IV | 25°C,少量MnO2, 10 mL 5% H2O2溶液 |
②实验I和实验IV得出的结论是
(2)为进一步研究催化剂对H2O2分解反应速率的影响,化学小组同学又做了下列实验:

①定性研究:小组同学用图2装置进行实验,在注射器中分别加入相同体积的1mol/LFeCl3溶液和1 mol/L CuCl2溶液,可通过观察
②定量研究:为了更精确地研究催化剂对反应速率的影响,小组同学利用图3装置进行定量实验。向大试管中加入100 mL 2 mol/L的H2O2溶液,向注射器中分别加入1 mL 1 mol/L CuCl2溶液和1 mL 1 mol/L FeCl3溶液,平行进行两次实验,测定的数据是
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】学习了元素周期律后,同学们对第四周期过渡元素氧化物产生了浓厚的兴趣。是否只有二氧化锰能催化氯酸钾受热分解?氧化铁、氧化铜、氧化铬等对氯酸钾的受热分解有没有催化作用?对此他们进行了实验探究。请你根据要求完成下列部分实验报告。
(1)实验仪器及试剂:实验仪器:带铁夹的铁架台、带橡皮塞的导管、量气装置、过滤装置、电子天平、药匙、___ 、___ 、___ 等;
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾;
(2)实验步骤:略;
(3)实验数据:
(4)实验讨论:
a.在氧化物的回收过程中,要进行过滤操作,所用的玻璃仪器是玻璃棒、____ ;
b.实验编号3的实验中KClO3的分解率为____ %(保留一位小数);
c.在用Cr2O3做研究实验时,发现有黄绿色刺激性气味的气体产生,同时绿色的混合物变成了橘黄色,该刺激性气体是___ (填分子式),可用____ 试纸检验,上述异常现象产生的原因是____ ;
(5)实验结论:____ 。
(1)实验仪器及试剂:实验仪器:带铁夹的铁架台、带橡皮塞的导管、量气装置、过滤装置、电子天平、药匙、
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾;
(2)实验步骤:略;
(3)实验数据:
| 实验编号 | KClO3质量(g) | 氧化物化学式 | 氧化物质量(g) | 氧化物回收率 | 产生气体(mL)(已折算到标况) | 耗时(s) |
| 1 | 0.60 | 10 | 480 | |||
| 2 | 0.60 | MnO2 | 0.20 | 90% | 67.2 | 36.5 |
| 3 | 0.60 | CuO | 0.20 | 90% | 67.2 | 79.5 |
| 4 | 0.60 | Fe2O3 | 0.20 | 90% | 67.2 | 34.7 |
| 5 | 0.60 | Cr2O3 | 0.20 | 异常 | 67.2 | 188.3 |
(4)实验讨论:
a.在氧化物的回收过程中,要进行过滤操作,所用的玻璃仪器是玻璃棒、
b.实验编号3的实验中KClO3的分解率为
c.在用Cr2O3做研究实验时,发现有黄绿色刺激性气味的气体产生,同时绿色的混合物变成了橘黄色,该刺激性气体是
(5)实验结论:
您最近半年使用:0次



