用硫酸酸化的草酸(H2C2O4,二元弱酸)溶液能将KMnO4溶液中的MnO 转化为Mn2+。某化学小组研究发现,少量MnSO4可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
转化为Mn2+。某化学小组研究发现,少量MnSO4可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,请完成以下实验设计表。
表中a、b的值分别为a=__ 、b=__
(2)该反应的离子方程式为_______ 。
 转化为Mn2+。某化学小组研究发现,少量MnSO4可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
转化为Mn2+。某化学小组研究发现,少量MnSO4可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:(1)常温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,请完成以下实验设计表。
| 实验编号 | 温度 | 初始pH | 0.1mol/L 草酸溶液/mL | 0.01mol/L KMnO4溶液的体积/mL | 蒸馏水体积/mL | 数据(反应混合液褪色时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | 2 | 20 | 50 | 30 | t2 |
| ③ | 常温 | 2 | 40 | a | b | t3 |
(2)该反应的离子方程式为
更新时间:2020-12-04 08:46:18
|
【知识点】 浓度对化学反应速率的影响解读
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】某学习小组探究金属与不同酸反应的差异,以及影响反应速率的因素。
实验药品:1.0moL/L盐酸、2.0mol/L盐酸、1.0mol/L硫酸、2.0mol/L硫酸,相同大小的铝片和铝粉(金属表面氧化膜都已除去);每次实验各种酸的用量均为25.0mL,金属用量均为6.0g。
(1)帮助该组同学完成以上实验设计表。
(2)该小组同学在对比①和⑤实验时发现①的反应速率明显比⑤快,你能对问题原因作出哪些假设或猜想(列出一种即可)?________________________________________________________________ 。
实验药品:1.0moL/L盐酸、2.0mol/L盐酸、1.0mol/L硫酸、2.0mol/L硫酸,相同大小的铝片和铝粉(金属表面氧化膜都已除去);每次实验各种酸的用量均为25.0mL,金属用量均为6.0g。
(1)帮助该组同学完成以上实验设计表。
| 实验目的 | 实验编号 | 温度 | 金属铝形态 | 酸及浓度 |
| 1.实验①和②探究盐酸浓度对该反应速率的影响; 2.实验②和③探究 3.实验②和④探究金属规格(铝片,铝粉)对该反应速率的影响; 4.①和⑤实验探究铝与稀盐酸和稀硫酸反应的差异 | ① | 铝片 | ||
② | 30˚C | 铝片 | 1.0mol/L盐酸 | |
③ | 40˚C | 铝片 | 1.0mol/L盐酸 | |
④ | | 铝粉 | | |
⑤ | 30˚C | 铝片 | 1.0mol/L硫酸 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】某实验小组在不同温度下,用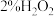 溶液与不同试剂混合,利用氧气传感器测定氧气全部放出所需时间,来探究影响H₃O₃分解的化学反应速率的因素,设计如下实验:
溶液与不同试剂混合,利用氧气传感器测定氧气全部放出所需时间,来探究影响H₃O₃分解的化学反应速率的因素,设计如下实验:
(1)从实验1、2、3可以得出,______ (填离子符号)促进 ,分解生成氧气;催化剂能增大化学反应速率的原因是
,分解生成氧气;催化剂能增大化学反应速率的原因是______ 。
(2)实验1设计的目的是______ 。
(3)实验______ (填实验序号)探究温度对 分解的影响。
分解的影响。
(4)由上述实验可知,酸______ (填“抑制”或“促进”) 分解。
分解。
(5)对于 分解反应,
分解反应, 也有一定的催化作用。为比较
也有一定的催化作用。为比较 和
和 对
对 分解的催化效果,研究小组设计了如图所示的实验。请回答相关问题:
分解的催化效果,研究小组设计了如图所示的实验。请回答相关问题:
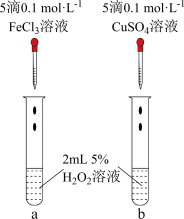
①可通过观察______ ,比较得出结论。
②若反应速率 ,有同学提出该实验不能说明
,有同学提出该实验不能说明 对
对 分解的催化效果一定比
分解的催化效果一定比 好。结合上表中的实验,你认为将
好。结合上表中的实验,你认为将______ 溶液改为______ 溶液更为合理。
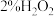 溶液与不同试剂混合,利用氧气传感器测定氧气全部放出所需时间,来探究影响H₃O₃分解的化学反应速率的因素,设计如下实验:
溶液与不同试剂混合,利用氧气传感器测定氧气全部放出所需时间,来探究影响H₃O₃分解的化学反应速率的因素,设计如下实验:| 实验序号 | 温度/℃ | 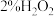 溶液的体积/mL 溶液的体积/mL | 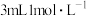 的试剂 的试剂 | 时间/s |
| 1 | 25 | 20.00 | KCl | 几乎不分解 |
| 2 | 25 | 20.00 | KI | 82 |
| 3 | 25 | 20.00 |  | 202 |
| 4 | 100 | 20.00 | KI | 65 |
| 5 | 25 | 20.00 | KI中通HCl气体,使其 | 几乎不分解 |
| 6 | 25 | 20.00 | KI中加入KOH固体,使其 | 75 |
(1)从实验1、2、3可以得出,
 ,分解生成氧气;催化剂能增大化学反应速率的原因是
,分解生成氧气;催化剂能增大化学反应速率的原因是(2)实验1设计的目的是
(3)实验
 分解的影响。
分解的影响。(4)由上述实验可知,酸
 分解。
分解。(5)对于
 分解反应,
分解反应, 也有一定的催化作用。为比较
也有一定的催化作用。为比较 和
和 对
对 分解的催化效果,研究小组设计了如图所示的实验。请回答相关问题:
分解的催化效果,研究小组设计了如图所示的实验。请回答相关问题:
①可通过观察
②若反应速率
 ,有同学提出该实验不能说明
,有同学提出该实验不能说明 对
对 分解的催化效果一定比
分解的催化效果一定比 好。结合上表中的实验,你认为将
好。结合上表中的实验,你认为将
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】近年来,我国化工技术获得重大突破,利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇(CH3OH)是其中的一个研究项目。该研究发生的主要反应如下:
Ⅰ.CO与H2反应合成甲醇:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
Ⅱ.CO2与H2反应合成甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
(1)上述反应符合原子经济性的是反应_______ (I或II)。
(2)在某一时刻采取下列措施,能使反应I的反应速率减小的措施是_______。
(3) 是大气污染物,同时也是重要的化工原料,可用于制备硫酸。回答下列问题:
是大气污染物,同时也是重要的化工原料,可用于制备硫酸。回答下列问题:
 在
在 作用下的催化氧化是工业上生产硫酸的主要反应,催化反应的机理如下。
作用下的催化氧化是工业上生产硫酸的主要反应,催化反应的机理如下。
第一步: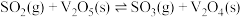
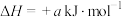
第二步: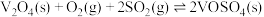
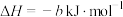
第三步: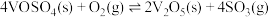
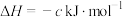
①写出 催化氧化的热化学方程式
催化氧化的热化学方程式_______ 。
②为研究①中 催化氧化的反应(
催化氧化的反应( ),某同学设计了如图三种已装固体
),某同学设计了如图三种已装固体 催化剂的密闭容器。
催化剂的密闭容器。

在初始体积与温度相同的条件下,甲、乙、丙中均按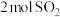 、
、 投料,达到平衡时,三个容器中
投料,达到平衡时,三个容器中 的转化率从大到小的顺序为
的转化率从大到小的顺序为_______ (用“甲、乙、丙”表示)。
(4)硝化法既能生产硫酸,也能处理 ,主要反应为
,主要反应为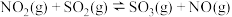
 。
。 时,向恒容密闭容器中加入等物质的量的
时,向恒容密闭容器中加入等物质的量的 和
和 ,达到平衡时NO和
,达到平衡时NO和 的物质的量浓度之比为
的物质的量浓度之比为 。
。 时,该反应的化学平衡常数为
时,该反应的化学平衡常数为_______ 。 时,向某容器中同时充入
时,向某容器中同时充入 、
、 、
、 、NO各1mol,则此时
、NO各1mol,则此时
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
Ⅰ.CO与H2反应合成甲醇:CO(g)+2H2(g)
 CH3OH(g)
CH3OH(g)Ⅱ.CO2与H2反应合成甲醇:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)(1)上述反应符合原子经济性的是反应
(2)在某一时刻采取下列措施,能使反应I的反应速率减小的措施是_______。
| A.恒温恒容下,再充入CO | B.升高温度 |
| C.恒温恒容下,向其中充入Ar | D.恒温恒压下,向其中充入Ar |
(3)
 是大气污染物,同时也是重要的化工原料,可用于制备硫酸。回答下列问题:
是大气污染物,同时也是重要的化工原料,可用于制备硫酸。回答下列问题: 在
在 作用下的催化氧化是工业上生产硫酸的主要反应,催化反应的机理如下。
作用下的催化氧化是工业上生产硫酸的主要反应,催化反应的机理如下。第一步:
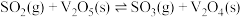
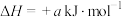
第二步:
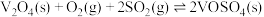
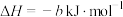
第三步:
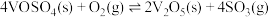
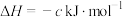
①写出
 催化氧化的热化学方程式
催化氧化的热化学方程式②为研究①中
 催化氧化的反应(
催化氧化的反应( ),某同学设计了如图三种已装固体
),某同学设计了如图三种已装固体 催化剂的密闭容器。
催化剂的密闭容器。
在初始体积与温度相同的条件下,甲、乙、丙中均按
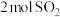 、
、 投料,达到平衡时,三个容器中
投料,达到平衡时,三个容器中 的转化率从大到小的顺序为
的转化率从大到小的顺序为(4)硝化法既能生产硫酸,也能处理
 ,主要反应为
,主要反应为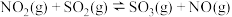
 。
。 时,向恒容密闭容器中加入等物质的量的
时,向恒容密闭容器中加入等物质的量的 和
和 ,达到平衡时NO和
,达到平衡时NO和 的物质的量浓度之比为
的物质的量浓度之比为 。
。 时,该反应的化学平衡常数为
时,该反应的化学平衡常数为 时,向某容器中同时充入
时,向某容器中同时充入 、
、 、
、 、NO各1mol,则此时
、NO各1mol,则此时
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
您最近一年使用:0次



