已知NO2和N2O4可以相互转化:2NO2(g)⇌N2O4(g) △H<0。现将一定量NO2和N2O4的混合气体通入一定体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。
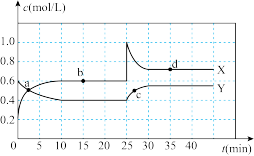
(1)图中共有两条曲线X和Y,其中曲线_______ 表示NO2浓度随时间的变化;a、b、c、d四个点中,表示化学反应处于平衡状态的点是_______ 。
(2)①前10min内用NO2表示的化学反应速率v(NO2)=_______ mol/(L·min)。
②15min时,反应2NO2(g)⇌N2O4(g)在b点的平衡常数Kb=_______ 。
③35min时,反应2NO2(g)⇌N2O4(g)在d点的平衡常数Kd_______ Kb(填“>”、“=”或“<”)。
(3)若要达到使NO2(s)的百分含量与d点相同的化学平衡状态,在25min时还可以采取的措施是_______ 。
A、加入催化剂 B、缩小容器体积 C、升高温度 D、加入一定量的N2O4

(1)图中共有两条曲线X和Y,其中曲线
(2)①前10min内用NO2表示的化学反应速率v(NO2)=
②15min时,反应2NO2(g)⇌N2O4(g)在b点的平衡常数Kb=
③35min时,反应2NO2(g)⇌N2O4(g)在d点的平衡常数Kd
(3)若要达到使NO2(s)的百分含量与d点相同的化学平衡状态,在25min时还可以采取的措施是
A、加入催化剂 B、缩小容器体积 C、升高温度 D、加入一定量的N2O4
更新时间:2020-12-29 09:09:40
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】(1)某反应过程中的能量变化如图所示:

写出该反应的热化学方程式:________________________________ 。
(2)合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
①该反应的化学平衡常数表达式为K=________ 。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值_______ 。(填“增大”“减小”)

写出该反应的热化学方程式:
(2)合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g)
 2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:①该反应的化学平衡常数表达式为K=
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】I、在一定体积的密闭容器中,进行如下化学反应: CO2(g)+H2(g)  CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K =___________ 。
(2)该反应为___________ 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是___________(多选扣分)。
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ___________ ℃。
II、 高炉炼铁中发生的基本反应之一如下:
FeO(g) +CO(g) Fe(g) + CO2(g) △H > 0,其平衡常数
Fe(g) + CO2(g) △H > 0,其平衡常数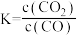 ,已知1100℃时,K=0.263。
,已知1100℃时,K=0.263。
(5)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO体积比值___________ (“增大”、“减小”或“不变”);平衡常数K值___________ (“增大”、“减小”或“不变”)。
(6)1100℃时测得高炉中,c(CO2)=0.025mol/L,c(CO)=0.1mol/L,在这种情况下,该反应是否处于化学平衡状态___________ (选“是”或“否”),此时V正___________ V逆 (选“ >”或“=” 或“<”) 。
 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K =
(2)该反应为
(3)能判断该反应是否达到化学平衡状态的依据是___________(多选扣分)。
| A.容器中压强不变 | B.混合气体中 c(CO)不变 |
| C.υ正(H2)=υ逆(H2O) | D.c(CO2)=c(CO) |
II、 高炉炼铁中发生的基本反应之一如下:
FeO(g) +CO(g)
 Fe(g) + CO2(g) △H > 0,其平衡常数
Fe(g) + CO2(g) △H > 0,其平衡常数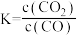 ,已知1100℃时,K=0.263。
,已知1100℃时,K=0.263。(5)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO体积比值
(6)1100℃时测得高炉中,c(CO2)=0.025mol/L,c(CO)=0.1mol/L,在这种情况下,该反应是否处于化学平衡状态
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】Ⅰ.现有下列仪器或用品:①铁架台(含铁圈、各式铁夹) ②锥形瓶 ③酸式滴定管和碱式滴定管 ④烧杯 ⑤玻璃棒 ⑥胶头滴管 ⑦天平(含砝码) ⑧滤纸 ⑨量筒 ⑩过滤漏斗;
现有下列药品:(A)NaOH固体 (B)标准NaOH溶液(C)未知浓度盐酸 (D)蒸馏水(E)碳酸钠溶液
根据所做过的学生实验,回答下列问题:
(1)过滤时,应选用的上述仪器是_________________________ (填编号)。
(2)配制一定物质的量浓度的NaOH溶液时,还缺少的仪器是__________ 。
(3)做酸碱中和滴定时,还缺乏的试剂是____________________ 。
(4)进行中和滴定时,绝不可用将要盛的溶液事先润洗的仪器是下列的______ (填编号)。甲.酸式滴定管 乙.碱式滴定管 丙.锥形瓶
(5)用标准的NaOH溶液滴定未知浓度的盐酸,选用酚酞作为指示剂,造成测定结果偏高的原因可能是______________ 。
A.配制标准溶液的NaOH中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
D.滴定前有气泡,滴定后气泡消失。
II. 甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
反应II:CO(g)+2H2(g) CH3OH(g) ΔH2
CH3OH(g) ΔH2
①反应I的平衡常数表达式为K=________________________
②下表所列数据是反应Ⅱ在不同温度下的化学平衡常数(K)
由表中数据判断ΔH2______ 0,ΔS______ 0 (填“>”、“=”或“<”=)。
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为________ 。
(2)已知在常温常压下,某实验小组依据甲醇燃烧的反应原理,设计如下图所示的电池装置:

①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH =-1275.6 kJ·mol-1
②H2O(g)=H2O(l) ΔH =-44.0 kJ·mol-1
①写出表示甲醇燃烧热的热化学方程式____________________ 。
②写出上图电池装置中负极反应式:________________________________ 。
现有下列药品:(A)NaOH固体 (B)标准NaOH溶液(C)未知浓度盐酸 (D)蒸馏水(E)碳酸钠溶液
根据所做过的学生实验,回答下列问题:
(1)过滤时,应选用的上述仪器是
(2)配制一定物质的量浓度的NaOH溶液时,还缺少的仪器是
(3)做酸碱中和滴定时,还缺乏的试剂是
(4)进行中和滴定时,绝不可用将要盛的溶液事先润洗的仪器是下列的
(5)用标准的NaOH溶液滴定未知浓度的盐酸,选用酚酞作为指示剂,造成测定结果偏高的原因可能是
A.配制标准溶液的NaOH中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
D.滴定前有气泡,滴定后气泡消失。
II. 甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1反应II:CO(g)+2H2(g)
 CH3OH(g) ΔH2
CH3OH(g) ΔH2①反应I的平衡常数表达式为K=
②下表所列数据是反应Ⅱ在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断ΔH2
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为
(2)已知在常温常压下,某实验小组依据甲醇燃烧的反应原理,设计如下图所示的电池装置:

①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH =-1275.6 kJ·mol-1
②H2O(g)=H2O(l) ΔH =-44.0 kJ·mol-1
①写出表示甲醇燃烧热的热化学方程式
②写出上图电池装置中负极反应式:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】现有可逆反应.2NO2(g) N2O4(g),△H<0,试根据下列图像,判断t2、t3、t4时刻采取的措施。
N2O4(g),△H<0,试根据下列图像,判断t2、t3、t4时刻采取的措施。
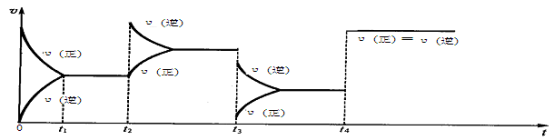
t2:_______________________________________________ ;
t3:_______________________________________________ ;
t4:_______________________________________________ 。
 N2O4(g),△H<0,试根据下列图像,判断t2、t3、t4时刻采取的措施。
N2O4(g),△H<0,试根据下列图像,判断t2、t3、t4时刻采取的措施。
t2:
t3:
t4:
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】钌( )为稀有元素,广泛应用于电子、航空航天、化工等领域。钌的矿产资源很少,故从含钌废料中回收钌的研究很有意义。某科研小组设计了一种从含钌废料中分离提纯钌的工艺,其流程如下:
)为稀有元素,广泛应用于电子、航空航天、化工等领域。钌的矿产资源很少,故从含钌废料中回收钌的研究很有意义。某科研小组设计了一种从含钌废料中分离提纯钌的工艺,其流程如下:

“滤渣”的主要成分为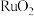 ,加入草酸的作用是
,加入草酸的作用是___________ ,金属钌与草酸的质量比x和反应温度T对钌的回收率的影响如图所示,则回收钌较为适宜的条件是___________ 。

 )为稀有元素,广泛应用于电子、航空航天、化工等领域。钌的矿产资源很少,故从含钌废料中回收钌的研究很有意义。某科研小组设计了一种从含钌废料中分离提纯钌的工艺,其流程如下:
)为稀有元素,广泛应用于电子、航空航天、化工等领域。钌的矿产资源很少,故从含钌废料中回收钌的研究很有意义。某科研小组设计了一种从含钌废料中分离提纯钌的工艺,其流程如下:
“滤渣”的主要成分为
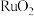 ,加入草酸的作用是
,加入草酸的作用是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】(1)密闭容器中mA(g)+nB(g) pC(g),反应达到平衡,经测定增大压强P时,A的转化率随P而变化的曲线如图。则:
pC(g),反应达到平衡,经测定增大压强P时,A的转化率随P而变化的曲线如图。则:
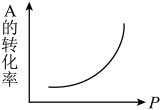
①增大压强,A的转化率___ 平衡向___ 移动,达到平衡后,混合物中C的浓度___ 。
②上述化学方程式中的系数m、n、p的正确关系是____ 。
③当降低温度时,C的浓度减小,正反应是___ 热反应。
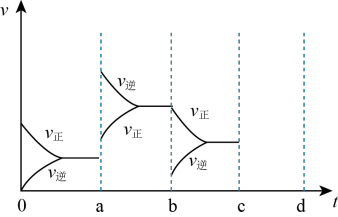
(2)如图表示在密闭容器中反应:2SO2(g)+O2(g) 2SO3(g)△H<0,达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a-b过程中改变的条件可能是
2SO3(g)△H<0,达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a-b过程中改变的条件可能是___ ;b-c过程中改变的条件可能是____ ;若增大压强时,反应速度变化情况画在c-d处。___
 pC(g),反应达到平衡,经测定增大压强P时,A的转化率随P而变化的曲线如图。则:
pC(g),反应达到平衡,经测定增大压强P时,A的转化率随P而变化的曲线如图。则:
①增大压强,A的转化率
②上述化学方程式中的系数m、n、p的正确关系是
③当降低温度时,C的浓度减小,正反应是
(2)如图表示在密闭容器中反应:2SO2(g)+O2(g)
 2SO3(g)△H<0,达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a-b过程中改变的条件可能是
2SO3(g)△H<0,达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a-b过程中改变的条件可能是
您最近一年使用:0次



