高锰酸钾(KMnO4)又名灰锰氧,在实验室、化工生产、医疗等领域有广泛的应用。某实验小组利用MnO2为原料,与KClO3和KOH共熔制得锰酸钾,再利用歧化法制备高锰酸钾。
实验原理:反应1:
反应2:3K2MnO4+4CH3COOH=2KMnO4+MnO2+4CH3COOK+2H2O
实验步骤:
Ⅰ.将2.5 g KClO3和5.2 g KOH倒入铁坩埚中,加热熔融后将3 g MnO2分多次加入并搅拌至干涸,继续加热5 min,得到墨绿色熔融物;
Ⅱ.将熔融物冷却后倒入盛有60 mL蒸馏水的烧杯中,控制反应温度在90℃,待固体溶解后滴加6.0 mol/L醋酸调节pH值,待反应完全后抽滤,得到初产品。回答下列问题:
(1)实验室常用高锰酸钾制O2,应选择下列哪套装置___
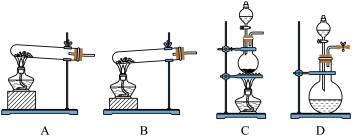
(2)①步骤Ⅰ中,墨绿色熔融物为___ (化学式)。
②反应1的化学方程式为___ 。
③铁坩埚不能换成瓷坩埚,原因是___ 。
(3)步骤Ⅱ中控制反应温度的方法是___ 。
(4)本实验采用6.0 mol/L醋酸来控制的pH值使锰酸钾发生歧化,用酸度计测得不同歧化酸度对高锰酸钾的产量、产率影响,结果如下表:
由表中数据得到结论____ 。
(5)为测定产品纯度,可取一定质量的KMnO4样品配成溶液,将其滴入2 mol/L硫酸酸化的Na2C2O4标准溶液中,滴定终点的判断是___ 。
实验原理:反应1:
反应2:3K2MnO4+4CH3COOH=2KMnO4+MnO2+4CH3COOK+2H2O
实验步骤:
Ⅰ.将2.5 g KClO3和5.2 g KOH倒入铁坩埚中,加热熔融后将3 g MnO2分多次加入并搅拌至干涸,继续加热5 min,得到墨绿色熔融物;
Ⅱ.将熔融物冷却后倒入盛有60 mL蒸馏水的烧杯中,控制反应温度在90℃,待固体溶解后滴加6.0 mol/L醋酸调节pH值,待反应完全后抽滤,得到初产品。回答下列问题:
(1)实验室常用高锰酸钾制O2,应选择下列哪套装置

(2)①步骤Ⅰ中,墨绿色熔融物为
②反应1的化学方程式为
③铁坩埚不能换成瓷坩埚,原因是
(3)步骤Ⅱ中控制反应温度的方法是
(4)本实验采用6.0 mol/L醋酸来控制的pH值使锰酸钾发生歧化,用酸度计测得不同歧化酸度对高锰酸钾的产量、产率影响,结果如下表:
| 实验编号 | pH值 | 产量/g | 平均产率/% |
| 1 | 11.04 | 2.06 | 56.5 |
| 2 | 10.50 | 2.24 | 61.7 |
| 3 | 10.00 | 2.33 | 64.2 |
| 4 | 9.50 | 2.13 | 58.6 |
| 5 | 9.04 | 1.86 | 51.3 |
(5)为测定产品纯度,可取一定质量的KMnO4样品配成溶液,将其滴入2 mol/L硫酸酸化的Na2C2O4标准溶液中,滴定终点的判断是
更新时间:2021-01-23 15:15:19
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
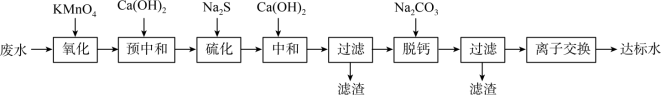
【推荐1】湿法炼锌的工业废水中主要阳离子有Zn2+、H+、Tl+、Tl3+,废水除铊的工艺流程如图。 能够在pH为0~14的范围内以离子态稳定存在,不易与
能够在pH为0~14的范围内以离子态稳定存在,不易与 形成沉淀。
形成沉淀。
②部分物质的 如表:
如表:
③排放标准:Tl的含量低于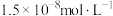 。
。
回答下列问题:
(1)Tl的原子序数为81,在元素周期表中的位置为___________ ,价电子排布式为___________ 。
(2)已知“氧化”步骤中 被还原为
被还原为 ,请写出该反应的离子方程式:
,请写出该反应的离子方程式:___________ ,反应后仍存在少量的 。
。
(3)“预中和”步骤中加入 至溶液的pH约为7,可减少“硫化”步骤中
至溶液的pH约为7,可减少“硫化”步骤中 的使用量,还能减少
的使用量,还能减少___________ (填化学式)污染物的生成。
(4)“硫化”步骤的主要目的是除去___________ (填离子符号)。
(5)在“中和”步骤中,若要使溶液中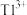 的含量低于排放标准,请根据
的含量低于排放标准,请根据 计算溶液的pH应大于
计算溶液的pH应大于___________ 。
(6)“离子交换”步骤中可用普鲁士蓝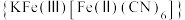 (其摩尔质量为
(其摩尔质量为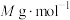 )中的
)中的 与残余铊离子进行离子交换,进一步实现废水中铊的去除。普鲁士蓝晶胞的如下[
与残余铊离子进行离子交换,进一步实现废水中铊的去除。普鲁士蓝晶胞的如下[ 未标出,其占据四个互不相邻的小立方体(晶胞的部分)的体心]。若该晶体的密度为
未标出,其占据四个互不相邻的小立方体(晶胞的部分)的体心]。若该晶体的密度为 ,则
,则 和
和 的最短距离为
的最短距离为___________ cm(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 能够在pH为0~14的范围内以离子态稳定存在,不易与
能够在pH为0~14的范围内以离子态稳定存在,不易与 形成沉淀。
形成沉淀。②部分物质的
 如表:
如表:| 物质 |  | 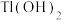 | ZnS |  |
 | 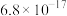 |  |  |  |
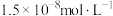 。
。回答下列问题:
(1)Tl的原子序数为81,在元素周期表中的位置为
(2)已知“氧化”步骤中
 被还原为
被还原为 ,请写出该反应的离子方程式:
,请写出该反应的离子方程式: 。
。(3)“预中和”步骤中加入
 至溶液的pH约为7,可减少“硫化”步骤中
至溶液的pH约为7,可减少“硫化”步骤中 的使用量,还能减少
的使用量,还能减少(4)“硫化”步骤的主要目的是除去
(5)在“中和”步骤中,若要使溶液中
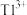 的含量低于排放标准,请根据
的含量低于排放标准,请根据 计算溶液的pH应大于
计算溶液的pH应大于(6)“离子交换”步骤中可用普鲁士蓝
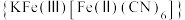 (其摩尔质量为
(其摩尔质量为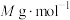 )中的
)中的 与残余铊离子进行离子交换,进一步实现废水中铊的去除。普鲁士蓝晶胞的如下[
与残余铊离子进行离子交换,进一步实现废水中铊的去除。普鲁士蓝晶胞的如下[ 未标出,其占据四个互不相邻的小立方体(晶胞的部分)的体心]。若该晶体的密度为
未标出,其占据四个互不相邻的小立方体(晶胞的部分)的体心]。若该晶体的密度为 ,则
,则 和
和 的最短距离为
的最短距离为 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。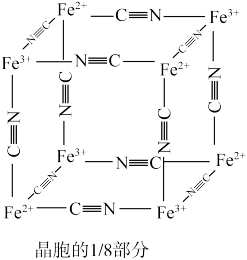
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】金属铝在酸性或碱性溶液中均可与NO 发生氧化还原反应,转化关系如下:
发生氧化还原反应,转化关系如下:
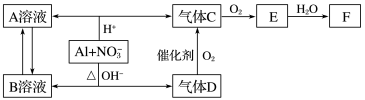
已知,气体D的大量生产曾经解决了地球上因粮食不足而导致的饥饿和死亡问题,气体D和F反应可生成盐。气体D和A溶液反应生成白色沉淀。气体C为无色气体,气体E为红棕色气体。B溶液加入过量的F溶液能生成A溶液。请回答下列问题:
(1)C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C、E转化为无毒的气态单质,该单质为________________________ 。
(2)完成并配平下列离子方程式:______Al+______ +______H+→____Al3++______+_____H2O,
+______H+→____Al3++______+_____H2O,______ 。
(3)D→C反应的化学方程式是________________________ 。
(4)除去气体C中的杂质气体E的化学方法:________________________ (用化学方程式表示)。
 发生氧化还原反应,转化关系如下:
发生氧化还原反应,转化关系如下:
已知,气体D的大量生产曾经解决了地球上因粮食不足而导致的饥饿和死亡问题,气体D和F反应可生成盐。气体D和A溶液反应生成白色沉淀。气体C为无色气体,气体E为红棕色气体。B溶液加入过量的F溶液能生成A溶液。请回答下列问题:
(1)C、E排入大气中会造成大气污染,在催化剂存在下,D可以将C、E转化为无毒的气态单质,该单质为
(2)完成并配平下列离子方程式:______Al+______
 +______H+→____Al3++______+_____H2O,
+______H+→____Al3++______+_____H2O,(3)D→C反应的化学方程式是
(4)除去气体C中的杂质气体E的化学方法:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】铜器久置,表面会生成一层绿色固体,某化学兴趣小组收集家中铜器表面的绿色固体进行探究。查阅相关资料后,得知该绿色物质是碱式碳酸铜。该小组同学利用如图装置进行实验,探究碱式碳酸铜的分解产物。

①对试管内的绿色固体进行加热至完全分解,观察到A装置中绿色固体逐渐变成黑色,B装置中无水硫酸铜变成蓝色,C装置中澄清石灰水变浑浊。
②取少量加热后生成的黑色固体于试管中,加入稀盐酸。观察到黑色固体逐渐溶解,溶液变成蓝色。
③取少量上述蓝色溶液于试管中,浸入一根洁净的铁丝。观察到铁丝表面有红色物质析出。
请回答下列问题:
(1)加热后试管中剩余的黑色物质是_______________________________________________ 。
(2)写出该绿色物质受热分解的化学方程式:________________________________________________________________ 。
(3)上述实验步骤③中反应的离子方程式为_________________________________________________________________ 。
(4)实验装置最后的干燥管的作用是_____________________________________________________________________________________ 。
(5)已知:
若提供的药品有:Cl2、浓硫酸、NaOH溶液、CuO、Cu,试结合题给表格,简述除去步骤③溶液中Fe2+的实验步骤:_____________________________________________________________________________________ 。

①对试管内的绿色固体进行加热至完全分解,观察到A装置中绿色固体逐渐变成黑色,B装置中无水硫酸铜变成蓝色,C装置中澄清石灰水变浑浊。
②取少量加热后生成的黑色固体于试管中,加入稀盐酸。观察到黑色固体逐渐溶解,溶液变成蓝色。
③取少量上述蓝色溶液于试管中,浸入一根洁净的铁丝。观察到铁丝表面有红色物质析出。
请回答下列问题:
(1)加热后试管中剩余的黑色物质是
(2)写出该绿色物质受热分解的化学方程式:
(3)上述实验步骤③中反应的离子方程式为
(4)实验装置最后的干燥管的作用是
(5)已知:
| 物质 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe(OH)3 | 1.9 | 3.2 |
| Fe(OH)2 | 7.0 | 9.0 |
| Cu(OH)2 | 4.7 | 6.7 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】某实验小组认为银镜反应用银氨溶液而不直接用AgNO3溶液的原因和溶液酸碱性有关。
I.甲同学进行了如下对比实验:
(1)甲同学认为:AgNO3溶液应该也可以直接氧化乙醛的理由是_______ (写出一条即可);而实验II中无明显现象,可能的原因是_______ 。(写出一条即可)
II.乙同学查阅资料,发现银镜反应的机理分为如下三步:
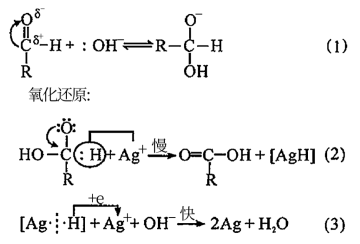
(2)据此,乙设计了实验III:1mL 2%AgNO3溶液中,依次加入3滴1mol/L NaOH溶液、2%氨水19滴、3滴40%乙醛溶液:水浴加热,结果比实验I更快出现了银镜,说明_______
III.丙同学查找资料,找到了不同浓度的AgNO3溶液对室内HCHO甲醛气体去除效果图:

(3)请解释曲线ab段上升的原因:_______ ;请解释曲线bc段下降的原因:_______
IV.结合甲乙丙同学的实验和资料,丁同学进一步提出,溶液的pH稳定,有利于快速形成均匀光亮的银镜。
(4)结合反应产物分析AgNO3溶液与乙醛溶液反应pH变化明显,而银氨溶液与乙醛溶液反应pH变化不明显的原因_______
(5)综合四位同学的实验和论证,相比AgNO3溶液,银氨溶液的优点是·_______ (写出2条)
I.甲同学进行了如下对比实验:
| 装置 | 实验序号 | 试管中的药品 | 现象 |
 | 实验1 | 2%AgNO3溶液1 mL,加入2%氨水22滴;再加入3滴40%乙醛溶液;水浴加热 | 出现光亮的银镜 |
| 实验2 | 2%AgNO3溶液1 mL,加入蒸馏水22滴;再加入3滴40%乙醛溶液;水浴加热 | 无明显现象 |
II.乙同学查阅资料,发现银镜反应的机理分为如下三步:

(2)据此,乙设计了实验III:1mL 2%AgNO3溶液中,依次加入3滴1mol/L NaOH溶液、2%氨水19滴、3滴40%乙醛溶液:水浴加热,结果比实验I更快出现了银镜,说明
III.丙同学查找资料,找到了不同浓度的AgNO3溶液对室内HCHO甲醛气体去除效果图:

(3)请解释曲线ab段上升的原因:
IV.结合甲乙丙同学的实验和资料,丁同学进一步提出,溶液的pH稳定,有利于快速形成均匀光亮的银镜。
(4)结合反应产物分析AgNO3溶液与乙醛溶液反应pH变化明显,而银氨溶液与乙醛溶液反应pH变化不明显的原因
(5)综合四位同学的实验和论证,相比AgNO3溶液,银氨溶液的优点是·
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】I.影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究。
(1)取等物质的量浓度、等体积的H2O溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)。
①实验1、2研究的是________________ 对H2O2分解速率的影响。
②实验2、3的目的是________________ 。
(2)查文献可知:Cu2+对H2O2分解也有催化作用,为比较Fe3+、Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
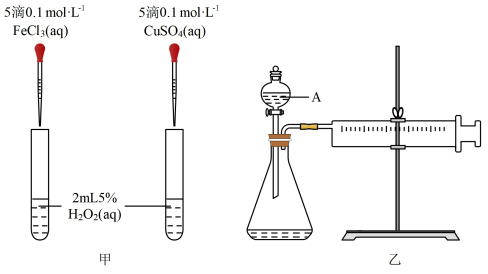
①定性性分析:如图甲可通过观察__________ ,先定性比较得出结论。有同学提出将CuSO4溶液改为CuCl2溶液更合理,其理由是__________ 。
②定量分析:如图乙所示,实验时以收集到40 mL气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是____________ 。
II.化学兴趣小组的同学0.100 mol/L盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应)。实验步骤如下:
(1)配制待测液:用分析天平准确称取烧碱样品2. 500 g,全部溶于水配制成500 mL溶液。配制溶液需用的玻璃仪器除了烧杯、胶头滴管外,还需要__________
(2)滴定:
①用碱式滴定管量取20.00 mL所配溶液放在锥形瓶中,滴加几滴指示剂,待测。滴定管在装入反应液之前应进行的操作有___________ 。
②用浓度为0. 1000 mol/L 的盐酸标准溶液进行滴定。开始滴定前的一步操作是____________ 。③滴定过程中用pH计测定锥形瓶中溶液的pH,临近滴定终点时每滴一滴测一次pH。滴定过程中,测得锥形瓶中溶液的pH变化如下表:
(3)数据处理:
所测样品中NaOH的质量百分含量为____________ 。
(1)取等物质的量浓度、等体积的H2O溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)。
| 序号 | 温度/℃ | 催化剂 | 现象 | 结论 |
| 1 | 40 | FeCl3溶液 | ||
| 2 | 20 | FeCl3溶液 | ||
| 3 | 20 | MnO2 | ||
| 4 | 20 | 无 |
①实验1、2研究的是
②实验2、3的目的是
(2)查文献可知:Cu2+对H2O2分解也有催化作用,为比较Fe3+、Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:

①定性性分析:如图甲可通过观察
②定量分析:如图乙所示,实验时以收集到40 mL气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是
II.化学兴趣小组的同学0.100 mol/L盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应)。实验步骤如下:
(1)配制待测液:用分析天平准确称取烧碱样品2. 500 g,全部溶于水配制成500 mL溶液。配制溶液需用的玻璃仪器除了烧杯、胶头滴管外,还需要
(2)滴定:
①用碱式滴定管量取20.00 mL所配溶液放在锥形瓶中,滴加几滴指示剂,待测。滴定管在装入反应液之前应进行的操作有
②用浓度为0. 1000 mol/L 的盐酸标准溶液进行滴定。开始滴定前的一步操作是
| V(HCI) /mL | 0.00 | 12.00 | 18.00 | 22.00 | 23.00 | 23.96 |
| pH | 13.1 | 12.6 | 12.2 | 11.7 | 11.4 | 9.9 |
| V(HCI) /mL | 24.00 | 24.04 | 25.00 | 26.00 | 30.00 | |
| pH | 7.0 | 4.0 | 2.7 | 2.4 | 1.9 |
(3)数据处理:
所测样品中NaOH的质量百分含量为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】化学反应速率在生产生活中有重要作用。
(1)氨的合成为氮肥的生产工业奠定了基础,其原理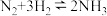 。
。
①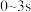 ,
, 的浓度增加了
的浓度增加了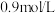 ,用
,用 表示其平均反应速率为
表示其平均反应速率为_______ 。
②下列4个数据是在不同条件下测得的合成氨反应速率,其中反应最快的是_______ (填字母)。
A.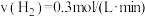 B.
B.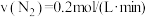
C.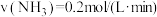 D.
D.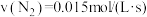
(2)研究反应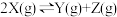 的速率影响因素,在不同条件下进行4组实验,Y、Z起始浓度为0,反应物X的浓度随反应时间的变化情况如图所示。
的速率影响因素,在不同条件下进行4组实验,Y、Z起始浓度为0,反应物X的浓度随反应时间的变化情况如图所示。

①对比实验Ⅰ、Ⅱ可得出:_______ ,化学反应速率加快。
②对比实验Ⅱ、Ⅳ可得出:_______ ,化学反应速率加快。
③实验Ⅲ与实验Ⅱ相比,实验Ⅲ平衡时间短的原因是_______ 。
(1)氨的合成为氮肥的生产工业奠定了基础,其原理
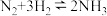 。
。①
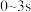 ,
, 的浓度增加了
的浓度增加了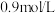 ,用
,用 表示其平均反应速率为
表示其平均反应速率为②下列4个数据是在不同条件下测得的合成氨反应速率,其中反应最快的是
A.
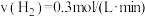 B.
B.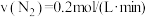
C.
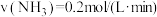 D.
D.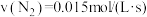
(2)研究反应
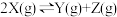 的速率影响因素,在不同条件下进行4组实验,Y、Z起始浓度为0,反应物X的浓度随反应时间的变化情况如图所示。
的速率影响因素,在不同条件下进行4组实验,Y、Z起始浓度为0,反应物X的浓度随反应时间的变化情况如图所示。
①对比实验Ⅰ、Ⅱ可得出:
②对比实验Ⅱ、Ⅳ可得出:
③实验Ⅲ与实验Ⅱ相比,实验Ⅲ平衡时间短的原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】亚硫酰氯(SOCl2)又名氯化亚砜,是一种无色或淡黄色发烟液体,有强烈刺激性气味,常用作脱水剂,主要用于制造酰基氯化物,还用于医药、农药、染料等的生产。某实验小组设计实验制备氯化亚砜并探究其性质。
已知:①实验室制备原理为 。
。
②资料卡片:
实验一:制备并探究SOCl2的性质,制备SOCl2的装置如图(夹持装置已略去)。
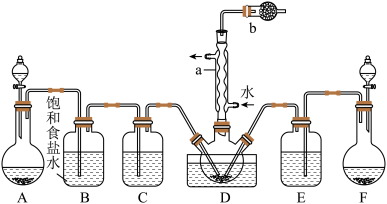
(1)a仪器的名称为_______ ,b装置的作用是_______ 。
(2) 可通过
可通过 固体与70%浓
固体与70%浓 反应制取,
反应制取, 可通过
可通过 固体与浓盐酸反应制取,则上图中制取
固体与浓盐酸反应制取,则上图中制取 的装置为
的装置为_______ (填字母)。
(3)将上述装置制得的SOCl2通过蒸馏方法提取出来(加热及夹持装置略),装置安装顺序为①⑨⑧_______ (填序号)。

(4)甲同学认为SOCl2可用作热分解 制取无水
制取无水 的脱水剂,反应的化学方程式为
的脱水剂,反应的化学方程式为_______ ;但乙同学认为该实验可能发生副反应使产品不纯,所以乙同学取少量 在不断通入SOCl2蒸气的条件下加热,充分反应后通入N2,加水溶解,取溶解后的溶液少许,加入
在不断通入SOCl2蒸气的条件下加热,充分反应后通入N2,加水溶解,取溶解后的溶液少许,加入_______ (填写试剂和实验现象),说明发生了副反应。
实验二:测定某SOCl2样品中SOCl2的纯度。
①准确称量称量瓶和盖的总质量 ,迅速加入
,迅速加入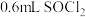 样品,立即盖紧,称量,质量为
样品,立即盖紧,称量,质量为 。
。
②连同称量瓶一起放入盛有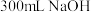 溶液的密封水解瓶中,盖紧并用蒸馏水封口,轻轻摇动,待称量瓶盖打开,将水解瓶放入冰水浴,浸泡水解1h后,将水解瓶中的溶液全部转移到
溶液的密封水解瓶中,盖紧并用蒸馏水封口,轻轻摇动,待称量瓶盖打开,将水解瓶放入冰水浴,浸泡水解1h后,将水解瓶中的溶液全部转移到 容量瓶中,洗涤水解瓶2~3次,洗涤液一并转入容量瓶中,静置至室温,定容,摇匀,得到溶液M。
容量瓶中,洗涤水解瓶2~3次,洗涤液一并转入容量瓶中,静置至室温,定容,摇匀,得到溶液M。
③准确量取 溶液M于
溶液M于 碘量瓶中,加入两滴指示剂,用
碘量瓶中,加入两滴指示剂,用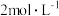 的盐酸中和过量的
的盐酸中和过量的 溶液至恰好完全。
溶液至恰好完全。
④准确加入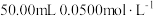 碘标准溶液,充分反应后,用淀粉溶液作指示剂,用
碘标准溶液,充分反应后,用淀粉溶液作指示剂,用 的
的 溶液滴定过量的碘,反应为
溶液滴定过量的碘,反应为 。平行测定两次,反应消耗
。平行测定两次,反应消耗 溶液的平均体积为
溶液的平均体积为 。
。
(5)判断滴定终点的方法为_______ ,样品中SOCl2的质量分数为_______ ;下列情况会导致测定的SOCl2的质量分数偏高的是_______ (填标号)。
A.实际碘标准溶液浓度偏低
B.实际 溶液浓度偏低
溶液浓度偏低
C.水解过程,气体吸收不充分,有部分气体逸出
D.滴定达终点时发现滴定管尖嘴内有气泡生成
已知:①实验室制备原理为
 。
。②资料卡片:
| 物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
 |  | 76.1 | 137.5 | 遇水剧烈水解,易与 反应 反应 |
 | 1.25 | 105.8 | 153.5 | 遇水剧烈水解,能溶于 |
 | 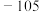 | 78.8 | 119 | 遇水剧烈水解,受热易分解 |

(1)a仪器的名称为
(2)
 可通过
可通过 固体与70%浓
固体与70%浓 反应制取,
反应制取, 可通过
可通过 固体与浓盐酸反应制取,则上图中制取
固体与浓盐酸反应制取,则上图中制取 的装置为
的装置为(3)将上述装置制得的SOCl2通过蒸馏方法提取出来(加热及夹持装置略),装置安装顺序为①⑨⑧

(4)甲同学认为SOCl2可用作热分解
 制取无水
制取无水 的脱水剂,反应的化学方程式为
的脱水剂,反应的化学方程式为 在不断通入SOCl2蒸气的条件下加热,充分反应后通入N2,加水溶解,取溶解后的溶液少许,加入
在不断通入SOCl2蒸气的条件下加热,充分反应后通入N2,加水溶解,取溶解后的溶液少许,加入实验二:测定某SOCl2样品中SOCl2的纯度。
①准确称量称量瓶和盖的总质量
 ,迅速加入
,迅速加入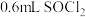 样品,立即盖紧,称量,质量为
样品,立即盖紧,称量,质量为 。
。②连同称量瓶一起放入盛有
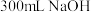 溶液的密封水解瓶中,盖紧并用蒸馏水封口,轻轻摇动,待称量瓶盖打开,将水解瓶放入冰水浴,浸泡水解1h后,将水解瓶中的溶液全部转移到
溶液的密封水解瓶中,盖紧并用蒸馏水封口,轻轻摇动,待称量瓶盖打开,将水解瓶放入冰水浴,浸泡水解1h后,将水解瓶中的溶液全部转移到 容量瓶中,洗涤水解瓶2~3次,洗涤液一并转入容量瓶中,静置至室温,定容,摇匀,得到溶液M。
容量瓶中,洗涤水解瓶2~3次,洗涤液一并转入容量瓶中,静置至室温,定容,摇匀,得到溶液M。③准确量取
 溶液M于
溶液M于 碘量瓶中,加入两滴指示剂,用
碘量瓶中,加入两滴指示剂,用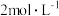 的盐酸中和过量的
的盐酸中和过量的 溶液至恰好完全。
溶液至恰好完全。④准确加入
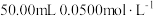 碘标准溶液,充分反应后,用淀粉溶液作指示剂,用
碘标准溶液,充分反应后,用淀粉溶液作指示剂,用 的
的 溶液滴定过量的碘,反应为
溶液滴定过量的碘,反应为 。平行测定两次,反应消耗
。平行测定两次,反应消耗 溶液的平均体积为
溶液的平均体积为 。
。(5)判断滴定终点的方法为
A.实际碘标准溶液浓度偏低
B.实际
 溶液浓度偏低
溶液浓度偏低C.水解过程,气体吸收不充分,有部分气体逸出
D.滴定达终点时发现滴定管尖嘴内有气泡生成
您最近一年使用:0次
【推荐2】高纯硝酸锶Sr(NO3)2 可用于制造信号灯,光学玻璃等。工业级硝酸锶含硝酸钙、硝酸钡等杂质,提纯流程如下:
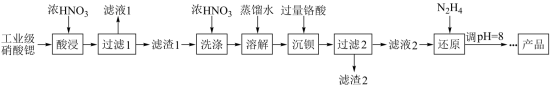
已知:①“滤渣1”的成分为Ba(NO3)2、Sr(NO3)2②铬酸(H2CrO4)为弱酸
(1)“酸浸”不能采用高温的原因是__________________ ,“滤液1”的主要溶质是_____________________ 。
(2)相对于水洗,用浓HNO3洗涤的优点是_____________________ 。
(3)“滤液2”中过量的H2CrO4被N2H4还原为Cr3+,同时放出无污染的气体,写出发生反应的离子方程式:_____________________________________________________ 。
(4)已知Cr(OH)3类似氢氧化铝,还原后溶液的pH不能大于8的原因是(结合离子方程式说明理由)_______________________________________________________ 。
(5)为了测定“滤渣2”中BaCrO4的含量,进行以下实验:
+mg“滤渣2” 溶液
溶液 滴定终点时消耗VmLNa2S2O3溶液(已知:I2+2S2O32-=2I-+S4O62-)
滴定终点时消耗VmLNa2S2O3溶液(已知:I2+2S2O32-=2I-+S4O62-)
①“滤渣2”中BaCrO4(摩尔质量为Mg/mol)的质量分数为__________ (用代数式表示)。
②若加入的HI溶液过量太多,测定结果会_______ (“偏高”、“偏低”或“无影响”)。

已知:①“滤渣1”的成分为Ba(NO3)2、Sr(NO3)2②铬酸(H2CrO4)为弱酸
(1)“酸浸”不能采用高温的原因是
(2)相对于水洗,用浓HNO3洗涤的优点是
(3)“滤液2”中过量的H2CrO4被N2H4还原为Cr3+,同时放出无污染的气体,写出发生反应的离子方程式:
(4)已知Cr(OH)3类似氢氧化铝,还原后溶液的pH不能大于8的原因是(结合离子方程式说明理由)
(5)为了测定“滤渣2”中BaCrO4的含量,进行以下实验:
+mg“滤渣2”
 溶液
溶液 滴定终点时消耗VmLNa2S2O3溶液(已知:I2+2S2O32-=2I-+S4O62-)
滴定终点时消耗VmLNa2S2O3溶液(已知:I2+2S2O32-=2I-+S4O62-)①“滤渣2”中BaCrO4(摩尔质量为Mg/mol)的质量分数为
②若加入的HI溶液过量太多,测定结果会
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】金属镓有“电子工业脊梁”的美誉,镓与铝的化学性质类似。从刚玉渣(含钛、镓的低硅铁合金,还含有少量氧化铝)回收镓的流程如图所示:

溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
请回答下列问题:
(1)“酸浸”过程中为提高浸取率可采取的具体措施为______ 。(任写两条)
(2)“中和沉淀”过程中,滤液③的溶质主要成分为______ ,这一过程pH应调节的范围为______ 。
(3)“碱浸”过程中______ 用氨水代替NaOH溶液(选填“能”或“不能”)
(4)“碳酸化”过程中为防止镓损耗,不能通入过量 的原因为
的原因为______ (用离子方程式表示),由流程图可知酸性
______  。
。
(5)GaN具有优异的光电性能。工业上常采用在1100℃条件下,利用Ga与 反应可制备GaN,该过程的化学方程式为
反应可制备GaN,该过程的化学方程式为______ 。
(6)副产品 样品的纯度可用滴定法进行测定,实验步骤如下:
样品的纯度可用滴定法进行测定,实验步骤如下:
步骤1:称取5.800g绿矾产品,经溶解、定容等步骤准确配制250mL溶液:
步骤2:从上述容量瓶中量取25.00mL待测溶液于锥形瓶中:
步骤3:用硫酸酸化的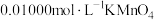 溶液滴定至终点,记录消耗
溶液滴定至终点,记录消耗 溶液体积;
溶液体积;
步骤4:重复步骤2、步骤3一至两次。
①数据处理:
计算上述样品中 的质量分数为
的质量分数为______ (保留两位小数)。
②不考虑操作误差,用上述方法测定的样品中 的质量分数偏低的原因可能是
的质量分数偏低的原因可能是______ 。

溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 |  |  |  |  |
开始沉淀时( )的pH )的pH | 4.5 | 3.7 | 2.2 | 7.5 |
沉淀完全时( )的pH )的pH | 5.5 | 4.7 | 3.2 | 9.0 |
(1)“酸浸”过程中为提高浸取率可采取的具体措施为
(2)“中和沉淀”过程中,滤液③的溶质主要成分为
(3)“碱浸”过程中
(4)“碳酸化”过程中为防止镓损耗,不能通入过量
 的原因为
的原因为
 。
。(5)GaN具有优异的光电性能。工业上常采用在1100℃条件下,利用Ga与
 反应可制备GaN,该过程的化学方程式为
反应可制备GaN,该过程的化学方程式为(6)副产品
 样品的纯度可用滴定法进行测定,实验步骤如下:
样品的纯度可用滴定法进行测定,实验步骤如下:步骤1:称取5.800g绿矾产品,经溶解、定容等步骤准确配制250mL溶液:
步骤2:从上述容量瓶中量取25.00mL待测溶液于锥形瓶中:
步骤3:用硫酸酸化的
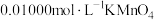 溶液滴定至终点,记录消耗
溶液滴定至终点,记录消耗 溶液体积;
溶液体积;步骤4:重复步骤2、步骤3一至两次。
①数据处理:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00mL | 0.02 | 40.01 |
| 2 | 25.00mL | 0.70 | 40.71 |
| 3 | 25.00mL | 0.20 | 39.20 |
 的质量分数为
的质量分数为②不考虑操作误差,用上述方法测定的样品中
 的质量分数偏低的原因可能是
的质量分数偏低的原因可能是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】平板电视显示屏生产过程中产生大量的废玻璃(含SiO2、Fe2O3、CeO2、FeO等物质)。某小组以此废玻璃为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4。
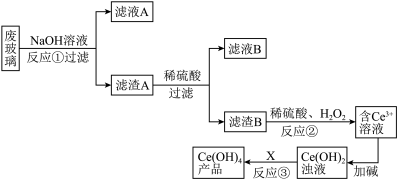
已知:CeO2不溶于强酸或强碱;Ce3+易水解,酸性条件下,Ce4+有强氧化性。
(1)反应①的离子方程式________________________ 。
(2)反应②的离子方程武是_____________________________ 。
(3)为了得到较纯的Ce3+溶液,反应②之前要进行的操作是______
(4)反应③需要加入的试剂X可以是______________ 。
(5)用滴定法测定制得的Ce(OH)4产品纯度。

用FeSO4溶液滴定用_____ 做指示剂,滴定终点的现象_________ 。

已知:CeO2不溶于强酸或强碱;Ce3+易水解,酸性条件下,Ce4+有强氧化性。
(1)反应①的离子方程式
(2)反应②的离子方程武是
(3)为了得到较纯的Ce3+溶液,反应②之前要进行的操作是
(4)反应③需要加入的试剂X可以是
(5)用滴定法测定制得的Ce(OH)4产品纯度。

用FeSO4溶液滴定用
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】海洋是一个巨大的化学资源宝库,利用海洋资源进行如下实验。
Ⅰ.海带中含有碘元素。从海带中提取碘的实验过程如下图所示:
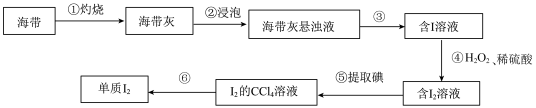
(1)实验步骤①会用到下列仪器中的___________ (填字母)。
a.酒精灯 b.漏斗 c.坩埚 d.泥三角
(2)步骤④中反应的离子方程式为___________ 。
(3)对于操作⑤,萃取后分液漏斗内观察到的现象是___________ 。
Ⅱ.从海水中获得纯净氯化钠溶液来生产焦亚硫酸钠(Na2S2O5,能溶于水,在空气中易被氧化),其工业流程如下:
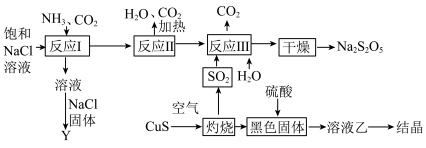
(4)反应Ⅰ中应该先通入___________ ,反应Ⅰ的离子方程式为___________ 。
(5)由“溶液乙→结晶”的操作是___________ 。
(6)已知Na2S2O5与稀硫酸反应生成SO2,焦亚硫酸钠常用作食物的抗氧化剂,在空气中容易被氧化而变质,要检验焦亚硫酸钠是否变质,具体的实验操作为___________ 。
(7)若灼烧过程中,投入质量分数为60%的CuS矿石32kg(反应过程中CuS无损失),则理论上可获得
___________  。
。
Ⅰ.海带中含有碘元素。从海带中提取碘的实验过程如下图所示:

(1)实验步骤①会用到下列仪器中的
a.酒精灯 b.漏斗 c.坩埚 d.泥三角
(2)步骤④中反应的离子方程式为
(3)对于操作⑤,萃取后分液漏斗内观察到的现象是
Ⅱ.从海水中获得纯净氯化钠溶液来生产焦亚硫酸钠(Na2S2O5,能溶于水,在空气中易被氧化),其工业流程如下:

(4)反应Ⅰ中应该先通入
(5)由“溶液乙→结晶”的操作是
(6)已知Na2S2O5与稀硫酸反应生成SO2,焦亚硫酸钠常用作食物的抗氧化剂,在空气中容易被氧化而变质,要检验焦亚硫酸钠是否变质,具体的实验操作为
(7)若灼烧过程中,投入质量分数为60%的CuS矿石32kg(反应过程中CuS无损失),则理论上可获得

 。
。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】己二酸是合成尼龙66的主要原料之一,在塑料和化工行业中有广泛的用途。通过浓硝酸氧化环己醇制备己二酸,其反应原理简式(未配平)有关数据装置示意图(夹持装置已省略)如下:
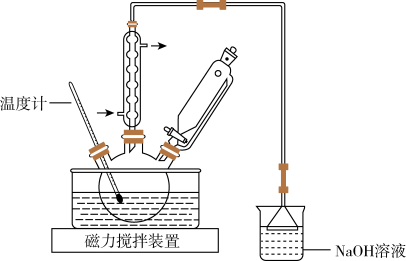


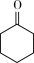

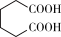 +NO2↑+H2O
+NO2↑+H2O
实验步骤:
步骤一:在三颈烧瓶中加入25mL水、10mL浓硝酸,慢慢开启磁力搅拌装置,将溶液混合,并用水浴加热至80℃回流。
步骤二:从恒压滴液漏斗中小心逐滴滴加环己醇4.2mL,水浴温度维持在85~90℃,必要时可往水浴中添加冷水。
步骤三:环己醇滴加完毕后,继续反应30分钟。将三颈烧瓶脱离水浴稍冷,观察到反应液浑浊并出现白色沉淀,再将烧瓶置于冰水浴中冷却20分钟,抽滤,用母液洗涤烧瓶和滤饼,后将粗品置于85℃烘箱鼓风干燥,称重得产品4.2g。
回答下列问题:
(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为_______(填标号)。
(2)反应开始后,三颈烧瓶中的现象是______ ;写出烧杯中发生反应的化学方程式_____ 。
(3)“步骤二”中,必要时可往水浴中添加冷水,理由是_______ 。
(4)“步骤三”中,再将烧瓶置于冰水浴20分钟的目的是_______ 。
(5)本实验中己二酸的产率约为_______ (保留2位有效数字)。
(6)若要得到纯度更高的己二酸,可通过_______ 的方法提纯。





 +NO2↑+H2O
+NO2↑+H2O| 名称 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/(g·mL-1) | 溶解性 |
| 环己醇 | 100 | 25.2 | 161 | 0.96 | 溶于水,易溶于乙醇 |
| 己二酸 | 146 | 151 | 265 | 1.36 | 溶于水,热水中溶解度更大,易溶于乙醇 |
步骤一:在三颈烧瓶中加入25mL水、10mL浓硝酸,慢慢开启磁力搅拌装置,将溶液混合,并用水浴加热至80℃回流。
步骤二:从恒压滴液漏斗中小心逐滴滴加环己醇4.2mL,水浴温度维持在85~90℃,必要时可往水浴中添加冷水。
步骤三:环己醇滴加完毕后,继续反应30分钟。将三颈烧瓶脱离水浴稍冷,观察到反应液浑浊并出现白色沉淀,再将烧瓶置于冰水浴中冷却20分钟,抽滤,用母液洗涤烧瓶和滤饼,后将粗品置于85℃烘箱鼓风干燥,称重得产品4.2g。
回答下列问题:
(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为_______(填标号)。
| A.50mL | B.100mL | C.250mL | D.500mL |
(3)“步骤二”中,必要时可往水浴中添加冷水,理由是
(4)“步骤三”中,再将烧瓶置于冰水浴20分钟的目的是
(5)本实验中己二酸的产率约为
(6)若要得到纯度更高的己二酸,可通过
您最近一年使用:0次



