碳元素是形成单质及其化合物种类最多的元素,其单质与化合物广泛分布于自然界。碳是地球上组成生命的最基本元素之一,具有很强的结合能力,与其它元素结合成不计其数的无机物和有机化合物,构成了丰富多彩的世界。碳及其化合物在研究和生产中有许多重要用途。回答下列有关问题:
(1)碳元素可形成多种不同形式的单质,如图1是几种碳的单质的结构图:
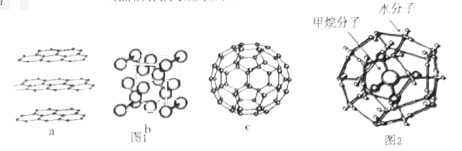
观察上述结构,a对应石墨晶体模型,b对应的物质是金刚石,c是 的分子结构模型。判断b中碳原子的杂化方式为
的分子结构模型。判断b中碳原子的杂化方式为___________ ,在 单质中,微粒之间的作用力为
单质中,微粒之间的作用力为___________ 。
(2)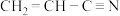 是制备晴纶的原料,其分子中
是制备晴纶的原料,其分子中 键和
键和 键的个数之比为
键的个数之比为___________ (填最简整数比)。
(3)碳的氢化物甲烷在自然界中广泛存在,其中可燃冰是有待人类开发的新能源。可燃冰是一种笼状结构, 分子存在于
分子存在于 分子形成的笼子中(如图2所示)。两种分子中,共价键的键能
分子形成的笼子中(如图2所示)。两种分子中,共价键的键能 键
键___________  键(填“大于”或“小于”);
键(填“大于”或“小于”); 分子与
分子与 分子的分子量相差不大,但两种物质的熔沸点相差很大,其主要原因是
分子的分子量相差不大,但两种物质的熔沸点相差很大,其主要原因是___________ 。
(4) 是碳元素的常见氧化物,分子中C原子上有一对孤对电子,
是碳元素的常见氧化物,分子中C原子上有一对孤对电子, 的结构式为
的结构式为 。
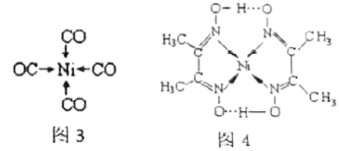
。 可以和很多过渡金属形成配合物。金属镍粉在
可以和很多过渡金属形成配合物。金属镍粉在 气流中轻微地加热,可生成液态的
气流中轻微地加热,可生成液态的 ,用配位键表示
,用配位键表示 的结构为图3;
的结构为图3; 是无色液体,沸点42.1℃,熔点
是无色液体,沸点42.1℃,熔点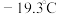 ,难溶于水,易溶于有机溶剂,推测
,难溶于水,易溶于有机溶剂,推测 是
是___________ 分子(填“极性”或“非极性”)。 元素位于第四周期VⅢ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则基态
元素位于第四周期VⅢ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则基态 原子的电子排布式为:
原子的电子排布式为:___________ ,其位于元素周期表的___________ 区。镍 可形成多种配合物,且各种配合物有广泛的用途。某镍配合物结构如图4所示,则分子内含有的作用力不存在
可形成多种配合物,且各种配合物有广泛的用途。某镍配合物结构如图4所示,则分子内含有的作用力不存在___________ (填序号)。
A.氢键 B.离子键 C.共价键 D.配位键
组成该配合物分子且同属第二周期元素的电负性由大到小的顺序是___________ 。
(1)碳元素可形成多种不同形式的单质,如图1是几种碳的单质的结构图:

观察上述结构,a对应石墨晶体模型,b对应的物质是金刚石,c是
 的分子结构模型。判断b中碳原子的杂化方式为
的分子结构模型。判断b中碳原子的杂化方式为 单质中,微粒之间的作用力为
单质中,微粒之间的作用力为(2)
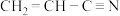 是制备晴纶的原料,其分子中
是制备晴纶的原料,其分子中 键和
键和 键的个数之比为
键的个数之比为(3)碳的氢化物甲烷在自然界中广泛存在,其中可燃冰是有待人类开发的新能源。可燃冰是一种笼状结构,
 分子存在于
分子存在于 分子形成的笼子中(如图2所示)。两种分子中,共价键的键能
分子形成的笼子中(如图2所示)。两种分子中,共价键的键能 键
键 键(填“大于”或“小于”);
键(填“大于”或“小于”); 分子与
分子与 分子的分子量相差不大,但两种物质的熔沸点相差很大,其主要原因是
分子的分子量相差不大,但两种物质的熔沸点相差很大,其主要原因是(4)
 是碳元素的常见氧化物,分子中C原子上有一对孤对电子,
是碳元素的常见氧化物,分子中C原子上有一对孤对电子, 的结构式为
的结构式为 。
。 可以和很多过渡金属形成配合物。金属镍粉在
可以和很多过渡金属形成配合物。金属镍粉在 气流中轻微地加热,可生成液态的
气流中轻微地加热,可生成液态的 ,用配位键表示
,用配位键表示 的结构为图3;
的结构为图3; 是无色液体,沸点42.1℃,熔点
是无色液体,沸点42.1℃,熔点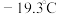 ,难溶于水,易溶于有机溶剂,推测
,难溶于水,易溶于有机溶剂,推测 是
是 元素位于第四周期VⅢ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则基态
元素位于第四周期VⅢ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则基态 原子的电子排布式为:
原子的电子排布式为: 可形成多种配合物,且各种配合物有广泛的用途。某镍配合物结构如图4所示,则分子内含有的作用力不存在
可形成多种配合物,且各种配合物有广泛的用途。某镍配合物结构如图4所示,则分子内含有的作用力不存在
A.氢键 B.离子键 C.共价键 D.配位键
组成该配合物分子且同属第二周期元素的电负性由大到小的顺序是
更新时间:2021-02-01 16:10:08
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
【推荐1】红矾钠(重铬酸钠: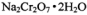 )是重要的基本化工原料,应用十分广泛。工业制备红矾钠的流程如下:
)是重要的基本化工原料,应用十分广泛。工业制备红矾钠的流程如下:
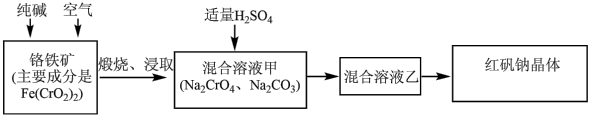
请回答下列问题:
(1) 的基态电子排布式为
的基态电子排布式为____________ 。
(2)煅烧铬铁矿发生反应:____________ Fe(CrO2)2+Na2CO3+O2 Fe2O3+Na2CrO4+CO2 配平上述化学反应方程式。
Fe2O3+Na2CrO4+CO2 配平上述化学反应方程式。
(3)溶液甲中加入H2SO4时,可以观察到溶液由黄色变为橙色,并放出无色气体,有关反应的离子方程式为____________ 。
(4)制备红矾钠的废水必须进行处理。首先酸化废水,将含+6价铬的酸性废液放入电解槽内,用铁作阳极进行电解,阴极析出H2,阳极产物被 氧化然后转化为Cr(OH)3、 Fe(0H)3沉淀。
氧化然后转化为Cr(OH)3、 Fe(0H)3沉淀。
①阳极的电极反应式为(不考虑后续反应):____________ 。
②溶液中金属离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因:______ 。
③已知某含 的酸性废水中Cr元素的含量是52.5mg/L,处理后Cr元素最高允许 排量为0.5 mg/L。要处理100 m3废水达到排放标准,至少消耗铁
的酸性废水中Cr元素的含量是52.5mg/L,处理后Cr元素最高允许 排量为0.5 mg/L。要处理100 m3废水达到排放标准,至少消耗铁_____ kg。
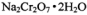 )是重要的基本化工原料,应用十分广泛。工业制备红矾钠的流程如下:
)是重要的基本化工原料,应用十分广泛。工业制备红矾钠的流程如下:
请回答下列问题:
(1)
 的基态电子排布式为
的基态电子排布式为(2)煅烧铬铁矿发生反应:
 Fe2O3+Na2CrO4+CO2 配平上述化学反应方程式。
Fe2O3+Na2CrO4+CO2 配平上述化学反应方程式。(3)溶液甲中加入H2SO4时,可以观察到溶液由黄色变为橙色,并放出无色气体,有关反应的离子方程式为
(4)制备红矾钠的废水必须进行处理。首先酸化废水,将含+6价铬的酸性废液放入电解槽内,用铁作阳极进行电解,阴极析出H2,阳极产物被
 氧化然后转化为Cr(OH)3、 Fe(0H)3沉淀。
氧化然后转化为Cr(OH)3、 Fe(0H)3沉淀。①阳极的电极反应式为(不考虑后续反应):
②溶液中金属离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因:
③已知某含
 的酸性废水中Cr元素的含量是52.5mg/L,处理后Cr元素最高允许 排量为0.5 mg/L。要处理100 m3废水达到排放标准,至少消耗铁
的酸性废水中Cr元素的含量是52.5mg/L,处理后Cr元素最高允许 排量为0.5 mg/L。要处理100 m3废水达到排放标准,至少消耗铁
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】合成氨有助于解决地球上粮食不足问题,是化学和技术对社会发展与进步的巨大贡献。
(1)基态N原子,核外电子的运动状态有_______ 种,能量最高的电子的电子云在空间有_______ 个伸展方向,原子轨道呈_______ 形。
(2)我国科研人员研制出了“Fe-LiH”催化剂,使得合成氨温度和压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破。
①第三电离能I3(Fe)_______ I3(Mn)(填“>”或“<”),原因是_______ 。
②比较Li+与H-的半径大小关系: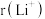
_______ 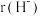 (填“>”或“<”)。
(填“>”或“<”)。
(3)科学家近期合成了一种固氮酶模型配合物,该物质可以在温和条件下直接活化H2,将N3-转化为 ,反应过程如图所示:
,反应过程如图所示:
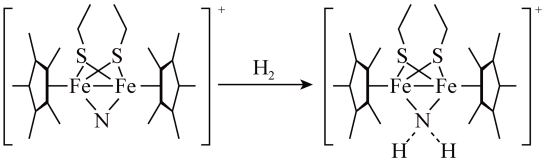
①产物中N原子的杂化轨道类型为_______ 。
②原子数和价电子数相同的微粒(分子、离子或基团)互为等电体,写出一种与 互为等电子体的分子
互为等电子体的分子_______ (填化学式)。
(1)基态N原子,核外电子的运动状态有
(2)我国科研人员研制出了“Fe-LiH”催化剂,使得合成氨温度和压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破。
①第三电离能I3(Fe)
②比较Li+与H-的半径大小关系:
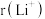
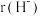 (填“>”或“<”)。
(填“>”或“<”)。(3)科学家近期合成了一种固氮酶模型配合物,该物质可以在温和条件下直接活化H2,将N3-转化为
 ,反应过程如图所示:
,反应过程如图所示:
①产物中N原子的杂化轨道类型为
②原子数和价电子数相同的微粒(分子、离子或基团)互为等电体,写出一种与
 互为等电子体的分子
互为等电子体的分子
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】X、Y、Z、W、M是原子序数依次增大的5种短周期元素。非金属元素X的核外电子数等于其周期数;Y的基态原子最外层有3个未成对电子;Z元素的电负性是同周期中最大的;W元素原子核外s能级上的电子总数与p能级上的电子总数相等;基态M原子的3p轨道上有4个电子。请回答下列问题:
(1)写出各元素的元素符号:X_______ ,Y_______ 。
(2)Y、Z、W、M的简单离子半径由大到小的顺序为_______ (填离子符号)。
(3)X、Y、Z、W的电负性由大到小的顺序为_______ (填元素符号,下同)。
(4)Z与M相比第一电离能比较大的是_______ ,其基态原子的电子排布式为_______ 。
(5)X~M中某种元素的部分电离能(用 、
、 ……表示,单位
……表示,单位 )数据如表:
)数据如表:
①由此可判断该元素是_______ (填元素符号),其最高正价为_______ 。
②该元素的电离能越来越大的原因是_______ 。
(1)写出各元素的元素符号:X
(2)Y、Z、W、M的简单离子半径由大到小的顺序为
(3)X、Y、Z、W的电负性由大到小的顺序为
(4)Z与M相比第一电离能比较大的是
(5)X~M中某种元素的部分电离能(用
 、
、 ……表示,单位
……表示,单位 )数据如表:
)数据如表:| I |  |  |  |  | …… |
| 电离能 | 738 | 1451 | 7733 | 10540 |
②该元素的电离能越来越大的原因是
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
名校
【推荐1】木质纤维素代替传统的化石原料用于生产对二甲苯可以缓解日益紧张的能源危机,再利用对二甲苯为起始原料结合 生产聚碳酸对二甲苯酯可以实现碳减排,路线如下:
生产聚碳酸对二甲苯酯可以实现碳减排,路线如下:
(1)葡萄糖中含有的官能团有___________ (写名称)。
(2)化合物II中C原子的杂化方式为___________ 。VI生成VII的反应类型为___________ 。
(3)1mol化合物III与1mol乙烯反应得到1molIV,化合物IV的结构简式为___________ 。
(4)已知化合物V的核磁共振氢谱有2组峰,且峰面积之比为2:3,写出V生成VI的化学方程式___________ 。
(5)化合物III的同分异构体中符合下列条件的有___________ 种(不含立体异构)。 杂化的C上。
杂化的C上。
(6)参照上述信息,写出以CH2=CH-CH3和CO2为起始有机原料合成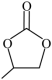 的路线(其它无机试剂任选)
的路线(其它无机试剂任选)___________ 。
 生产聚碳酸对二甲苯酯可以实现碳减排,路线如下:
生产聚碳酸对二甲苯酯可以实现碳减排,路线如下: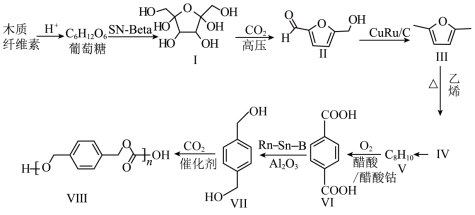
已知: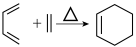 。
。
(1)葡萄糖中含有的官能团有
(2)化合物II中C原子的杂化方式为
(3)1mol化合物III与1mol乙烯反应得到1molIV,化合物IV的结构简式为
(4)已知化合物V的核磁共振氢谱有2组峰,且峰面积之比为2:3,写出V生成VI的化学方程式
(5)化合物III的同分异构体中符合下列条件的有
①含有环戊二烯(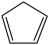 )的结构;
)的结构;
 杂化的C上。
杂化的C上。(6)参照上述信息,写出以CH2=CH-CH3和CO2为起始有机原料合成
 的路线(其它无机试剂任选)
的路线(其它无机试剂任选)
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】A、B、D、E、F五种元素的原子序数依次增大,且均为元素周期表前四周期元素,其中基态A原子的最外层电子数是最内层电子数的2倍;基态B原子的2p轨道上有3个未成对电子;基态D原子的s能级和p能级的电子总数相等;E和D可形成淡黄色固体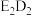 ;基态F原子的3d轨道的电子数是4s轨道电子数的3倍。回答下列问题:
;基态F原子的3d轨道的电子数是4s轨道电子数的3倍。回答下列问题:
(1)写出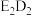 的电子式:
的电子式:___________ 。
(2)B的简单氢化物分子的空间结构是___________ ,其中心原子采取___________ 杂化。
(3)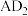 分子的
分子的 模型为
模型为___________ ,它的键角为___________ 。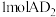 含有
含有 键的数目为
键的数目为___________ 。
(4) 比
比 稳定,请用原子结构知识解释其原因:
稳定,请用原子结构知识解释其原因:___________ 。
(5)A、B、D简单氢化物稳定性由弱到强的顺序为___________ (用化学式表示),原因是___________ (从原子结构与键参数角度解释原因)。
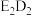 ;基态F原子的3d轨道的电子数是4s轨道电子数的3倍。回答下列问题:
;基态F原子的3d轨道的电子数是4s轨道电子数的3倍。回答下列问题:(1)写出
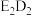 的电子式:
的电子式:(2)B的简单氢化物分子的空间结构是
(3)
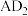 分子的
分子的 模型为
模型为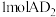 含有
含有 键的数目为
键的数目为(4)
 比
比 稳定,请用原子结构知识解释其原因:
稳定,请用原子结构知识解释其原因:(5)A、B、D简单氢化物稳定性由弱到强的顺序为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】近日,科学家开发用于人工固氮的 型碳材料高效利用
型碳材料高效利用 和
和 固氮合成
固氮合成 。反应原理如图所示。
。反应原理如图所示。

回答下列问题:
(1)基态C原子核外有___________ 种不同空间运动状态的电子;基态N原子有___________ 个不同运动状态的电子。
(2)基态H原子电子云轮廓图为___________ (填名称)。
(3) 的空间构型为
的空间构型为___________ , 的VSEPR模型为
的VSEPR模型为___________ 。
(4)从上述反应机理看出,第一步,1个 分子断键与
分子断键与 形成
形成___________ (填“共价键”“配位键”或“离子键”)。
(5) 催化剂中,C原子杂化类型是
催化剂中,C原子杂化类型是___________ ,N原子杂化类型是___________ 。
(6)C和N形成一种超硬度新材料,其熔点高于金刚石,其晶体部分结构如图所示。

①该晶体类型是___________ ,加热该材料时破坏的作用力类型是___________ 。
②该超硬度新材料的化学式为___________ 。
 型碳材料高效利用
型碳材料高效利用 和
和 固氮合成
固氮合成 。反应原理如图所示。
。反应原理如图所示。
回答下列问题:
(1)基态C原子核外有
(2)基态H原子电子云轮廓图为
(3)
 的空间构型为
的空间构型为 的VSEPR模型为
的VSEPR模型为(4)从上述反应机理看出,第一步,1个
 分子断键与
分子断键与 形成
形成(5)
 催化剂中,C原子杂化类型是
催化剂中,C原子杂化类型是(6)C和N形成一种超硬度新材料,其熔点高于金刚石,其晶体部分结构如图所示。

①该晶体类型是
②该超硬度新材料的化学式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐1】[化学—物质结构与性质]
A、B、C、D、E五种元素中,A原子核外的M层中只有两对成对电子,B原子核外的L层电子数是K层的两倍,C是地壳内含量(质量分数)最高的元素,D的核电荷数是A与C的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)A、B的元素符号依次为_____________ 、_______________ ;
(2)AC2与BC2分子的立体结构分别是______ 和______ ,相同条件下两者在水中的溶解度较大的是______ (写分子式),理由是___________________________________________ ;
(3)D的核外电子排布式为________________________ ,在形成化合物时它的最高化合价为__________ 。
A、B、C、D、E五种元素中,A原子核外的M层中只有两对成对电子,B原子核外的L层电子数是K层的两倍,C是地壳内含量(质量分数)最高的元素,D的核电荷数是A与C的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)A、B的元素符号依次为
(2)AC2与BC2分子的立体结构分别是
(3)D的核外电子排布式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】因瓦合金是铁和镍的合金,由于其膨胀系数极小,又称不变合金,适合做测量元件。回答下列问题:
(1)基态铁原子的原子结构示意图为___________ ;镍的基态原子核外未成对电子数为___________ 。
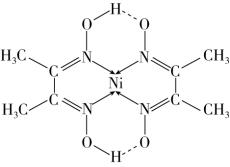
(2)在稀氨水介质中,Ni2+与丁二酮肟(分子式为C4H8N2O2)反应可生成鲜红色沉淀,其分子结构如下图所示,该结构中碳原子的杂化方式为___________ ; 该分子中含有的微粒间作用有_____ (选填以下序号)
①离子键 ②金属键 ③配位键 ④极性共价键⑤非极性共价键 ⑥分子内氢键
(3)铁、镍易与CO作用形成羰基配合物Fe(CO)5、Ni(CO)4。1个Fe(CO)5分子中含有σ键数目为___________ ;已知Ni(CO)4分子为正四面体构型,下列溶剂能够溶解Ni(CO)4的是___________ (填字母)。
A.四氯化碳 B.苯 C.水 D.液氨
(4)镍晶胞为面心立方,其中镍原子的配位数为___________ 。氯化亚铁的熔点为674 ℃,而氯化铁的熔点仅为182 ℃,二者熔点存在差异的原因是___________ 。
(5)在硅酸盐中,SiO 四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根:Si与O的原子数之比为
四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根:Si与O的原子数之比为___________ ,化学式为___________ 。

(1)基态铁原子的原子结构示意图为
(2)在稀氨水介质中,Ni2+与丁二酮肟(分子式为C4H8N2O2)反应可生成鲜红色沉淀,其分子结构如下图所示,该结构中碳原子的杂化方式为
①离子键 ②金属键 ③配位键 ④极性共价键⑤非极性共价键 ⑥分子内氢键

(3)铁、镍易与CO作用形成羰基配合物Fe(CO)5、Ni(CO)4。1个Fe(CO)5分子中含有σ键数目为
A.四氯化碳 B.苯 C.水 D.液氨
(4)镍晶胞为面心立方,其中镍原子的配位数为
(5)在硅酸盐中,SiO
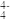 四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根:Si与O的原子数之比为
四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根:Si与O的原子数之比为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】碘及其化合物在生产、生活中有着广泛的应用。回答下列问题:已知: 电负性: H 2.20; C 2.55; F 3.98; P 2.19; I 2.66
(1)人工合成的 131I是医疗上常用的放射性同位素,基态碘原子价层电子排布式为___________ 。
(2)碘单质在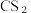 中的溶解度比在水中的大,解释原因
中的溶解度比在水中的大,解释原因___________ 。
(3)HI 主要用于药物合成,通常用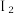 和P反应生成
和P反应生成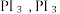 再水解制HI。
再水解制HI。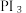 的空间结构是
的空间结构是___________ (用文字描述),PI₃水解生成 HI的化学方程式是___________ 。
(4)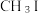 是一种甲基化试剂,
是一种甲基化试剂,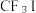 可用作制冷剂,
可用作制冷剂,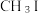 和
和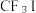 发生水解时的主要反应分别是:
发生水解时的主要反应分别是: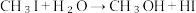 和
和 。
。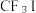 的水解产物是HIO,结合电负性解释原因
的水解产物是HIO,结合电负性解释原因___________ 。
(5) 晶体是一种性能良好的光学材料,其晶胞为立方体,边长为 a nm,晶胞中 K、I、O分别处于顶点、体心、面心位置,结构如图。
晶体是一种性能良好的光学材料,其晶胞为立方体,边长为 a nm,晶胞中 K、I、O分别处于顶点、体心、面心位置,结构如图。
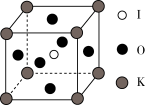
①与 K 原子紧邻的O原子有___________ 个。
② 中
中  里Ⅰ原子的杂化类型是
里Ⅰ原子的杂化类型是___________ 。
③若晶体的密度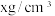 ,则阿伏加德罗常数
,则阿伏加德罗常数
___________  。 (用含x、a的表达式表示)
。 (用含x、a的表达式表示)
(1)人工合成的 131I是医疗上常用的放射性同位素,基态碘原子价层电子排布式为
(2)碘单质在
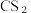 中的溶解度比在水中的大,解释原因
中的溶解度比在水中的大,解释原因(3)HI 主要用于药物合成,通常用
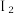 和P反应生成
和P反应生成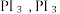 再水解制HI。
再水解制HI。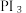 的空间结构是
的空间结构是(4)
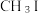 是一种甲基化试剂,
是一种甲基化试剂,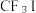 可用作制冷剂,
可用作制冷剂,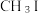 和
和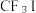 发生水解时的主要反应分别是:
发生水解时的主要反应分别是: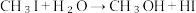 和
和 。
。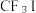 的水解产物是HIO,结合电负性解释原因
的水解产物是HIO,结合电负性解释原因(5)
 晶体是一种性能良好的光学材料,其晶胞为立方体,边长为 a nm,晶胞中 K、I、O分别处于顶点、体心、面心位置,结构如图。
晶体是一种性能良好的光学材料,其晶胞为立方体,边长为 a nm,晶胞中 K、I、O分别处于顶点、体心、面心位置,结构如图。
①与 K 原子紧邻的O原子有
②
 中
中  里Ⅰ原子的杂化类型是
里Ⅰ原子的杂化类型是③若晶体的密度
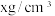 ,则阿伏加德罗常数
,则阿伏加德罗常数
 。 (用含x、a的表达式表示)
。 (用含x、a的表达式表示)
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐1】下列中所列的是五种短期周期元素原子的半径及主要化合价:
(1)C元素在周期表中的位置___ ;E原子的电子填充在___ 个轨道上,这些电子有___ 种不同的能量。
(2)B、D、E所代表元素的离子半径从大到小的顺序为___ (填离子符号)
(3)C与E形成的化合物属于__ 晶体。
(4)已知X是与E同族的另一短周期元素,有人认为:H-E键的键能大于H-X键的键能,所以H2E的沸点高于H2X的沸点。你是否赞同这种观点___ (“赞同”或“不赞同”),理由:___ 。
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.111 | 0.064 | 0.117 | 0.160 | 0.066 |
| 主要化合物 | +2 | -1 | +4,-4 | +2 | -2 |
(2)B、D、E所代表元素的离子半径从大到小的顺序为
(3)C与E形成的化合物属于
(4)已知X是与E同族的另一短周期元素,有人认为:H-E键的键能大于H-X键的键能,所以H2E的沸点高于H2X的沸点。你是否赞同这种观点
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】有A、B、C、D、E、F、G七种短周期主族元素,它们的原子序数依次增大。B元素的最高正价与最低负价的绝对值相等,D元素原子最外层电子数是次外层电子数的3倍,E元素在同周期中半径最大,F元素是在地壳中的含量最高的金属元素;A与B、C、D分别构成电子数相等的分子Q、X、Y;化合物AG在空气中与X反应产生白烟Z。请回答下列问题:
(1)BD2的结构式为_______ ;E2D2的电子式_______ 。
(2)Z为_______ 化合物(填“离子”、“共价”),Z受热分解的过程中破坏的化学键有_______ (填序号)。
①极性键 ②非极性键 ③离子键 ④分子间作用力 ⑤氢键
(3)在元素D的同主族元素形成的氢化物中,Y的沸点反常,原因是_______ 。
(4)D、E、F、G形成的简单离子半径由大到小的顺序_______ 。(填离子符号)
(5)气体(BC)2称为拟卤素,其性质与卤素类似,(BC)2的结构式为_______ ,(BC)2与氢氧化钠溶液反应的离子方程式_______ 。
(1)BD2的结构式为
(2)Z为
①极性键 ②非极性键 ③离子键 ④分子间作用力 ⑤氢键
(3)在元素D的同主族元素形成的氢化物中,Y的沸点反常,原因是
(4)D、E、F、G形成的简单离子半径由大到小的顺序
(5)气体(BC)2称为拟卤素,其性质与卤素类似,(BC)2的结构式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为 40%,且其核内质子数等于中子数。化合物R是由A、D两元素形成的离子化合物,其中A+阳离子与Dn-阴离子数之比为2∶1。请回答下列问题:
(1)B-的电子排布式为______________ ,在CB3分子中C元素原子的原子轨道发生的是______ 杂化。
(2)C的氢化物的空间构型为________________ ,其氢化物在同族元素所形成的氢化物中沸点最高的原因是__________________________________________________________ 。
(3)B元素的电负性____ D元素的电负性(填“>”、“<”或“=”),用一个 化学方程式说明B、D两元素形成的单质的氧化性强弱:________________________________ 。
(4)如图所示是R形成的晶体的晶胞,设晶胞的棱长为a cm。 试计算R晶体的密度为_________________ 。(阿伏伽德罗常数用NA表示)

(1)B-的电子排布式为
(2)C的氢化物的空间构型为
(3)B元素的电负性
(4)如图所示是R形成的晶体的晶胞,设晶胞的棱长为a cm。 试计算R晶体的密度为

您最近一年使用:0次



