氢气的生产、存储是氢能应用的核心。目前较成熟的生产、存储路线之一为:利用甲醇(CH3OH)和H2O在Cu/Zn—Al催化剂存在下生产H2,H2与Mg在一定条件下化合制得储氢物质MgH2。
回答问题:
(1)根据原子核外电子排布特征
①Al在元素周期表中位于_______ 区(填“s”“p”“d”或“ds”)。
②基态Al原子的轨道表示式是_______ 。
③基态29Cu原子的价层电子排布式是_______ 。
(2)组成CH3OH分子的三种元素中,电负性最大的元素是_______ 。
(3)键能是衡量共价键稳定性的参数之一、甲醇的结构式为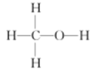 (可看作甲烷分子中的一个H原子被羟基取代的产物)。
(可看作甲烷分子中的一个H原子被羟基取代的产物)。
①甲醇分子的键参数中有_______ 种键能数据。
②由甲醇与水分子中都含有H-O键,解释“甲醇为非电解质,而水为弱电解质”的原因_______ 。
(4)作为储氢材料的MgH2,能发生水解反应产生氢气,该反应的化学方程式是_______ 。
回答问题:
(1)根据原子核外电子排布特征
①Al在元素周期表中位于
②基态Al原子的轨道表示式是
③基态29Cu原子的价层电子排布式是
(2)组成CH3OH分子的三种元素中,电负性最大的元素是
(3)键能是衡量共价键稳定性的参数之一、甲醇的结构式为
 (可看作甲烷分子中的一个H原子被羟基取代的产物)。
(可看作甲烷分子中的一个H原子被羟基取代的产物)。①甲醇分子的键参数中有
②由甲醇与水分子中都含有H-O键,解释“甲醇为非电解质,而水为弱电解质”的原因
(4)作为储氢材料的MgH2,能发生水解反应产生氢气,该反应的化学方程式是
更新时间:2021/02/03 23:09:40
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
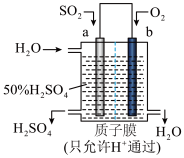
【推荐1】(1)氢氧燃料电池是一种高效无污染的清洁电池它分碱性(用KOH做电解质)和酸性(用硫酸做电解质)燃料电池。如果是酸性燃料电池,则正极反应方程式是___ 。
(2)科研人员设想用如图原电池装置生产硫酸,则负极的电极反应式为___ 。
(3)二氯化二硫(S2Cl2)是一种琥珀色液体,是合成硫化染料的重要原料。
a.S2Cl2分子中所有原子都满足8电子稳定结构,写出它的电子式__ ;
b.指出它分子内的键型__ 。
(4)分子式为C5H12O的有机物,能与金属钠反应产生氢气的有__ 种,其中能够发生催化氧化生成醛的有___ 种。
(5)乙烷中混有丙烯杂质,写出除杂的化学反应方程式__ 。
(2)科研人员设想用如图原电池装置生产硫酸,则负极的电极反应式为

(3)二氯化二硫(S2Cl2)是一种琥珀色液体,是合成硫化染料的重要原料。
a.S2Cl2分子中所有原子都满足8电子稳定结构,写出它的电子式
b.指出它分子内的键型
(4)分子式为C5H12O的有机物,能与金属钠反应产生氢气的有
(5)乙烷中混有丙烯杂质,写出除杂的化学反应方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】碱金属元素和卤族元素广泛存在,用化学用语回答下列问题。
(1)氢氟酸可以用来雕刻玻璃。用电子式表示氟化氢的形成过程__________ 。
(2)过氧化钠可以用于潜水艇中氧气的来源,其与二氧化碳反应的化学方程式是_____ 。
(3)次氯酸钠溶液(pH>7)和溴化钠溶液混合,可以作为角膜塑形镜的除蛋白液。二者混合后,溶液变成淡黄色,该反应的离子方程式是_____________________ 。
(4)Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2 = 4LiCl +S +SO2。组装该电池必须在无水条件下进行,原因是_____________ (用化学方程式表示)。
(5)关于碱金属和卤族元素,下列说法一定正确的是____________ 。
A.从上到下,单质密度依次增大 B.从上到下,单质熔沸点依次升高
C.从上到下,原子半径依次增大 D.单质都可以与水反应
(6)常温下,KMnO4固体和浓盐酸反应产生氯气。为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
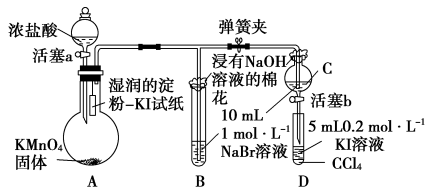
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为红棕色时,关闭活塞a。
Ⅳ.……
①验证氯气的氧化性强于碘的实验现象是____________________ 。
②B中溶液发生反应的离子方程式是__________________________ 。
③为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是______________ 。
(1)氢氟酸可以用来雕刻玻璃。用电子式表示氟化氢的形成过程
(2)过氧化钠可以用于潜水艇中氧气的来源,其与二氧化碳反应的化学方程式是
(3)次氯酸钠溶液(pH>7)和溴化钠溶液混合,可以作为角膜塑形镜的除蛋白液。二者混合后,溶液变成淡黄色,该反应的离子方程式是
(4)Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2 = 4LiCl +S +SO2。组装该电池必须在无水条件下进行,原因是
(5)关于碱金属和卤族元素,下列说法一定正确的是
A.从上到下,单质密度依次增大 B.从上到下,单质熔沸点依次升高
C.从上到下,原子半径依次增大 D.单质都可以与水反应
(6)常温下,KMnO4固体和浓盐酸反应产生氯气。为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为红棕色时,关闭活塞a。
Ⅳ.……
①验证氯气的氧化性强于碘的实验现象是
②B中溶液发生反应的离子方程式是
③为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】亚硝酰氯( ,熔点:
,熔点: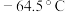 ,沸点:
,沸点: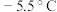 )是一种黄色气体,遇水易水解生成
)是一种黄色气体,遇水易水解生成 和
和 。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气 和
和 ,制备装置如图所示:
,制备装置如图所示:
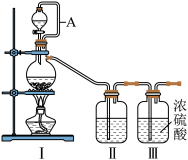
为制备纯净干燥的气体,补充表中缺少的药品
(2)乙组同学利用甲组制得的 和
和 制备
制备 ,装置如图所示:
,装置如图所示:
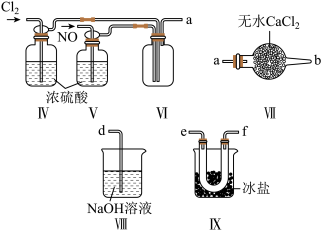
① 分子中各原子均满足8电子稳定结构,则
分子中各原子均满足8电子稳定结构,则 的电子式为
的电子式为_______ ;
②装置连接顺序为a→_______ (按气流自左向右方向,用小写字母表示);
③装置Ⅳ、Ⅴ除了可进一步干燥 、
、 外,另一作用是
外,另一作用是_______ ;
④装置Ⅷ中吸收尾气时, 发生反应的化学方程式为
发生反应的化学方程式为_______ 。
 ,熔点:
,熔点: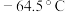 ,沸点:
,沸点: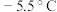 )是一种黄色气体,遇水易水解生成
)是一种黄色气体,遇水易水解生成 和
和 。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。(1)甲组的同学拟制备原料气
 和
和 ,制备装置如图所示:
,制备装置如图所示:
为制备纯净干燥的气体,补充表中缺少的药品
| 装置I | 装置Ⅱ | ||
| 烧瓶中 | 分液漏斗中 | ||
制备纯净的 |  | ①浓盐酸 | ② |
制备纯净的 |  | ③ | ④水 |
 和
和 制备
制备 ,装置如图所示:
,装置如图所示:
①
 分子中各原子均满足8电子稳定结构,则
分子中各原子均满足8电子稳定结构,则 的电子式为
的电子式为②装置连接顺序为a→
③装置Ⅳ、Ⅴ除了可进一步干燥
 、
、 外,另一作用是
外,另一作用是④装置Ⅷ中吸收尾气时,
 发生反应的化学方程式为
发生反应的化学方程式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】元素周期表中某些过渡元素(如V、Zn、Cr等)在生产、生活中有着广泛的应用。
(1)基态钒原子的价层电子排布式为_______ 。
(2)根据价层电子对互斥理论,NH3、NO 、NO
、NO 中,中心原子价层电子对数不同于其他两种粒子的是
中,中心原子价层电子对数不同于其他两种粒子的是_______ (填化学式); NO 与NO
与NO 中O-N-O的键角: NO
中O-N-O的键角: NO
________ NO (填“<”、“>”、“=”)。
(填“<”、“>”、“=”)。
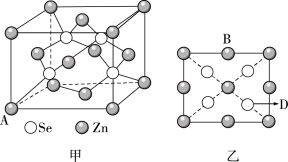
(3)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示(与SiC 类似),乙图为甲图的俯视图,若A点坐标为(0,0,0),B点坐标为( ,1,
,1, ),则D点坐标为
),则D点坐标为_______ ,在晶胞中距离Se最近且等距离的Zn组成的空间结构为_______ 形。若晶胞参数为acm,则晶体的密度为_______ g·cm-3 (用NA表示阿伏加德罗常数)。
(1)基态钒原子的价层电子排布式为
(2)根据价层电子对互斥理论,NH3、NO
 、NO
、NO 中,中心原子价层电子对数不同于其他两种粒子的是
中,中心原子价层电子对数不同于其他两种粒子的是 与NO
与NO 中O-N-O的键角: NO
中O-N-O的键角: NO
 (填“<”、“>”、“=”)。
(填“<”、“>”、“=”)。(3)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示(与SiC 类似),乙图为甲图的俯视图,若A点坐标为(0,0,0),B点坐标为(
 ,1,
,1, ),则D点坐标为
),则D点坐标为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】硼元素及其化合物具有各异的结构与性质。氮化硼(BN)晶体有多种相结构。六方相氮化硼与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如下图所示。
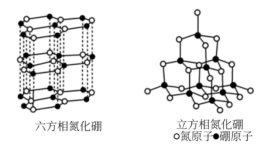
(1)基态硼原子的电子排布式为_______ 。
(2)关于这两种晶体的说法,正确的是_______ (填序号)。
a.立方相氮化硼含有σ键和π键,所以硬度大
b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体中的B-N键均为共价键
d.两种晶体均为分子晶体
(3)六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为_______ ,其结构与石墨相似却不导电,原因是_______ 。
(4)NH4BF4是合成氮化硼纳米管的原料之一,1molNH4BF4含有_______ mol配位键。
(5)常温常压下硼酸(H3BO3)晶体结构为层状,其二维平面结构如下图所示。
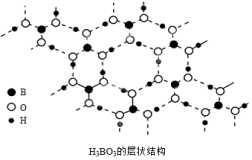
①1molH3BO3晶体中含有_______ mol氢键。
②请从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大的原因:_______ 。
(6)硼氢化钠是一种常用的还原剂。其晶胞结构如下图所示。
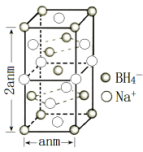
回答下列问题:
①H3BO3分子中的O—B—O的键角_______ (填“大于”、“等于”或“小于”)BH 中的H—B—H的键角,判断依据是
中的H—B—H的键角,判断依据是_______ 。
②若硼氢化钠晶胞上下底心处的Na+被Li+取代,得到的晶体的化学式为_______ 。

(1)基态硼原子的电子排布式为
(2)关于这两种晶体的说法,正确的是
a.立方相氮化硼含有σ键和π键,所以硬度大
b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体中的B-N键均为共价键
d.两种晶体均为分子晶体
(3)六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为
(4)NH4BF4是合成氮化硼纳米管的原料之一,1molNH4BF4含有
(5)常温常压下硼酸(H3BO3)晶体结构为层状,其二维平面结构如下图所示。

①1molH3BO3晶体中含有
②请从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大的原因:
(6)硼氢化钠是一种常用的还原剂。其晶胞结构如下图所示。

回答下列问题:
①H3BO3分子中的O—B—O的键角
 中的H—B—H的键角,判断依据是
中的H—B—H的键角,判断依据是②若硼氢化钠晶胞上下底心处的Na+被Li+取代,得到的晶体的化学式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐3】A、B、C是中学化学中常见的三种短周期元素。
已知:①A元素原子最外层电子数是次外层电子数的2倍;②B元素最高正价与最低负价的代数和为2;③C元素有多种化合价,且常温下C元素的单质与某种一元强碱溶液反应,可得到两种含C元素的化合物;④B、C两种元素质子数之和是A元素质子数的4倍。
(1)写出A元素在周期表中的位置:___________ 。
(2)画出B元素的原子结构示意图:___________ 。
(3)写出C元素的核外电子排布式:___________ 。
(4)写出C的单质和强碱溶液反应的离子方程式___________ 。
(5)由B、C两种元素组成的化合物x,常温下为易挥发的淡黄色液体,X分子为三角锥形分子。且分子里B、C两种原子最外层均达到8个电子的稳定结构。X遇水蒸气可形成一种常见的漂白性物质。则X的电子式为___________ ,X与水反应的化学方程式是___________ 。
已知:①A元素原子最外层电子数是次外层电子数的2倍;②B元素最高正价与最低负价的代数和为2;③C元素有多种化合价,且常温下C元素的单质与某种一元强碱溶液反应,可得到两种含C元素的化合物;④B、C两种元素质子数之和是A元素质子数的4倍。
(1)写出A元素在周期表中的位置:
(2)画出B元素的原子结构示意图:
(3)写出C元素的核外电子排布式:
(4)写出C的单质和强碱溶液反应的离子方程式
(5)由B、C两种元素组成的化合物x,常温下为易挥发的淡黄色液体,X分子为三角锥形分子。且分子里B、C两种原子最外层均达到8个电子的稳定结构。X遇水蒸气可形成一种常见的漂白性物质。则X的电子式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】元素锑(Sb)位于周期表第五周期ⅤA族,科研工作者精准合成了SbxOy、SbI3•3S8等二维无机分子晶体,为潜在的分子电子设备研究创设了机会;合成了Na[Sb(PDTA)]•H2O等配合物,在冶金工业中应用广泛。
(1)基态S原子的价电子轨道表示式(排布图)为_____ 。
(2)SbI3中心原子的杂化方式为______ ;第一电离能:I1(Sb)<I1(I),原因是_____ 。
(3)SbI3•3S8双分子晶体中存在的微粒间作用力有_____ 。
A.离子键 B.π键 C.非极性共价键 D.氢键 E.范德华力
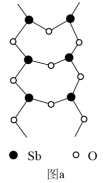
(4)SbxOy的一种双链基本结构单元如图a,则其化学式为_____ 。
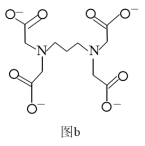
(5)PDTA的结构如图b,Na[Sb(PDTA)]•H2O中心原子的配位数为6,则配位原子是_____ 。
(1)基态S原子的价电子轨道表示式(排布图)为
(2)SbI3中心原子的杂化方式为
(3)SbI3•3S8双分子晶体中存在的微粒间作用力有
A.离子键 B.π键 C.非极性共价键 D.氢键 E.范德华力
(4)SbxOy的一种双链基本结构单元如图a,则其化学式为

(5)PDTA的结构如图b,Na[Sb(PDTA)]•H2O中心原子的配位数为6,则配位原子是

您最近一年使用:0次
【推荐2】X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表
回答下列问题:
(1)Y的氢化物空间构型是_________
(2)XY2是一种常用的溶剂,XY2的分子中存在_________ 个σ键,_________ 个π键。在H-Y,H-Z两种共价键中,键的极性较强的是_________ ,键长较长的是在_________ 。
(3)XZ4分子中X以______ 方式杂化。
(4)写出W元素简化的原子核外电子排布式_________ ,Z的价电子排布图_________
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下。Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
(1)Y的氢化物空间构型是
(2)XY2是一种常用的溶剂,XY2的分子中存在
(3)XZ4分子中X以
(4)写出W元素简化的原子核外电子排布式
您最近一年使用:0次
【推荐3】回答下列问题:
(1)钒(23V)是元素广泛用于催化及钢铁工业。钒在元素周期表中的位置为第四周期第___________ 族,其价层电子的轨道表示式为___________ 。第四周期未成对电子数最多的元素是___________ (填元素符号)。
(2)E元素基态原子的M层全充满,N层没有成对电子且只有一个未成对电子、E的元素符号为___________ ,其正二价离子的电子排布式为___________ 。
(3)铝原子核外电子共有___________ 种不同能量的电子。
(4)丁二酮肟(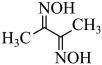 )中涉及元素的电负性由大到小的顺序为
)中涉及元素的电负性由大到小的顺序为___________ ,氮同周期的硼在成键时,能将一个2s电子激发进入2p能级参与形成化学键,请写出该激发态原子的价电子轨道表示式:___________ 。该过程形成的原子光谱为___________ (填“吸收”或“发射”)光谱。
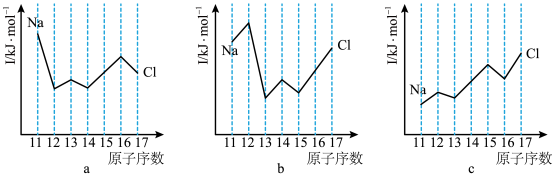
(5)与Si同周期的部分元素的电离能如图所示,其中a、b和c分别代表___________(填字母)
(1)钒(23V)是元素广泛用于催化及钢铁工业。钒在元素周期表中的位置为第四周期第
(2)E元素基态原子的M层全充满,N层没有成对电子且只有一个未成对电子、E的元素符号为
(3)铝原子核外电子共有
(4)丁二酮肟(
 )中涉及元素的电负性由大到小的顺序为
)中涉及元素的电负性由大到小的顺序为(5)与Si同周期的部分元素的电离能如图所示,其中a、b和c分别代表___________(填字母)

A. 为 为 ,b为 ,b为 ,c为 ,c为 | B. 为 为 ,b为 ,b为 ,c为 ,c为 |
C. 为 为 ,b为 ,b为 ,c为 ,c为 | D. 为 为 ,b为 ,b为 ,c为 ,c为 |
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐1】D、E、F、X、Y、Z为前四周期元素,且原子序数依次增大。D的最高正价和最低负价的绝对值相等;E有三个能级,且每个能级上的电子数相等;F原子未成对电子数在同周期元素中最多;X与F同周期,第一电离能比F低;Y与E同主族,Z的最外层只有一个电子,其他电子层电子均处于饱和状态。请回答下列问题:
(1)Y基态原子的核外电子排布式为____ ;基态Z原子中电子占据的最高能层符号为___ 。
(2)E、F、X的电负性由小到大的顺序为_____ (用元素符号表示)。
(3)D、E、F、X形成的有机化合物EX(FD2)2中E的杂化轨道类型为____ ,F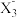 的空间结构是
的空间结构是____ 。
(4)下列关于E2D2分子和D2X2分子的说法正确的是____ (填字母)。
a.分子中都含σ键和π键
b.E2D2分子的沸点明显低于D2X2分子的沸点
c.都是含极性键和非极性键的非极性分子
(1)Y基态原子的核外电子排布式为
(2)E、F、X的电负性由小到大的顺序为
(3)D、E、F、X形成的有机化合物EX(FD2)2中E的杂化轨道类型为
 的空间结构是
的空间结构是(4)下列关于E2D2分子和D2X2分子的说法正确的是
a.分子中都含σ键和π键
b.E2D2分子的沸点明显低于D2X2分子的沸点
c.都是含极性键和非极性键的非极性分子
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】碳材料在生活中占有重要地位。
请回答:
(2)图 1 中 C—C 键键长为 apm,则石墨烯的密度ρ=______________ g/cm2 (用含 a 式子表示,阿伏伽德罗常数为 NA)
(3)尿素[(NH2)2CO]可以与正烷烃(n~CmH2m+2,m≥8)形成超分子包合物。尿素中各种元素的电负性由大到小的顺序________________ ,尿素分子通过______________________ 氢键(写出具体形式)
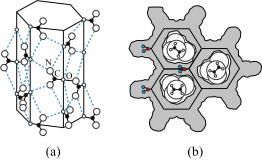
有序地组合成具有蜂窝状六角形通道结构的接受体,如(a)所示。正烷烃分子作为底物填入到通道之中,图(b)示出垂直于通道截面的结构。该超分子包合物能稳定存在的原因是_________________________ 。
请回答:
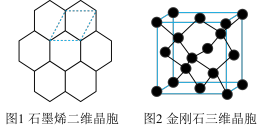
| A.石墨烯碳采用 sp2杂化,金刚石 VSPRE 模型为正四面体形 |
| B.多层石墨烯和金刚石均为共价型晶体 |
| C.1mol 石墨烯与金刚石中,σ键键数之比为 3:4 |
| D.石墨烯中 C—C 键键能较金刚石大,故石墨烯的内能更高 |
(3)尿素[(NH2)2CO]可以与正烷烃(n~CmH2m+2,m≥8)形成超分子包合物。尿素中各种元素的电负性由大到小的顺序
有序地组合成具有蜂窝状六角形通道结构的接受体,如(a)所示。正烷烃分子作为底物填入到通道之中,图(b)示出垂直于通道截面的结构。该超分子包合物能稳定存在的原因是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】金属镍及其化合物在合金材料以及催化剂等方面应用广泛。
(1)基态镍原子价电子排布式为___________ 。
(2)丁二酮肟( )是检验Ni2+的灵敏试剂,常与Ni2+形成图I所示的配合物,图II是硫代氧的结果:
)是检验Ni2+的灵敏试剂,常与Ni2+形成图I所示的配合物,图II是硫代氧的结果:
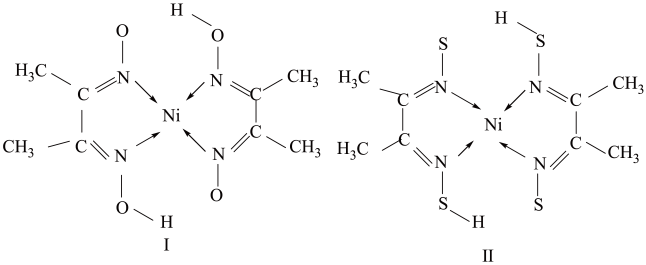
①下列说法正确的有___________ (填字母)。
A.在I中N元素的电负性最大 B.在I中C-C-C键角是180°
C.在II中-SH 上的S原子采取sp3杂化 D.在II中存在σ键、Π键与配位键
②化合物I的熔、沸点高于化合物II的原因是___________ 。
(3)工业上选用硫酸和硝酸的混酸与Ni反应制备NiSO4。写出与SO 互为等电子体的一种分子
互为等电子体的一种分子___________ 。Fe、Co、Ni三种元素二价离子的硫酸盐晶体的晶胞类型相同,其熔点由高到低的顺序为___________ 。
(4)Ni和La的合金是目前使用广泛的储氢材料。该合金的晶胞结构如图所示。
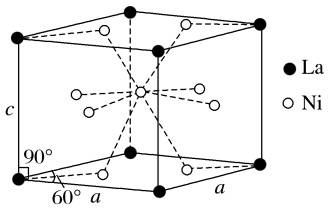
①设该合金的密度为dg/cm3,则该晶胞的体积为___________ cm3(用含 d的代数式表示,NA表示阿伏加德罗常数的值)
②该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子时比较稳定。已知:a=500pm,c=400pm;标准状况下氢气的密度为9.00×10-5g/cm3; 储氢能力= 。若忽略储氢前后晶胞的体积变化,则该合金的储氢能力为
。若忽略储氢前后晶胞的体积变化,则该合金的储氢能力为___________ (列出最简计算式,计算式不使用小数。NA表示阿伏加德罗常数的值)。
(1)基态镍原子价电子排布式为
(2)丁二酮肟(
 )是检验Ni2+的灵敏试剂,常与Ni2+形成图I所示的配合物,图II是硫代氧的结果:
)是检验Ni2+的灵敏试剂,常与Ni2+形成图I所示的配合物,图II是硫代氧的结果:
①下列说法正确的有
A.在I中N元素的电负性最大 B.在I中C-C-C键角是180°
C.在II中-SH 上的S原子采取sp3杂化 D.在II中存在σ键、Π键与配位键
②化合物I的熔、沸点高于化合物II的原因是
(3)工业上选用硫酸和硝酸的混酸与Ni反应制备NiSO4。写出与SO
 互为等电子体的一种分子
互为等电子体的一种分子(4)Ni和La的合金是目前使用广泛的储氢材料。该合金的晶胞结构如图所示。

①设该合金的密度为dg/cm3,则该晶胞的体积为
②该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子时比较稳定。已知:a=500pm,c=400pm;标准状况下氢气的密度为9.00×10-5g/cm3; 储氢能力=
 。若忽略储氢前后晶胞的体积变化,则该合金的储氢能力为
。若忽略储氢前后晶胞的体积变化,则该合金的储氢能力为
您最近一年使用:0次



