硒(Se)和铜(Cu)在生产生活中有广泛的应用。氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如图所示:
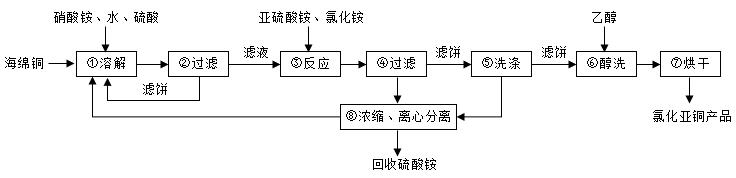
请回答下列问题:
(1)步骤①中主要成分发生的离子反应方程式是:___ 。
(2)写出步骤③中主要反应的离子方程式:___ 。
(3)步骤⑤包括用pH=2的溶液酸洗、水洗两步操作,酸洗采用的酸是___ (写酸的名称)。
(4)上述工艺中,步骤⑥和⑦的作用是___ 。
(5)Se为ⅥA族元素,用乙二胺四乙酸铜阴离子水溶液和硒代硫酸钠(Na2SeSO3)溶液反应可获得纳米硒化铜,硒代硫酸钠还可用于Se的精制,写出硒代硫酸钠(Na2SeSO3)与H2SO4溶液反应得到精硒的化学方程式:___ 。
(6)氯化亚铜产率与温度、溶液pH关系如图所示。据图分析,流程化生产氯化亚铜的过程中,温度过低影响CuCl产率的原因是___ ;温度过高、pH过大也会影响CuCl产率的原因是___ 。
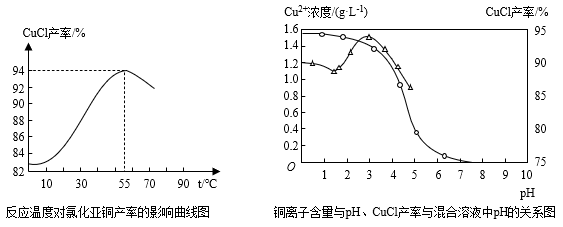
(7)用NaHS作污水处理的沉淀剂,可以处理工业废水中的Cu2+。已知:25℃时,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15,CuS的溶度积为Ksp(CuS)=6.3×10-36。反应Cu2+(aq)+HS-(aq) CuS(s)+H+(aq)的平衡常数K=
CuS(s)+H+(aq)的平衡常数K=___ (结果保留1位小数)。

请回答下列问题:
(1)步骤①中主要成分发生的离子反应方程式是:
(2)写出步骤③中主要反应的离子方程式:
(3)步骤⑤包括用pH=2的溶液酸洗、水洗两步操作,酸洗采用的酸是
(4)上述工艺中,步骤⑥和⑦的作用是
(5)Se为ⅥA族元素,用乙二胺四乙酸铜阴离子水溶液和硒代硫酸钠(Na2SeSO3)溶液反应可获得纳米硒化铜,硒代硫酸钠还可用于Se的精制,写出硒代硫酸钠(Na2SeSO3)与H2SO4溶液反应得到精硒的化学方程式:
(6)氯化亚铜产率与温度、溶液pH关系如图所示。据图分析,流程化生产氯化亚铜的过程中,温度过低影响CuCl产率的原因是

(7)用NaHS作污水处理的沉淀剂,可以处理工业废水中的Cu2+。已知:25℃时,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15,CuS的溶度积为Ksp(CuS)=6.3×10-36。反应Cu2+(aq)+HS-(aq)
 CuS(s)+H+(aq)的平衡常数K=
CuS(s)+H+(aq)的平衡常数K=
21-22高三上·四川南充·阶段练习 查看更多[2]
更新时间:2021-01-15 20:28:06
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】氧化亚铜(Cu2O)是一种附加值较高的铜类物质,某工厂以硫化铜矿石(含CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
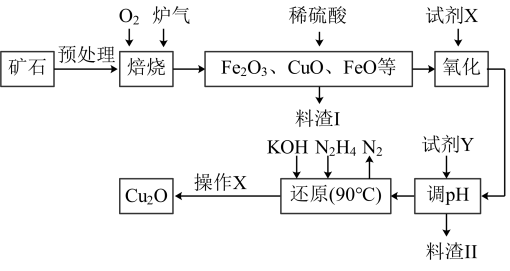
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
(1)炉气中的有害气体成分是_______ ,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为_______ 。
(2)若试剂X是H2O2溶液,写出相应反应的离子方程式:_______ 。
(3)加入试剂Y调pH时,pH的调控范围是_______ 。
(4)写出用N2H4制备Cu2O的化学方程式:______ ,操作X包括过滤、洗涤、烘干,其中过滤后,可以通过______ 的方法检验固体物质是否已被洗涤干净。
(5)Cu2O也常用电解法制备,流程如下:
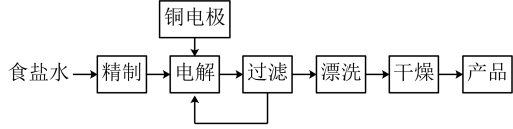
已知:①Cu2O为暗红色的固体,有毒 ②部分难溶物的颜色和常温下的Ksp如下表所示:
实验室模拟电解装置如图所示,观察到的现象如下:

①开始无明显现象,随后液面以下的铜棒表面逐渐变暗;
②5 min后,b极附近开始出现白色沉淀,并逐渐增多,且向a极扩散;
③10 min后,最靠近a极的白色沉淀开始变成红色;
④12 min后,b极附近的白色沉淀开始变成黄色,然后逐渐变成橙黄色;
⑤a极一直有大量气泡产生;
⑥停止电解,将U形管中悬浊液静置一段时间后,上层溶液呈无色,没有出现蓝色,下层沉淀全部显红色。则:
①电解池的阳极反应式为_____ 。
②b极附近的白色沉淀开始变成黄色,此时溶液中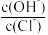 =
=_____ 。

常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀 | 7.5 | 2.7 | 4.8 |
完全沉淀 | 9.0 | 3.7 | 6.4 |
(2)若试剂X是H2O2溶液,写出相应反应的离子方程式:
(3)加入试剂Y调pH时,pH的调控范围是
(4)写出用N2H4制备Cu2O的化学方程式:
(5)Cu2O也常用电解法制备,流程如下:

已知:①Cu2O为暗红色的固体,有毒 ②部分难溶物的颜色和常温下的Ksp如下表所示:
| 难溶物 | Cu(OH)2 | CuOH | CuCl | Cu2O |
| 颜色 | 蓝色 | 黄色 | 白色 | 红色 |
| Ksp(25 ℃) | 1.6×10-19 | 1.0×10-14 | 1.2×10-6 | — |

①开始无明显现象,随后液面以下的铜棒表面逐渐变暗;
②5 min后,b极附近开始出现白色沉淀,并逐渐增多,且向a极扩散;
③10 min后,最靠近a极的白色沉淀开始变成红色;
④12 min后,b极附近的白色沉淀开始变成黄色,然后逐渐变成橙黄色;
⑤a极一直有大量气泡产生;
⑥停止电解,将U形管中悬浊液静置一段时间后,上层溶液呈无色,没有出现蓝色,下层沉淀全部显红色。则:
①电解池的阳极反应式为
②b极附近的白色沉淀开始变成黄色,此时溶液中
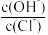 =
=
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐2】某同学用含结晶水的碱式盐X(四种元素组成的纯净物)进行了如下实验:
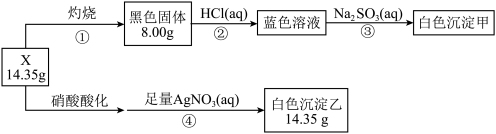
白色沉淀甲的组成元素与蓝色溶液的溶质相同,且组成的元素原子物质的量之比为1:1。请回答:
(1)X中含有的元素除了H、O之外,还含有的元素是___ 、____ 。
(2)白色沉淀甲的化学式是___ ,X的化学式是___ 。
(3)步骤③的离子方程式是___ 。
(4)在一定的温度下,将空气不断通入白色沉淀甲的悬浊液中可得到X,该反应的化学方程式是___ 。

白色沉淀甲的组成元素与蓝色溶液的溶质相同,且组成的元素原子物质的量之比为1:1。请回答:
(1)X中含有的元素除了H、O之外,还含有的元素是
(2)白色沉淀甲的化学式是
(3)步骤③的离子方程式是
(4)在一定的温度下,将空气不断通入白色沉淀甲的悬浊液中可得到X,该反应的化学方程式是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】某实验小组拟用碱性烂版液{主要成分为[Cu(NH3)4]Cl2和Cu(OH)2}为原料制取摩尔盐,并回收铜单质,设计流程如图:

已知:温度超过60℃时, FeSO4在溶液中易形成FeSO4·H2O白色晶体,且一旦产生则难以消失。摩尔盐能溶于水,难溶于乙醇。
请回答下列问题:
(1)写出[Cu(NH3)4]Cl2与稀硫酸反应的离子方程式_______ 。
(2)实验中第一步所用硫酸浓度为4mol/L,不能太小,原因是_______ 。
(3)关于该实验过程的下列说法中正确的是_______ 。

A.所加铁粉应该先用饱和碳酸钠溶液浸泡除去表面的油污,然后用倾析法分离,倾析法操作如图所示:
B.溶液A.与铁粉反应,若温度高于60℃,会导致回收的铜不纯净
C.硫酸铵的用量,可以由溶解的铁粉的量决定,即溶解l mol铁粉,则所加硫酸铵也约为1 mol
D.溶液B的pH控制在5~6之间,若pH过高, 可用硫酸调节,以抑制Fe2+水解
(4)为从溶液C中得到较纯的摩尔盐,请选择下列合适的操作并排序:_______ 。
①用少量冰水洗涤 ②蒸发至较多晶体出现 ③溶液中加入无水乙醇 ④抽滤 ⑤冷却结晶 ⑥干燥
(5)如何检验摩尔盐已经洗涤干净:_______ 。
(6)为了测定产品中摩尔盐(M=392g/mol)的含量,某同学用分析天平称取5.220 g的产品置于锥形瓶中,加适量去氧水溶解后用0.080 mol/L的酸性KMnO4溶液滴定,滴定时读数如图,测得产品纯度为_______ 。


已知:温度超过60℃时, FeSO4在溶液中易形成FeSO4·H2O白色晶体,且一旦产生则难以消失。摩尔盐能溶于水,难溶于乙醇。
请回答下列问题:
(1)写出[Cu(NH3)4]Cl2与稀硫酸反应的离子方程式
(2)实验中第一步所用硫酸浓度为4mol/L,不能太小,原因是
(3)关于该实验过程的下列说法中正确的是

A.所加铁粉应该先用饱和碳酸钠溶液浸泡除去表面的油污,然后用倾析法分离,倾析法操作如图所示:
B.溶液A.与铁粉反应,若温度高于60℃,会导致回收的铜不纯净
C.硫酸铵的用量,可以由溶解的铁粉的量决定,即溶解l mol铁粉,则所加硫酸铵也约为1 mol
D.溶液B的pH控制在5~6之间,若pH过高, 可用硫酸调节,以抑制Fe2+水解
(4)为从溶液C中得到较纯的摩尔盐,请选择下列合适的操作并排序:
①用少量冰水洗涤 ②蒸发至较多晶体出现 ③溶液中加入无水乙醇 ④抽滤 ⑤冷却结晶 ⑥干燥
(5)如何检验摩尔盐已经洗涤干净:
(6)为了测定产品中摩尔盐(M=392g/mol)的含量,某同学用分析天平称取5.220 g的产品置于锥形瓶中,加适量去氧水溶解后用0.080 mol/L的酸性KMnO4溶液滴定,滴定时读数如图,测得产品纯度为

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】工业生产中利用方铅矿(主要成分为PbS,含有FeS2等杂质)制备PbSO4的工艺流程如图:
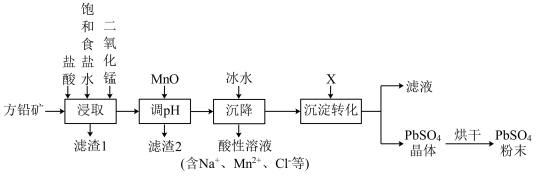
已知:①PbCl2难溶于冷水,易溶于热水。
②PbCl2(s)+2Cl-(aq) PbCl
PbCl (aq) ΔH>0
(aq) ΔH>0
③Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×10-5
(1)“浸取”时需要加热,充分反应后生成Na2PbCl4、S、FeCl3等物质,其中生成FeCl3的化学方程式为_______ 。
(2)“滤渣2”的主要成分是_______ 。
(3)“沉降”操作时加入冰水的原因是_______ 。
(4)上述流程中滤液可循环利用,试剂X是_______ (填化学式)。PbCl2经“沉淀转化”后得到PbSO4,若用1LX溶液转化5mol的PbCl2(忽略溶液体积变化),则X溶液的最初物质的量浓度不得低于_______ (精确到小数点后2位)。
(5)硫酸铅广泛应用于制造铅蓄电池。铅蓄电池的正极充电时,电极反应式为_______ 。充电过程中转移2mole—时,两电极材料质量共减少_______ g。

已知:①PbCl2难溶于冷水,易溶于热水。
②PbCl2(s)+2Cl-(aq)
 PbCl
PbCl (aq) ΔH>0
(aq) ΔH>0③Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×10-5
(1)“浸取”时需要加热,充分反应后生成Na2PbCl4、S、FeCl3等物质,其中生成FeCl3的化学方程式为
(2)“滤渣2”的主要成分是
(3)“沉降”操作时加入冰水的原因是
(4)上述流程中滤液可循环利用,试剂X是
(5)硫酸铅广泛应用于制造铅蓄电池。铅蓄电池的正极充电时,电极反应式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】通过绿柱石(xBeO•yAl2O3•zSiO2)获取BeO的常用方法有酸浸法和氟化法两种,其操作流程如图:
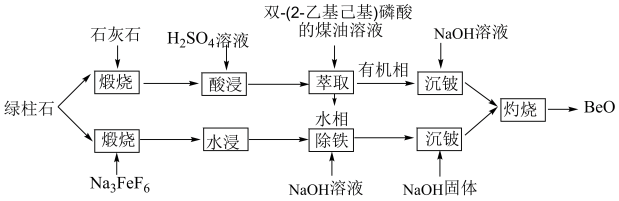
I.酸浸法:
(1)根据元素周期表“对角线原则”,Be与_______ 元素(填元素符号)性质相似。
(2)已知Be在有机相和水相中分配比(即萃取的浓度比)约为2:1,为了使Be2+的萃取率达到99%以上,可采用的有效措施有_______ 。
Ⅱ.氟化法:
(3)加Na3FeF6“煅烧”时,有Na2BeF4生成,其中[BeF4]2-的中心原子杂化方式为________ 。
(4)加入NaOH“除铁”,是为了除去过量的Na3FeF6,则发生反应的离子方程式为_______ 。
(5)常温下,加入NaOH“沉铍”,当pH=12时,沉铍率为________ (计算结果保留三位有效数字){已知:沉铍前,溶液中c(BeF )=0.2mol/L,沉铍后,溶液中c(F-)=0.2mol/L;Be2++4F-
)=0.2mol/L,沉铍后,溶液中c(F-)=0.2mol/L;Be2++4F- BeF
BeF ,K=2.5×1010;Ksp[Be(OH)2]=5.0×10-16}。若“沉铍”时pH过大,会导致沉铍率下降,原因是
,K=2.5×1010;Ksp[Be(OH)2]=5.0×10-16}。若“沉铍”时pH过大,会导致沉铍率下降,原因是________ 。
(6)绿柱石属于硅酸盐材料,其晶体结构中含有[Si6P18]环状硅酸盐单元;z轴方向上,相邻两层[Si6P18]环投影图如图甲,晶胞结构如图乙。
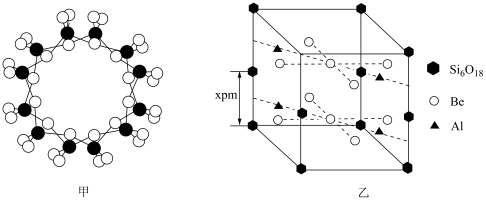

①z轴方向上,晶胞参数 为2xpm,而不是xpm的原因是
为2xpm,而不是xpm的原因是_______ 。
②已知:晶体中,Be、Al、Si均和氧配位,Be和Si的配位数(一个微粒周围最邻近的微粒的数目)均为4,氧的配位数有两种,分别为2和3,两种氧的个数比为1:2。通过计算可确定Al的配位数为________ 。

I.酸浸法:
(1)根据元素周期表“对角线原则”,Be与
(2)已知Be在有机相和水相中分配比(即萃取的浓度比)约为2:1,为了使Be2+的萃取率达到99%以上,可采用的有效措施有
Ⅱ.氟化法:
(3)加Na3FeF6“煅烧”时,有Na2BeF4生成,其中[BeF4]2-的中心原子杂化方式为
(4)加入NaOH“除铁”,是为了除去过量的Na3FeF6,则发生反应的离子方程式为
(5)常温下,加入NaOH“沉铍”,当pH=12时,沉铍率为
 )=0.2mol/L,沉铍后,溶液中c(F-)=0.2mol/L;Be2++4F-
)=0.2mol/L,沉铍后,溶液中c(F-)=0.2mol/L;Be2++4F- BeF
BeF ,K=2.5×1010;Ksp[Be(OH)2]=5.0×10-16}。若“沉铍”时pH过大,会导致沉铍率下降,原因是
,K=2.5×1010;Ksp[Be(OH)2]=5.0×10-16}。若“沉铍”时pH过大,会导致沉铍率下降,原因是(6)绿柱石属于硅酸盐材料,其晶体结构中含有[Si6P18]环状硅酸盐单元;z轴方向上,相邻两层[Si6P18]环投影图如图甲,晶胞结构如图乙。


①z轴方向上,晶胞参数
 为2xpm,而不是xpm的原因是
为2xpm,而不是xpm的原因是②已知:晶体中,Be、Al、Si均和氧配位,Be和Si的配位数(一个微粒周围最邻近的微粒的数目)均为4,氧的配位数有两种,分别为2和3,两种氧的个数比为1:2。通过计算可确定Al的配位数为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐3】磁性材料产业是21世纪各国竞相发展的高科技支柱产业之一,作为信息产业和机电工业的重要基础功能材料,磁性材料广泛应用于电子信息、军事技术等领域。碳酸锰主要用于制备软磁铁氧体,工业上以软锰矿(主要成分为MnO2)和黄铁矿(主要成分为FeS2)为主要原料制备碳酸锰的主要工艺流程如下:
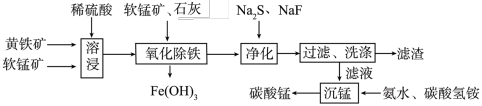
已知:几种金属离子沉淀的pH如下表。
回答下列问题:
(1)为了提高溶浸工序中原料的浸出效率,采取的措施不合理的有________ 。
A.搅拌 B.适当升高温度
C.研磨矿石 D.加入足量的蒸馏水
(2)溶浸过程中主要产生的离子为Fe3+、Mn2+、SO42-,请写出主要反应的离子方程式:___________ ;浸取后的溶液中含有少量Fe2+、Cu2+、Ca2+,则在加入石灰调节溶液的pH从而使铁元素被完全沉淀前,加入适量的软锰矿目的是______________________ ,加入石灰调节溶液pH的范围为____________________ 。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质,故滤渣主要是________ (填化学式)和CaF2。若测得滤液中c(F-)为0.01mol·L-1,则滤液中残留c(Ca2+)为________ mol·L-1[已知:Ksp(CaF2)=1.46×10-10]。
(4)有人认为净化工序中使用NaF会引起污染,建议用(NH4)2CO3代替NaF,但是用(NH4)2CO3代替NaF的缺点是______________________________________ 。
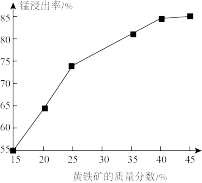
(5)如图为黄铁矿的质量分数对锰浸出率的影响,仅据图中信息,黄铁矿的质量分数应保持在________ %左右。

已知:几种金属离子沉淀的pH如下表。
| Fe2+ | Fe3+ | Cu2+ | Mn2+ | |
| 开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
| 完全沉淀的pH | 9.2 | 3.7 | 7.8 | 10.4 |
回答下列问题:
(1)为了提高溶浸工序中原料的浸出效率,采取的措施不合理的有
A.搅拌 B.适当升高温度
C.研磨矿石 D.加入足量的蒸馏水
(2)溶浸过程中主要产生的离子为Fe3+、Mn2+、SO42-,请写出主要反应的离子方程式:
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质,故滤渣主要是
(4)有人认为净化工序中使用NaF会引起污染,建议用(NH4)2CO3代替NaF,但是用(NH4)2CO3代替NaF的缺点是
(5)如图为黄铁矿的质量分数对锰浸出率的影响,仅据图中信息,黄铁矿的质量分数应保持在

您最近一年使用:0次
【推荐1】钨是熔点最高的金属,是重要的战略物资。自然界中钨主要存在于黑钨矿中,其主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含少量Si、As的化合物。由黑钨矿冶炼钨的工艺流程如图1:

已知:
①滤渣I的主要成份是Fe2O3、MnO2
②上述流程中,钨的化合价只有在最后一步发生改变。
③常温下钨酸难溶于水。
(1)钨酸盐(FeWO4、MnWO4)中钨元素的化合价为___ ,请写出MnWO4在熔融条件下发生碱分解反应生成Fe2O3的化学方程式___
(2)上述流程中向粗钨酸钠溶液中加硫酸中和至pH=10后,溶液中的杂质阴离子确SiO32-、HAsO32-、HAsO42-等,则“净化”过程中,加入H2O2时发生反应的离子方程式为___ ,滤渣Ⅱ的主要成分是___
(3)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。图2为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线,则:
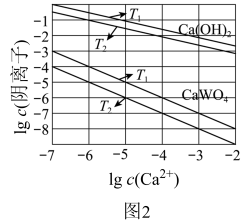
①T1___ T2(填“>”或“<”)T1时Ksp(CaWO4)=___
②将钨酸钠溶液加入石灰乳得到大量钨酸钙,发生反应的离子方程式为___ 。

已知:
①滤渣I的主要成份是Fe2O3、MnO2
②上述流程中,钨的化合价只有在最后一步发生改变。
③常温下钨酸难溶于水。
(1)钨酸盐(FeWO4、MnWO4)中钨元素的化合价为
(2)上述流程中向粗钨酸钠溶液中加硫酸中和至pH=10后,溶液中的杂质阴离子确SiO32-、HAsO32-、HAsO42-等,则“净化”过程中,加入H2O2时发生反应的离子方程式为
(3)已知氢氧化钙和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。图2为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线,则:

①T1
②将钨酸钠溶液加入石灰乳得到大量钨酸钙,发生反应的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐2】印刷电路板(简称PCB)是电子产品的重要组成部分,在PCB的加工过程中,常采用碱性蚀刻法,蚀刻后的废液中存在大量的[Cu(NH3)4]C12,如果直接排放不仅造成资源浪费,而且污染环境。下图是碱性蚀刻制PCB,并利用蚀刻废液制碱式碳酸铜(Cu2(OH)2CO3)的工艺流程。
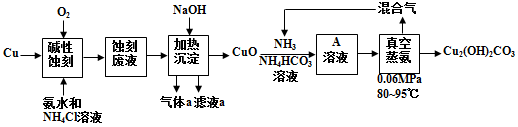
(1)碱性蚀刻时发生反应的化学方程式为_____________________________________ 。
(2)滤液a的溶质主要是__________ 。(化学式)
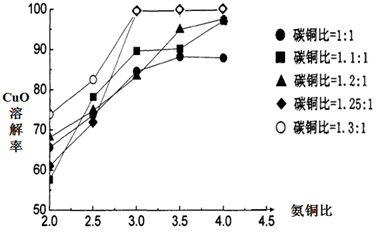
(3)不同的氨铜比和碳铜比条件下溶解CuO得A溶液,实验结果如下图。该反应的最佳实验条件为_______________________________ 。(氨铜比指n(NH3)∶n(CuO),碳铜比指n(NH4HCO3)∶n(CuO) )
(4)A溶液主要含[Cu(NH3)n]2+,对溶液中析出的无水碳酸盐进行分析后,测得元素质量分数为N:17.5%,Cu:39.7%,则此蓝色晶体的化学式是____________ 。
(5)写出真空蒸氨反应的化学方程式__________________________________________ 。
(6)蒸氨时,如果选择在常压80℃条件下进行,即使反应24小时,也仅有少量氨蒸出,且不Cu2(OH)2CO3沉淀析出。原因为______________________________________ 。
(7)除流程中标出的循环使用的物质外,还可循环使用的物质有__________ 。
(8)已知某次实验从0.4L 含Cu元素140g/L的蚀刻废液获得碱式碳酸铜82.5g,则Cu元素回收率为_____________ (结果保留至1%)。

(1)碱性蚀刻时发生反应的化学方程式为
(2)滤液a的溶质主要是
(3)不同的氨铜比和碳铜比条件下溶解CuO得A溶液,实验结果如下图。该反应的最佳实验条件为

(4)A溶液主要含[Cu(NH3)n]2+,对溶液中析出的无水碳酸盐进行分析后,测得元素质量分数为N:17.5%,Cu:39.7%,则此蓝色晶体的化学式是
(5)写出真空蒸氨反应的化学方程式
(6)蒸氨时,如果选择在常压80℃条件下进行,即使反应24小时,也仅有少量氨蒸出,且不Cu2(OH)2CO3沉淀析出。原因为
(7)除流程中标出的循环使用的物质外,还可循环使用的物质有
(8)已知某次实验从0.4L 含Cu元素140g/L的蚀刻废液获得碱式碳酸铜82.5g,则Cu元素回收率为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】镁及其化合物在现代工业中有着广泛的用途。
(1)组成为Mg17Al12的镁铝合金是一种潜在的贮氢材料,当其贮氢最达到最大值时组成变为“17MgH2+12Al”,则Mg、Al、Mg17Al12三种物质按熔点由高到低的顺序排列为_______ , 1mol“17MgH2+12Al”与足量NaOH溶液反应时生成的气体的质量是___________ g。
(2)镁可与SiO2发生多种反应,且条件不同时得到的产物也不同。当二者在高温条件下发生置换反应时.还原产物是_________ ,若镁过量,则产物为两种镁的二元化合物,写出反应的化学方程式:______ 。
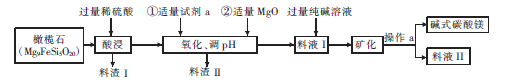
(3)碱式碳酸镁[MgCO3·3H2O]是重要的化工原料,下图表示的是制备它的一种工艺流程。
① Mg9FeSi5O20中铁元素的化合价为____ ,pH的调节范围是______ .
② 试剂a是一种常用的绿色氧化剂,加入a后反应的离子方程式为__________ 。
③ 写出料渣Ⅱ的一种用途:______ 。一般认为c(Mg2+)≤1×10-5mol/L时,Mg2+已完全沉淀,则Mg(OH)2的Ksp=______ 。写出生成碱式碳酸镁的离子方程式:____________ 。
(1)组成为Mg17Al12的镁铝合金是一种潜在的贮氢材料,当其贮氢最达到最大值时组成变为“17MgH2+12Al”,则Mg、Al、Mg17Al12三种物质按熔点由高到低的顺序排列为
(2)镁可与SiO2发生多种反应,且条件不同时得到的产物也不同。当二者在高温条件下发生置换反应时.还原产物是
(3)碱式碳酸镁[MgCO3·3H2O]是重要的化工原料,下图表示的是制备它的一种工艺流程。
| 开始沉淀时的PH | 完全沉淀时的pH | |
| Fe(OH)3 | 2.7 | 3.7 |
| Mg(OH)2 | 9.7 | 11 |
② 试剂a是一种常用的绿色氧化剂,加入a后反应的离子方程式为
③ 写出料渣Ⅱ的一种用途:
您最近一年使用:0次



