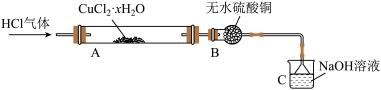
纳米氧化亚铜(Cu2O,颗粒直径1~100 nm)具有特殊的光学、光电和催化性能,已成为当前材料科学研究的热点之一、以CuSO4溶液和聚乙烯吡咯烷酮(PVP)为原料,采用化学沉淀法制备晶型结构完整、粒度分布均匀的纳米Cu2O路线如下:
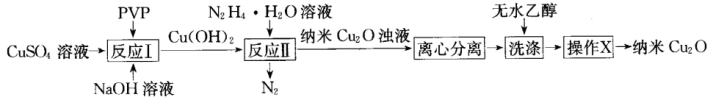
已知:Cu2O在潮湿的空气中会慢慢氧化生成CuO。
回答下列问题:
(1)“反应I”的基本反应类型为____________ 。
(2)Cu(OH)2完全反应后,验证反应II后的分散系中的分散质为纳米Cu2O浊液的方法是____________ 。
(3)“反应II”化学方程式为____________ ;每生成22.4 L(标准状况下)N2,转移____________ mol电子。
(4)“洗涤”时,用无水乙醇而不用水的原因是____________ 。
(5)“操作X”为____________ 。
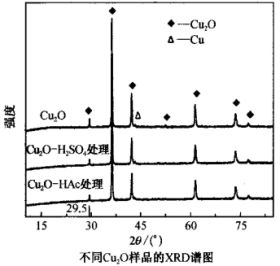
(6)获得材料的成分、材料内部原子或分子的结构或形态等信息可利用X射线衍射(XRD)法,如图为不同Cu2O样品的XRD谱图,由图可知各样品都是由Cu2O及极微量的铜组成,极微量铜产生的原因是____________ (语言叙述);通过对比各样品XRD曲线发现硫酸和醋酸(HAc)处理后,产物在2θ角为29.5°处衍射峰明显变弱,其原因是____________ (用离子方程式表示)。
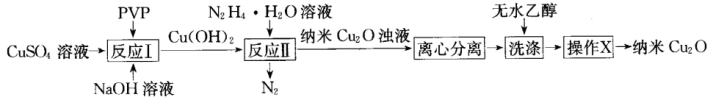
已知:Cu2O在潮湿的空气中会慢慢氧化生成CuO。
回答下列问题:
(1)“反应I”的基本反应类型为
(2)Cu(OH)2完全反应后,验证反应II后的分散系中的分散质为纳米Cu2O浊液的方法是
(3)“反应II”化学方程式为
(4)“洗涤”时,用无水乙醇而不用水的原因是
(5)“操作X”为
(6)获得材料的成分、材料内部原子或分子的结构或形态等信息可利用X射线衍射(XRD)法,如图为不同Cu2O样品的XRD谱图,由图可知各样品都是由Cu2O及极微量的铜组成,极微量铜产生的原因是

更新时间:2021-02-12 17:12:16
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】某地区利用其自然资源建立的工业体系如下图所示。
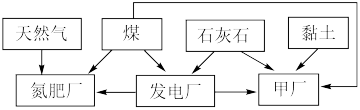
回答下列问题:
(1)“甲厂”为提高反应速率和原料的利用率,应先将石灰石进行___________ 处理。依据所使用的资源分析,“甲厂”的产品是___________ 。
(2)天然气中含有少量有害气体 ,常用NaOH溶液进行洗涤除去,反应的离子方程式为
,常用NaOH溶液进行洗涤除去,反应的离子方程式为___________ 。若改为使用三乙醇胺[N(CH2CH2OH)3]溶液洗涤,则每年节约资金可达百万元。已知在常温下三乙醇胺为液体,沸点为380℃,与 的反应为
的反应为 。解释能节约资金的原因
。解释能节约资金的原因___________ 。
(3)煤中含有一定量 。为减少大气污染,在煤燃烧发电时需加入石灰石脱硫,简称“钙基固硫”,“钙基固硫”最终得到的含硫物质的化学式为
。为减少大气污染,在煤燃烧发电时需加入石灰石脱硫,简称“钙基固硫”,“钙基固硫”最终得到的含硫物质的化学式为___________ 。后来改为在煤燃烧前,用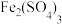 溶液溶解煤中的
溶液溶解煤中的 进行脱硫,写出反应化学方程式
进行脱硫,写出反应化学方程式___________ 。
(4)氮肥厂产生的“氨氮”废水中含有铵盐,直接排放会产生水体污染。传统的处理方法有多种。近年,电化学处理“氨氮”废水成为了研究热点,其中的一种原理如下图所示。
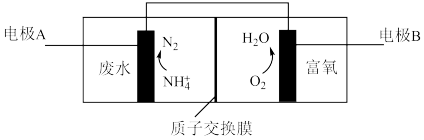
①检验废水中含有 的操作是
的操作是___________ 。
②电极B是___________ 极。
③写出电极A上发生的电极反应式___________ 。

回答下列问题:
(1)“甲厂”为提高反应速率和原料的利用率,应先将石灰石进行
(2)天然气中含有少量有害气体
 ,常用NaOH溶液进行洗涤除去,反应的离子方程式为
,常用NaOH溶液进行洗涤除去,反应的离子方程式为 的反应为
的反应为 。解释能节约资金的原因
。解释能节约资金的原因(3)煤中含有一定量
 。为减少大气污染,在煤燃烧发电时需加入石灰石脱硫,简称“钙基固硫”,“钙基固硫”最终得到的含硫物质的化学式为
。为减少大气污染,在煤燃烧发电时需加入石灰石脱硫,简称“钙基固硫”,“钙基固硫”最终得到的含硫物质的化学式为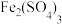 溶液溶解煤中的
溶液溶解煤中的 进行脱硫,写出反应化学方程式
进行脱硫,写出反应化学方程式(4)氮肥厂产生的“氨氮”废水中含有铵盐,直接排放会产生水体污染。传统的处理方法有多种。近年,电化学处理“氨氮”废水成为了研究热点,其中的一种原理如下图所示。

①检验废水中含有
 的操作是
的操作是②电极B是
③写出电极A上发生的电极反应式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】铁元素是重要的金属元素,铁及其化合物在日常生产生活中应用广泛,研究铁及其化合物的应用意义重大。
(1)所含铁元素具有氧化性也有还原性的物质是_________ 。
a.铁单质 b.氯化亚铁 c.铁红 d.Fe3O4
(2)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、C1O-、OH-、FeO42-、Cl-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式:____ Fe(OH)3+___ ClO-+_______ =____ FeO42-+____ Cl-+______
(3)电子工业上用氯化铁腐蚀铜箔,制造印刷电路板,并从使用过的腐蚀废液(含有FeCl2、CuCl2、FeCl3)中回收铜,并获得氯化铁晶体,其工艺流程如下:回答下列问题:
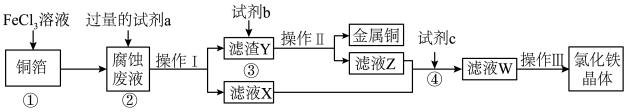
①反应①的化学方程式:_______________ ;
②从反应①和②可以判断出Fe2+、Cu2+、Fe3+的氧化性从强到弱顺序为:____________ ;
③操作I用到的玻璃仪器有烧杯、玻璃棒和___________ ;
④滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为:___________________ 。
(1)所含铁元素具有氧化性也有还原性的物质是
a.铁单质 b.氯化亚铁 c.铁红 d.Fe3O4
(2)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、C1O-、OH-、FeO42-、Cl-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式:
(3)电子工业上用氯化铁腐蚀铜箔,制造印刷电路板,并从使用过的腐蚀废液(含有FeCl2、CuCl2、FeCl3)中回收铜,并获得氯化铁晶体,其工艺流程如下:回答下列问题:

①反应①的化学方程式:
②从反应①和②可以判断出Fe2+、Cu2+、Fe3+的氧化性从强到弱顺序为:
③操作I用到的玻璃仪器有烧杯、玻璃棒和
④滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】亚氯酸钠(NaClO2)是一种重要的杀菌消毒剂,也常用来漂白织物,可通过下列流程得到NaClO2•3H2O:

已知:NaClO2饱和溶液在低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出晶体是NaClO2。
(1)“合成”中发生:2NaClO3+SO2+H2SO4=2NaHSO4+2ClO2↑,在该反应中氧化剂是____ 。若生成2 mol ClO2时,电子转移的数目是____ 。
(2)“转化”过程中,H2O2的作用是____ (填“氧化剂”或“还原剂”)。将得到的NaClO2溶液进行蒸发浓缩,____ ,过滤洗涤,得到NaClO2•3H2O。
(3)为确定样品的纯度,某课外兴趣活动小组进行如下实验:
步骤一:取10.00 g NaClO2样品,用适量蒸馏水溶解后,加入略过量的KI溶液,充分反应。
步骤二:将反应液定容至200 mL,取出20.00 mL于锥形瓶。向锥形瓶中滴加两滴淀粉溶液,用2.00 mol·L-1 Na2S2O3溶液与之反应。
步骤三:重复以上操作2~3次,测得平均消耗Na2S2O3溶液22.00 mL。(所需的关系式:NaClO2 ~ 4I- ~ 2I2 ~ 4Na2S2O3)该NaClO2样品的纯度是____ (写出计算过程)。

已知:NaClO2饱和溶液在低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出晶体是NaClO2。
(1)“合成”中发生:2NaClO3+SO2+H2SO4=2NaHSO4+2ClO2↑,在该反应中氧化剂是
(2)“转化”过程中,H2O2的作用是
(3)为确定样品的纯度,某课外兴趣活动小组进行如下实验:
步骤一:取10.00 g NaClO2样品,用适量蒸馏水溶解后,加入略过量的KI溶液,充分反应。
步骤二:将反应液定容至200 mL,取出20.00 mL于锥形瓶。向锥形瓶中滴加两滴淀粉溶液,用2.00 mol·L-1 Na2S2O3溶液与之反应。
步骤三:重复以上操作2~3次,测得平均消耗Na2S2O3溶液22.00 mL。(所需的关系式:NaClO2 ~ 4I- ~ 2I2 ~ 4Na2S2O3)该NaClO2样品的纯度是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】为了降低电子垃圾对环境构成的影响,将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
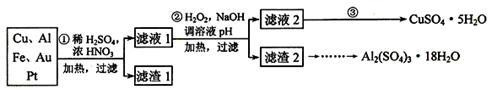
(1)第①步Cu与混酸反应的离子方程式为________________ 。得到滤渣1的主要成分为___________ 。
(2)第②步中加入H2O2的作用是__________________ ,使用H2O2的优点是_________ ;调溶液pH的目的是_________________ 。
(3)简述第③步由滤液2得到CuSO4·5H2O的方法是_________________________ 。
(4)由滤渣2制取Al2(SO4)3·18H2O ,设计了以下三种方案:
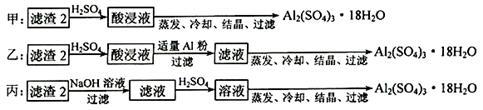
上述三种方案中,_______ 方案不可行,原因是________________ ;
从原子利用率角度考虑,_______ 方案更合理。
(5)用滴定法测定CuSO4·5H2O含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol·L-1EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2++ H2Y2-→ CuY2-+ 2H+。写出计算CuSO4·5H2O质量分数的表达式ω=__________________ 。

(1)第①步Cu与混酸反应的离子方程式为
(2)第②步中加入H2O2的作用是
(3)简述第③步由滤液2得到CuSO4·5H2O的方法是
(4)由滤渣2制取Al2(SO4)3·18H2O ,设计了以下三种方案:

上述三种方案中,
从原子利用率角度考虑,
(5)用滴定法测定CuSO4·5H2O含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol·L-1EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2++ H2Y2-→ CuY2-+ 2H+。写出计算CuSO4·5H2O质量分数的表达式ω=
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】回答下列问题
(1)下图为铁及其化合物的“价-类”二维图。
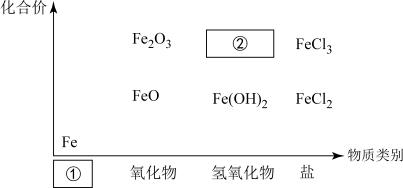
填写二维图缺失的类别 ①___________ 和化学式②___________ 。
(2)某同学利用以下试剂研究FeCl3性质,进行了如下预测:
①Cl2 ②Fe ③NaOH ④H2SO4 ⑤AgNO3
从物质类别 上看,FeCl3属于___________ ,可能与___________ 发生反应(填序号);从化合价角度看,Fe3+具有___________ 性,可能与___________ 发生反应(填序号)。
(3)宋代《千里江山图》描绘了山清水秀的美丽景色,来自孔雀石颜料(主要成分为Cu(OH)2·CuCO3),
经千年色彩依然,其中绿色来自蓝铜矿(主要成分为Cu(OH)2·2CuCO3)。其中Cu(OH)2·2CuCO3属于___________ (填“纯净物”或“混合物”),请写出Cu(OH)2·2CuCO3与盐酸反应的化学方程式 ___________
(4)酸式盐是盐的一种,可看作是多元酸中的氢离子未被完全中和所得到的盐,常见的有NaHCO3、NaHSO4、KH2PO4、K2HPO4等。已知H3PO2(次磷酸)与足量的NaOH反应只生成一种盐NaH2PO2,H3PO2水溶液中存在H3PO2分子。
①H3PO2属于___________ 酸;NaH2PO2为___________ 盐(填序号)
a. 一元酸 b.二元酸 c.三元酸 d.强酸 e.弱酸 f.正盐 g.酸式盐
②写出H3PO2溶液与足量NaOH溶液反应的化学方程式___________ 。
(1)下图为铁及其化合物的“价-类”二维图。

填写二维图缺失的
(2)某同学利用以下试剂研究FeCl3性质,进行了如下预测:
①Cl2 ②Fe ③NaOH ④H2SO4 ⑤AgNO3
从物质
(3)宋代《千里江山图》描绘了山清水秀的美丽景色,来自孔雀石颜料(主要成分为Cu(OH)2·CuCO3),
经千年色彩依然,其中绿色来自蓝铜矿(主要成分为Cu(OH)2·2CuCO3)。其中Cu(OH)2·2CuCO3属于
(4)酸式盐是盐的一种,可看作是多元酸中的氢离子未被完全中和所得到的盐,常见的有NaHCO3、NaHSO4、KH2PO4、K2HPO4等。已知H3PO2(次磷酸)与足量的NaOH反应只生成一种盐NaH2PO2,H3PO2水溶液中存在H3PO2分子。
①H3PO2属于
a. 一元酸 b.二元酸 c.三元酸 d.强酸 e.弱酸 f.正盐 g.酸式盐
②写出H3PO2溶液与足量NaOH溶液反应的化学方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】某工厂排放的工业废水中含有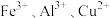 ,为了减少环境污染,变废为宝,该工厂利用废铁屑和其他化学试剂进行如下操作,得到了铁红、
,为了减少环境污染,变废为宝,该工厂利用废铁屑和其他化学试剂进行如下操作,得到了铁红、 和金属Cu,试回答下列问题:
和金属Cu,试回答下列问题:
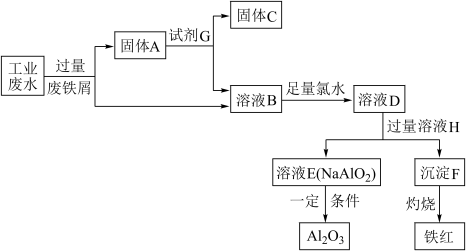
(1)固体A的成分为___________ (填化学式,下同)。
(2)反应B—D的离子方程式是___________ ,该反应中氧化剂是___________ ,2mol  参加反应时转移电子
参加反应时转移电子___________ mol。
(3)溶液E的焰色反应呈黄色,则H是___________ 溶液;反应D→E的离子方程式是___________ 。
 ,为了减少环境污染,变废为宝,该工厂利用废铁屑和其他化学试剂进行如下操作,得到了铁红、
,为了减少环境污染,变废为宝,该工厂利用废铁屑和其他化学试剂进行如下操作,得到了铁红、 和金属Cu,试回答下列问题:
和金属Cu,试回答下列问题:
(1)固体A的成分为
(2)反应B—D的离子方程式是
 参加反应时转移电子
参加反应时转移电子(3)溶液E的焰色反应呈黄色,则H是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】已知碳酸氢钠的溶解度较小。在饱和氯化钠溶液中通入二氧化碳和氨气,可析出碳酸氢钠固体。某学习小组制备少量 的流程如下:
的流程如下:
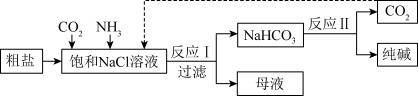
(1)粗盐中含有大量的NaCl,以及少量的 、
、 、
、 等离子。为得到纯净的饱和NaCl溶液,对粗盐溶液进行了如下操作。下列操作步骤排序不合理的是___________(填正确答案标号)
等离子。为得到纯净的饱和NaCl溶液,对粗盐溶液进行了如下操作。下列操作步骤排序不合理的是___________(填正确答案标号)
a.加入过量的氢氧化钠溶液;
b.加入过量的碳酸钠溶液;
c.加入过量的氯化钡溶液;
d.加入足量的稀盐酸;
e.过滤;
f.加热煮沸一段时间,得到饱和NaCl溶液。
(2)向“饱和NaCl溶液”通入 和
和 的顺序是先通入
的顺序是先通入___________ ,后通入___________ 。
(3)过滤用到的玻璃仪器除烧杯和玻璃棒外,还需要___________ 。
(4)反应Ⅰ的化学方程式为___________ 。
(5)纯碱和小苏打都是白色固体,下列区分这两种物质的方法正确的是___________。(填正确答案标号)
(6)“过滤”后的母液中最主要的成分是___________ (填写化学式)。检验这一成分中的阳离子的具体方法是___________ 。
 的流程如下:
的流程如下:
(1)粗盐中含有大量的NaCl,以及少量的
 、
、 、
、 等离子。为得到纯净的饱和NaCl溶液,对粗盐溶液进行了如下操作。下列操作步骤排序不合理的是___________(填正确答案标号)
等离子。为得到纯净的饱和NaCl溶液,对粗盐溶液进行了如下操作。下列操作步骤排序不合理的是___________(填正确答案标号)a.加入过量的氢氧化钠溶液;
b.加入过量的碳酸钠溶液;
c.加入过量的氯化钡溶液;
d.加入足量的稀盐酸;
e.过滤;
f.加热煮沸一段时间,得到饱和NaCl溶液。
| A.acbedf | B.cabedf | C.acbdef | D.cbaedf |
 和
和 的顺序是先通入
的顺序是先通入(3)过滤用到的玻璃仪器除烧杯和玻璃棒外,还需要
(4)反应Ⅰ的化学方程式为
(5)纯碱和小苏打都是白色固体,下列区分这两种物质的方法正确的是___________。(填正确答案标号)
| A.分别用炒锅加热两种样品,全部分解挥发,没有残留物的是小苏打 |
| B.用洁净铁丝蘸取两种样品在煤气火焰上灼烧,使火焰颜色发生明显变化的是小苏打 |
| C.用两只小玻璃杯,分别加入等量的两种样品,再逐滴加入食醋,产生气泡快的是小苏打 |
| D.先将两种样品配成溶液,分别加入足量石灰水,无白色沉淀生成的是小苏打 |
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】柠檬酸亚铁(FeC6H6O7)是一种易被人体吸收的高效铁制剂,医疗上可以用来治疗缺铁性贫血。某课题组以硫铁矿烧渣(含Fe2O3、SiO2、少量Al2O3等)为原料,先制备碳酸亚铁,再与柠檬酸反应可以制得柠檬酸亚铁。其工艺流程如下:

已知:相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算):
(1)基态Fe2+的核外电子排布式为_______ 。
(2)“浸泡”时加入过量硫酸的目的:_______ 。
(3)“除杂”时有同学提出下列两种途径,请选择较合理的途径并说明理由_______ 。
途径一:
途径二:
(4)“制备FeCO3”时,Na2CO3溶液的浓度对沉淀中铁元素的质量分数以及FeCO3产率的影响如图:
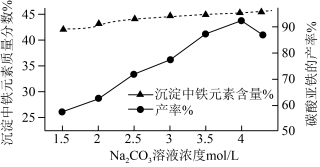
Na2CO3溶液的浓度大于4mol/L时,FeCO3的产率有所下降,而沉淀中铁元素质量分数仍在上升的原因是_______ 。
(5)已知柠檬酸亚铁易被氧化,能溶于水,不溶于乙醇。设计试验方案,从“除杂”后的FeSO4溶液制备柠檬酸亚铁晶体:_______ ,静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。(必须用到的试剂有:Fe粉、4mol/LNa2CO3溶液、柠檬酸溶液、无水乙醇)
(6)产品纯度的测定。产品中铁的含量用 EDTA 配位滴定法测定:称取0.4000g产品中加入足量H2O2溶液和适量的稀H2SO4,充分反应后再用0.0600mol·L-1EDTA溶液滴定至终点(其他离子对滴定过程无干扰),消耗EDTA溶液的体积为20.00mL(已知:EDTA与Fe3+的滴定比例为1:1,柠檬酸亚铁的摩尔质量为246g/mol)。计算产品的纯度为_______ 。
(7)上述滴定过程中,导致测定结果偏大的是_______ 。
a.滴定前,盛装EDTA的酸式滴定管未润洗
b.滴定时,酸式滴定管中开始有气泡,后来无气泡
c.滴定开始时平视,滴定结束时俯视

已知:相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算):
金属离子 | 沉淀开始pH | 沉淀完全pH |
Al3+ | 3.1 | 5.1 |
Fe2+ | 5.9 | 6.9 |
Fe3+ | 1.2 | 3.2 |
(1)基态Fe2+的核外电子排布式为
(2)“浸泡”时加入过量硫酸的目的:
(3)“除杂”时有同学提出下列两种途径,请选择较合理的途径并说明理由
途径一:

途径二:

(4)“制备FeCO3”时,Na2CO3溶液的浓度对沉淀中铁元素的质量分数以及FeCO3产率的影响如图:

Na2CO3溶液的浓度大于4mol/L时,FeCO3的产率有所下降,而沉淀中铁元素质量分数仍在上升的原因是
(5)已知柠檬酸亚铁易被氧化,能溶于水,不溶于乙醇。设计试验方案,从“除杂”后的FeSO4溶液制备柠檬酸亚铁晶体:
(6)产品纯度的测定。产品中铁的含量用 EDTA 配位滴定法测定:称取0.4000g产品中加入足量H2O2溶液和适量的稀H2SO4,充分反应后再用0.0600mol·L-1EDTA溶液滴定至终点(其他离子对滴定过程无干扰),消耗EDTA溶液的体积为20.00mL(已知:EDTA与Fe3+的滴定比例为1:1,柠檬酸亚铁的摩尔质量为246g/mol)。计算产品的纯度为
(7)上述滴定过程中,导致测定结果偏大的是
a.滴定前,盛装EDTA的酸式滴定管未润洗
b.滴定时,酸式滴定管中开始有气泡,后来无气泡
c.滴定开始时平视,滴定结束时俯视
您最近一年使用:0次