硫是一种重要的非金属元素,化工生产中通过控制化学反应条件而实现含硫物质的相互转化。回答下列问题:
Ⅰ.电化学溶解-沉淀法是一种回收利用H2S的新方法,其工艺原理如图所示:

已知:Zn与强酸、强碱都能反应生成H2;Zn2+在过量的强碱溶液中以[Zn(OH)4]2-形式存在。
(1)锌棒连接直流电源的_______ 极,电极反应方程式为_______ 。
(2)反应器中反应的离子方程式为_______ 。
Ⅱ.生成的ZnS可制立德粉ZnS·BaSO4(也称锌钡白),是一种常用白色颜料。成品中S2−的含量可以用“碘量法”测得。称取m g样品,置于碘量瓶中,移取20.00 mL 0.1000 mol·L-1的I2-KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5 min,有单质硫析出。以淀粉溶液为指示剂,过量的I2用0.1050 mol·L-1 Na2S2O3溶液滴定,反应式为I2+2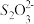 =2I−+
=2I−+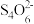 。测定时消耗Na2S2O3溶液体积V mL。
。测定时消耗Na2S2O3溶液体积V mL。
(3)Na2S2O3可利用向Na2S和Na2SO3混合溶液中通入SO2的方法制备,该方法的离子反应方程式为_______ 。
(4)上述制备的反应溶液应保持碱性环境,请用简要的文字并结合离子方程式解释其原因_______ 。
(5)Na2S2O3溶液不稳定,使用前需用K2Cr2O7、KIO3等基准物质进行标定,标定过程利用Na2S2O3具有_______ 性。
(6)该样品中S2-的百分含量为_______ (写出表达式)。若Na2S2O3溶液标定后,放置过久使用,则测定结果_______ (填“偏高”、“偏低”或“无影响”)。
III.利用沉淀间的转化,可使BaSO4中的 进入溶液中,现将0.28 mol BaSO4沉淀,每次用1L1.50mol·L-1 Na2CO3溶液处理,若使BaSO4中的
进入溶液中,现将0.28 mol BaSO4沉淀,每次用1L1.50mol·L-1 Na2CO3溶液处理,若使BaSO4中的 全部进入溶液中,需反复洗
全部进入溶液中,需反复洗_______ 次(已知Ksp(BaSO4)=1.07×10-10、Ksp(BaCO3)=2.58×10-9)。
Ⅰ.电化学溶解-沉淀法是一种回收利用H2S的新方法,其工艺原理如图所示:

已知:Zn与强酸、强碱都能反应生成H2;Zn2+在过量的强碱溶液中以[Zn(OH)4]2-形式存在。
(1)锌棒连接直流电源的
(2)反应器中反应的离子方程式为
Ⅱ.生成的ZnS可制立德粉ZnS·BaSO4(也称锌钡白),是一种常用白色颜料。成品中S2−的含量可以用“碘量法”测得。称取m g样品,置于碘量瓶中,移取20.00 mL 0.1000 mol·L-1的I2-KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5 min,有单质硫析出。以淀粉溶液为指示剂,过量的I2用0.1050 mol·L-1 Na2S2O3溶液滴定,反应式为I2+2
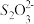 =2I−+
=2I−+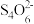 。测定时消耗Na2S2O3溶液体积V mL。
。测定时消耗Na2S2O3溶液体积V mL。(3)Na2S2O3可利用向Na2S和Na2SO3混合溶液中通入SO2的方法制备,该方法的离子反应方程式为
(4)上述制备的反应溶液应保持碱性环境,请用简要的文字并结合离子方程式解释其原因
(5)Na2S2O3溶液不稳定,使用前需用K2Cr2O7、KIO3等基准物质进行标定,标定过程利用Na2S2O3具有
(6)该样品中S2-的百分含量为
III.利用沉淀间的转化,可使BaSO4中的
 进入溶液中,现将0.28 mol BaSO4沉淀,每次用1L1.50mol·L-1 Na2CO3溶液处理,若使BaSO4中的
进入溶液中,现将0.28 mol BaSO4沉淀,每次用1L1.50mol·L-1 Na2CO3溶液处理,若使BaSO4中的 全部进入溶液中,需反复洗
全部进入溶液中,需反复洗
更新时间:2021-03-08 15:50:08
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】NH3、N2H4在工业生产和国防建设中都有广泛应用。回答下列问题:
(1)①N2H4 (g) N2(g)+2H2(g) △H1
N2(g)+2H2(g) △H1
②N2(g)+3H2(g) 2NH3(g) △H2
2NH3(g) △H2
③7N2H4(g) 8NH3(g)+3N2(g)+2H2(g) △H3
8NH3(g)+3N2(g)+2H2(g) △H3
△H3=___________ (用含△H1和△H2的代数式表示)。
(2)纳米钴的催化作用下,N2H4可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。当反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示。
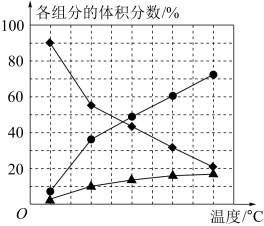
该反应的△H________ (填“>”或“<”)0,N2H4发生分解反应的化学方程式为___________ 。
(3)T℃时,向一体积为5L 的恒容密闭容器中充入总物质的量为2 mol的CO2和NH3,在一定条件下发生反应:2NH3(g)+CO2(g)====CO(NH2)2(s)+H2O(g)。混合气体中氨气的体积分数随反应时间的变化如图所示。
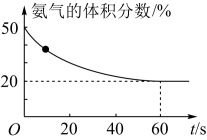
① 0~60s内,反应速率v(CO2)=________ mol/(L·s)
② T℃时,该反应的化学平衡常数K=________ 。
(1)①N2H4 (g)
 N2(g)+2H2(g) △H1
N2(g)+2H2(g) △H1②N2(g)+3H2(g)
 2NH3(g) △H2
2NH3(g) △H2③7N2H4(g)
 8NH3(g)+3N2(g)+2H2(g) △H3
8NH3(g)+3N2(g)+2H2(g) △H3△H3=
(2)纳米钴的催化作用下,N2H4可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。当反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示。

该反应的△H
(3)T℃时,向一体积为5L 的恒容密闭容器中充入总物质的量为2 mol的CO2和NH3,在一定条件下发生反应:2NH3(g)+CO2(g)====CO(NH2)2(s)+H2O(g)。混合气体中氨气的体积分数随反应时间的变化如图所示。

① 0~60s内,反应速率v(CO2)=
② T℃时,该反应的化学平衡常数K=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】化学环分解氯化铵的纯碱和氯乙烯集成清洁工艺如下:

(1)“释氨反应”步骤可能发生的化学反应:
NH4Cl(s)≒ NH3(g)+HCl(g) ΔH=163.57 kJ/mol
MgO(s)+ HCl(g) ≒ MgOHCl(s) ΔH=-102.23 kJ/mol
则总反应NH4Cl(s)+MgO(s)≒NH3(g)+MgOHCl(s) ΔH=____ kJ/mol
(2)“释氯反应”可能的化学反应有:
i. MgOHCl(s)≒MgO(s)+ HCl(g) ΔH=+97.50 kJ/mol
ii. MgOHCl(s)+ HCl(g)≒MgCl2(s)+H2O(g) ΔH=+2.89 kJ/mol
iii. MgCl2(s)+ H2O(g)=MgO(s)+2HCl(g) ΔH=+94.61 kJ/mol
图为“释氯反应”在不同温度下各组分的平衡组成,回答下列问题
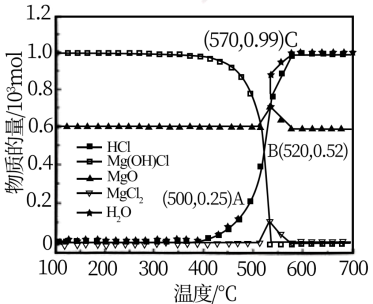
①应选择的最佳反应温度是___________
②500°C时,释氯反应器的压强为P,计算该温度下反应i的平衡常数Kp=___________ (Kp为以分压表示的平衡常数)
③结合平衡移动原理,原料气增加水蒸气的目的是___________
(3)“氯乙烯反应”中, (g)+HCl(g)
(g)+HCl(g)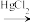 CH2=CHCl(g)的反应机理如图,其中吸附在催化剂表面的物种用*标注
CH2=CHCl(g)的反应机理如图,其中吸附在催化剂表面的物种用*标注
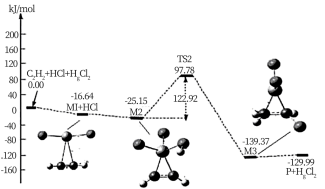
①碳碳叁键的键能:M1_____  (填“>”或“<”)
(填“>”或“<”)
②“M2→M3”的化学方程式为__________
③该反应的决速步骤为__________
(4)下列有关该工艺的说法不正确的是______ (填标号)
A.可循环利用的物质有NH3、MgO、HCl
B.“石灰窑”和“纯碱反应”的副产物可实现资源化利用
C.利用MgO作为吸附剂可有效实现NH3与HCl分离
D.减少了从氯碱工业的产品获取HCl的电能消耗

(1)“释氨反应”步骤可能发生的化学反应:
NH4Cl(s)≒ NH3(g)+HCl(g) ΔH=163.57 kJ/mol
MgO(s)+ HCl(g) ≒ MgOHCl(s) ΔH=-102.23 kJ/mol
则总反应NH4Cl(s)+MgO(s)≒NH3(g)+MgOHCl(s) ΔH=
(2)“释氯反应”可能的化学反应有:
i. MgOHCl(s)≒MgO(s)+ HCl(g) ΔH=+97.50 kJ/mol
ii. MgOHCl(s)+ HCl(g)≒MgCl2(s)+H2O(g) ΔH=+2.89 kJ/mol
iii. MgCl2(s)+ H2O(g)=MgO(s)+2HCl(g) ΔH=+94.61 kJ/mol
图为“释氯反应”在不同温度下各组分的平衡组成,回答下列问题

①应选择的最佳反应温度是
②500°C时,释氯反应器的压强为P,计算该温度下反应i的平衡常数Kp=
③结合平衡移动原理,原料气增加水蒸气的目的是
(3)“氯乙烯反应”中,
 (g)+HCl(g)
(g)+HCl(g) CH2=CHCl(g)的反应机理如图,其中吸附在催化剂表面的物种用*标注
CH2=CHCl(g)的反应机理如图,其中吸附在催化剂表面的物种用*标注
①碳碳叁键的键能:M1
 (填“>”或“<”)
(填“>”或“<”)②“M2→M3”的化学方程式为
③该反应的决速步骤为
(4)下列有关该工艺的说法不正确的是
A.可循环利用的物质有NH3、MgO、HCl
B.“石灰窑”和“纯碱反应”的副产物可实现资源化利用
C.利用MgO作为吸附剂可有效实现NH3与HCl分离
D.减少了从氯碱工业的产品获取HCl的电能消耗
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】北京奥运会祥云火炬将中国传统文化、奥运精神以及现代高科技融为一体。火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料。试回答下列问题:
(1)①如图是一定量丙烷完全燃烧生成CO2和1molH2O(l)过程中的能量变化图,图中的括号内应该填入_______ 。(“+”或“−”)

②写出表示丙烷燃烧热的热化学方程式:_______ 。
③二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ热量。若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1645kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为_______ 。
(2)化学家正在研究尿素动力燃料电池。用这种电池直接去除城市废水中的尿素,既能产生净化的水,又能发电,尿素燃料电池结构如图所示。回答下列问题:

电池中的负极为_______ (填“甲”或“乙”),甲的电极反应式为_______ ,电池工作时,理论上每净化1mol尿素,消耗O2的体积(标准状况下)约为_______ L。
(3)CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式为:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
①甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2=2CO+2H2,1gCH4(g)完全反应可释放15.46kJ的热量,则下图(所有物质均为气态)能表示该反应过程中能量变化的是_______ (填字母)。


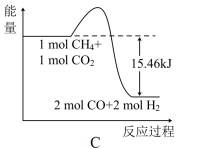
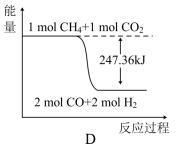
②C(s)与H2(g)不反应,所以C(s)+2H2(g)=CH4(g)的反应热无法直接测量,但通过上述反应可求出,C(s)+2H2(g)=CH4(g)的反应热ΔH=_______ 。
(1)①如图是一定量丙烷完全燃烧生成CO2和1molH2O(l)过程中的能量变化图,图中的括号内应该填入

②写出表示丙烷燃烧热的热化学方程式:
③二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ热量。若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1645kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为
(2)化学家正在研究尿素动力燃料电池。用这种电池直接去除城市废水中的尿素,既能产生净化的水,又能发电,尿素燃料电池结构如图所示。回答下列问题:

电池中的负极为
(3)CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式为:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
①甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2=2CO+2H2,1gCH4(g)完全反应可释放15.46kJ的热量,则下图(所有物质均为气态)能表示该反应过程中能量变化的是




②C(s)与H2(g)不反应,所以C(s)+2H2(g)=CH4(g)的反应热无法直接测量,但通过上述反应可求出,C(s)+2H2(g)=CH4(g)的反应热ΔH=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】去除泥沙后的粗盐溶液中含有 、
、 和
和 等杂质离子,获取精制食盐水的流程如下:
等杂质离子,获取精制食盐水的流程如下:

(1)过程I,加入NaOH的目的是为了除去 ,离子方程式为
,离子方程式为_______ 。
(2)过程Ⅱ,试剂a是_______ 。
(3)过程Ⅱ,如果不过滤,直接向浑浊液中加入过量 ,则最终获得的精制食盐水中含有一定量的
,则最终获得的精制食盐水中含有一定量的 ,结合化学用语解释原因
,结合化学用语解释原因_______ 。
(4)过程Ⅳ,调节pH所用的酸为_______ (填写化学式)。已知碳酸溶液中含碳微粒的物质的量分数随pH变化如下图所示,调节溶液
_______ (填“可行”或“不可行”),理由是_______ 。
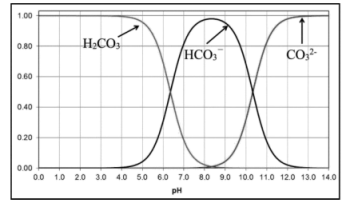
(5)判断杂质是否除尽是粗盐精制的关键环节,过程I中当 时,可认为
时,可认为 被除尽。(已知:
被除尽。(已知: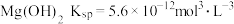 ).常温下当加入NaOH使溶液
).常温下当加入NaOH使溶液 时,
时,
_______  ,此时溶液中
,此时溶液中
_______ (填“已除尽”或“未除尽”)。
 、
、 和
和 等杂质离子,获取精制食盐水的流程如下:
等杂质离子,获取精制食盐水的流程如下:
(1)过程I,加入NaOH的目的是为了除去
 ,离子方程式为
,离子方程式为(2)过程Ⅱ,试剂a是
(3)过程Ⅱ,如果不过滤,直接向浑浊液中加入过量
 ,则最终获得的精制食盐水中含有一定量的
,则最终获得的精制食盐水中含有一定量的 ,结合化学用语解释原因
,结合化学用语解释原因(4)过程Ⅳ,调节pH所用的酸为


(5)判断杂质是否除尽是粗盐精制的关键环节,过程I中当
 时,可认为
时,可认为 被除尽。(已知:
被除尽。(已知: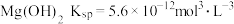 ).常温下当加入NaOH使溶液
).常温下当加入NaOH使溶液 时,
时,
 ,此时溶液中
,此时溶液中
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】砷(As)与氮(N)是同主族元素,它们的化合物在生活、生产和科学研究中有重要的作用。
(1)亚硝酸钠(NaNO2)的外观与食盐非常相似,但有毒。某小组欲鉴别NaCl与NaNO2,常温下,用pH试纸分别测定0.1 mol∙L−1两种盐溶液的pH,测得NaNO2溶液的pH=9,即NaNO2溶液呈碱性,其原因为___________ (用离子方程式表示)。常温下,HNO2电离常数Ka(HNO2)约为___________ 。
(2)查阅资料知:5 +2
+2 +6H+=5
+6H+=5 +3Mn2++3H2O;
+3Mn2++3H2O; +5Fe2++8H+=Mn2++5Fe3++4H2O。该小组设计如下方案测定NaNO2样品的纯度(含NaNO3杂质):取样品2.3 g经溶解后得到溶液A 100 mL,准确量取10.00 mL A与24.00 mL 0.0500 mol∙L−1的酸性高锰酸钾溶液在锥形瓶中充分反应。反应后的溶液用0.1000 mol∙L−1 (NH4)2Fe(SO4)2标准溶液滴定至紫色刚好褪去;重复上述实验3次,平均消耗(NH4)2Fe(SO4)2溶液10.00 mL,则样品中NaNO2的纯度为
+5Fe2++8H+=Mn2++5Fe3++4H2O。该小组设计如下方案测定NaNO2样品的纯度(含NaNO3杂质):取样品2.3 g经溶解后得到溶液A 100 mL,准确量取10.00 mL A与24.00 mL 0.0500 mol∙L−1的酸性高锰酸钾溶液在锥形瓶中充分反应。反应后的溶液用0.1000 mol∙L−1 (NH4)2Fe(SO4)2标准溶液滴定至紫色刚好褪去;重复上述实验3次,平均消耗(NH4)2Fe(SO4)2溶液10.00 mL,则样品中NaNO2的纯度为___________ 。通过上述实验测得样品中NaNO2的纯度偏高,该小组讨论的原因错误的是___________ (填字母编号)。
a.滴定至溶液紫色刚好褪去,立即停止滴定
b.加入A与KMnO4溶液前的锥形瓶未经干燥
c.实验中使用的(NH4)2Fe(SO4)2溶液暴露在空气中的时间过长
(3)已知常温下,Ksp(AgNO2)=2×10−8,Ksp(AgCl)=1.8×10−10.分别向同浓度的两种盐溶液中滴入向同浓度的AgNO3溶液,先出现的沉淀是___________ (填化学式)。欲用1L NaNO2溶液将0.01mol AgCl完全转化为AgNO2,则NaNO2溶液的浓度需要满足___________ 。
(4)25℃时,10mL 0.3 mol∙L−1 Na3AsO3溶液、10mL 0.3 mol∙L−1 I2溶液的的水溶液和10mL NaOH溶液混合,发生反应: (aq)+I2(aq)+2OH-(aq)
(aq)+I2(aq)+2OH-(aq) 
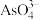 (aq)+2I-(aq)+H2O(l)。溶液中c(I-)与反应时间(t)的关系如图所示(溶液体积变化忽略不计):
(aq)+2I-(aq)+H2O(l)。溶液中c(I-)与反应时间(t)的关系如图所示(溶液体积变化忽略不计):
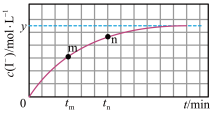
①m点时υ逆___________ n点时υ正(填“>”、“=”或“<”)。
②若平衡时溶液的pH=13,该反应的平衡常数K=___________ (用含y的代数式表示)。
(5)已知H3AsO4的电离常数分别为Ka1=6.3×10−2,Ka2=1.0×10−7,Ka3=3.2×10−12。
①25℃时,0.1 mol∙L−1的NaH2AsO4溶液中:c(H3AsO4)___________ c( )(填“>”、“=”或“<”)。
)(填“>”、“=”或“<”)。
②25℃时,向10mL 0.1 mol∙L−1的H3AsO4溶液中逐滴滴加1 mol∙L−1 NaOH溶液至中性,此时混合溶液中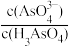 =
=___________ 。
(1)亚硝酸钠(NaNO2)的外观与食盐非常相似,但有毒。某小组欲鉴别NaCl与NaNO2,常温下,用pH试纸分别测定0.1 mol∙L−1两种盐溶液的pH,测得NaNO2溶液的pH=9,即NaNO2溶液呈碱性,其原因为
(2)查阅资料知:5
 +2
+2 +6H+=5
+6H+=5 +3Mn2++3H2O;
+3Mn2++3H2O; +5Fe2++8H+=Mn2++5Fe3++4H2O。该小组设计如下方案测定NaNO2样品的纯度(含NaNO3杂质):取样品2.3 g经溶解后得到溶液A 100 mL,准确量取10.00 mL A与24.00 mL 0.0500 mol∙L−1的酸性高锰酸钾溶液在锥形瓶中充分反应。反应后的溶液用0.1000 mol∙L−1 (NH4)2Fe(SO4)2标准溶液滴定至紫色刚好褪去;重复上述实验3次,平均消耗(NH4)2Fe(SO4)2溶液10.00 mL,则样品中NaNO2的纯度为
+5Fe2++8H+=Mn2++5Fe3++4H2O。该小组设计如下方案测定NaNO2样品的纯度(含NaNO3杂质):取样品2.3 g经溶解后得到溶液A 100 mL,准确量取10.00 mL A与24.00 mL 0.0500 mol∙L−1的酸性高锰酸钾溶液在锥形瓶中充分反应。反应后的溶液用0.1000 mol∙L−1 (NH4)2Fe(SO4)2标准溶液滴定至紫色刚好褪去;重复上述实验3次,平均消耗(NH4)2Fe(SO4)2溶液10.00 mL,则样品中NaNO2的纯度为a.滴定至溶液紫色刚好褪去,立即停止滴定
b.加入A与KMnO4溶液前的锥形瓶未经干燥
c.实验中使用的(NH4)2Fe(SO4)2溶液暴露在空气中的时间过长
(3)已知常温下,Ksp(AgNO2)=2×10−8,Ksp(AgCl)=1.8×10−10.分别向同浓度的两种盐溶液中滴入向同浓度的AgNO3溶液,先出现的沉淀是
(4)25℃时,10mL 0.3 mol∙L−1 Na3AsO3溶液、10mL 0.3 mol∙L−1 I2溶液的的水溶液和10mL NaOH溶液混合,发生反应:
 (aq)+I2(aq)+2OH-(aq)
(aq)+I2(aq)+2OH-(aq) 
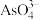 (aq)+2I-(aq)+H2O(l)。溶液中c(I-)与反应时间(t)的关系如图所示(溶液体积变化忽略不计):
(aq)+2I-(aq)+H2O(l)。溶液中c(I-)与反应时间(t)的关系如图所示(溶液体积变化忽略不计):
①m点时υ逆
②若平衡时溶液的pH=13,该反应的平衡常数K=
(5)已知H3AsO4的电离常数分别为Ka1=6.3×10−2,Ka2=1.0×10−7,Ka3=3.2×10−12。
①25℃时,0.1 mol∙L−1的NaH2AsO4溶液中:c(H3AsO4)
 )(填“>”、“=”或“<”)。
)(填“>”、“=”或“<”)。②25℃时,向10mL 0.1 mol∙L−1的H3AsO4溶液中逐滴滴加1 mol∙L−1 NaOH溶液至中性,此时混合溶液中
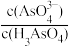 =
=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】用低品铜矿(主要含CuS、FeO)制备Cu2O的一种工艺流程如图:
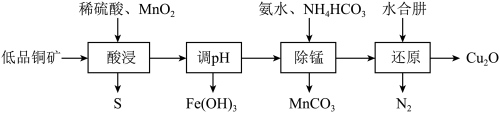
(1)“酸浸”中CuS发生反应的化学方程式为_____ 。
(2)“调pH”后滤液中Fe3+刚好沉淀完全(离子浓度小于1×10-5mol·L-1认为沉淀完全),此时pH约为_____ 。[Ksp[Fe(OH)3]=1×10-38]
(3)“除锰”时的离子方程式为_____ 。
(4)“还原”前需测定铜氨离子{[Cu(NH3)4]2+}的浓度来确定水合肼的用量。准确量取20.0mL除去Mn2+的铜氨溶液于100mL容量瓶中,加水稀释至刻度;准确量取25.00mL稀释后的溶液于锥形瓶中,滴加3mol·L-1H2SO4至pH为3~4,加入过量KI固体。以淀粉溶液为指示剂,生成的碘用0.1000mol·L-1Na2S2O3标准溶液滴定至终点(反应为2Cu2++4I-=2CuI+I2,I2+2S2O =2I-+S4O
=2I-+S4O ),重复2~3次,平均消耗Na2S2O3标准溶液20.00mL。计算铜氨溶液的物质的量浓度
),重复2~3次,平均消耗Na2S2O3标准溶液20.00mL。计算铜氨溶液的物质的量浓度_____ (写出计算过程)。
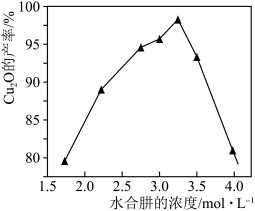
(5)保持其它条件不变,水合肼浓度对Cu2O的产率的影响如图所示。水合肼浓度大于3.25mol·L-1时Cu2O的产率下降,[Cu(NH3)4]2+的转化率仍增大,可能的原因是_____ 。

(1)“酸浸”中CuS发生反应的化学方程式为
(2)“调pH”后滤液中Fe3+刚好沉淀完全(离子浓度小于1×10-5mol·L-1认为沉淀完全),此时pH约为
(3)“除锰”时的离子方程式为
(4)“还原”前需测定铜氨离子{[Cu(NH3)4]2+}的浓度来确定水合肼的用量。准确量取20.0mL除去Mn2+的铜氨溶液于100mL容量瓶中,加水稀释至刻度;准确量取25.00mL稀释后的溶液于锥形瓶中,滴加3mol·L-1H2SO4至pH为3~4,加入过量KI固体。以淀粉溶液为指示剂,生成的碘用0.1000mol·L-1Na2S2O3标准溶液滴定至终点(反应为2Cu2++4I-=2CuI+I2,I2+2S2O
 =2I-+S4O
=2I-+S4O ),重复2~3次,平均消耗Na2S2O3标准溶液20.00mL。计算铜氨溶液的物质的量浓度
),重复2~3次,平均消耗Na2S2O3标准溶液20.00mL。计算铜氨溶液的物质的量浓度(5)保持其它条件不变,水合肼浓度对Cu2O的产率的影响如图所示。水合肼浓度大于3.25mol·L-1时Cu2O的产率下降,[Cu(NH3)4]2+的转化率仍增大,可能的原因是

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】某种电镀污泥主要含有碲化亚钢(Cu2Te)、三氧化二铬(Cr2O3)以及少量的金(Au),可用于制取Na2Cr2O7溶液、金属铜和粗碲等,以实现有害废料的资源化利用,工艺流程如图:

已知:煅烧时,Cu2Te发生的反应为Cu2Te+2O2 2CuO+TeO2。
2CuO+TeO2。
(1)写出煅烧时Cr2O3发生反应的化学方程式____ 。
(2)酸浸过程中TeO2转化为TeO2+,写出酸浸过程中可能发生的反应离子方程式____ 。
(3)“电解沉积”步骤除了生成铜、O2还有____ (填化学式),该物质可返回____ 工序重复使用。
(4)上述流程中Na2Cr2O7发生氧化还原反应后所得溶液中除含有Cr3+外,还含有一定浓度的Fe3+杂质,可通过加碱调pH的方法使两者转化为沉淀。已知c(Cr3+)=5×10-5mol·L-1,则当溶液中开始析出Cr(OH)3沉淀时,Fe3+是否沉淀完全?____ (填“是”或“否”)。{已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31}

已知:煅烧时,Cu2Te发生的反应为Cu2Te+2O2
 2CuO+TeO2。
2CuO+TeO2。(1)写出煅烧时Cr2O3发生反应的化学方程式
(2)酸浸过程中TeO2转化为TeO2+,写出酸浸过程中可能发生的反应离子方程式
(3)“电解沉积”步骤除了生成铜、O2还有
(4)上述流程中Na2Cr2O7发生氧化还原反应后所得溶液中除含有Cr3+外,还含有一定浓度的Fe3+杂质,可通过加碱调pH的方法使两者转化为沉淀。已知c(Cr3+)=5×10-5mol·L-1,则当溶液中开始析出Cr(OH)3沉淀时,Fe3+是否沉淀完全?
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】电化学原理在生产生活中运用广泛,下面是常见的一些运用。
I.汽车尾气中氮氧化合物、碳氧化合物的处理会污染环境,运用电化学方法可以进行NO的消除和CO含量检测。
(1)间接电解法除NO。其原理如图1所示,从A口中出来的气体是___________ ,电解池阴极的电极反应式___________ 。用离子方程式表示吸收柱中除去NO的原理___________ 。

(2)用电化学气敏传感器测定汽车尾气中CO含量,原理如图2所示,B电极是该电池的___________ (填“正极”或“负极”),A电极上的电极反应式为___________ 。
II.运用电解Na2CO3溶液制备小苏打和烧碱,原理如下图所示。
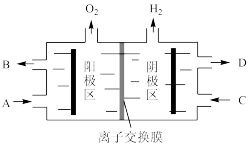
(3)B处排出的溶液主要溶质为________ 。电解槽中的离子交换膜为_______ (填“阴”或“阳”)离子交换膜,当阳极区收集到11.2L气体(标准状况下),阴极区质量变化________ g。
III.电解法可用于提纯金属。已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(杂质与酸不反应),某小组在实验室条件下以CuSO4溶液为电解液,用电解的方法实现粗铜精炼,并对阳极泥进行回收。
步骤一:电解精炼铜
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:
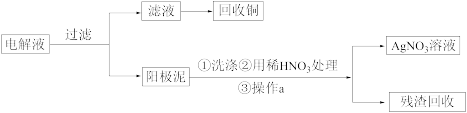
(4)步骤一结束后,电解过程中,CuSO4的浓度会___________ (填“增大”或“不变”或“减小”)
(5)步骤二阳极泥的综合利用中,操作a需要用到的玻璃仪器除了烧杯外,还需要_____ 。
(6)残渣含有少量的黄金,为了回收金,查阅了相关资料(见下表)
从资料中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与浓盐酸按体积比1:3的混合物)。请从化学平衡的角度解释金能溶于王水的原因___________ 。
I.汽车尾气中氮氧化合物、碳氧化合物的处理会污染环境,运用电化学方法可以进行NO的消除和CO含量检测。
(1)间接电解法除NO。其原理如图1所示,从A口中出来的气体是

(2)用电化学气敏传感器测定汽车尾气中CO含量,原理如图2所示,B电极是该电池的
II.运用电解Na2CO3溶液制备小苏打和烧碱,原理如下图所示。

(3)B处排出的溶液主要溶质为
III.电解法可用于提纯金属。已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(杂质与酸不反应),某小组在实验室条件下以CuSO4溶液为电解液,用电解的方法实现粗铜精炼,并对阳极泥进行回收。
步骤一:电解精炼铜
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:

(4)步骤一结束后,电解过程中,CuSO4的浓度会
(5)步骤二阳极泥的综合利用中,操作a需要用到的玻璃仪器除了烧杯外,还需要
(6)残渣含有少量的黄金,为了回收金,查阅了相关资料(见下表)
| 反应原理 | 化学平衡常数 | |
| 反应1 | Au+6HNO3(浓)⇌Au(NO3)3+3NO2↑+3H2O | <<1 |
| 反应2 | Au3++4Cl-=AuCl | >>1 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】了解原理就能更好地解决问题,是学生迁移与应用的能力外显。请用学习的相关原理回答问题。
(1)已知:电离平衡常数:Ka(CH3COOH)=1.8×10-5;Kb(NH3·H2O)=1.8×10-5。
则:①CH3COONH4溶液呈____ 性(填“酸”、“碱”或“中”),理由是____ 。
②对于醋酸溶液和醋酸钠溶液的下列说法正确的是____ (填字母)
A.升高温度可以促进醋酸电离,也可以促进醋酸钠水解
B.常温下,在pH=3的醋酸与pH=11醋酸钠溶液中,由水电离出的c(H+)都是1×10-11 mol·L-1
C.常温下,等浓度等体积的醋酸和醋酸钠混合后,溶液中2c(Na+)=c(CH3COO-)+c(CH3COOH)
D.25℃时,向0.1 mol·L-1醋酸中滴加NaOH至溶液中c(CH3COO-):c(CH3COOH)=9:5,则溶液pH=9
(2)在25℃时, 浓度相等的①NH4Cl ②CH3COONH4 ③NH4HSO4 ④(NH4)2CO3四种溶液,其对应溶液中溶质的物质的量浓度由小到大的顺序是
浓度相等的①NH4Cl ②CH3COONH4 ③NH4HSO4 ④(NH4)2CO3四种溶液,其对应溶液中溶质的物质的量浓度由小到大的顺序是____ 。(用序号回答)
(3)利用下列装置可以验证不同化合价铁的氧化还原能力。

①电流表显示电子由铁电极流向石墨电极。则盐桥(含有琼胶的KCl饱和溶液)中的 进入
进入___ 电极溶液中。
②电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加,石墨电极上未见Fe析出。则石墨电极溶液中的电极反应式为____ ;则Fe2+氧化性小于____ 。
(4)金属腐蚀现象遍及国民经济和国防建设各个领域,危害十分严重。金属阳极钝化法是一种金属防腐的处理方法。如图是金属阳极钝化法在Al表面形成致密Al2O3氧化膜,则石墨电极附近产生的气体是____ (填化学式);该阳极的电极反应式____ 。

(1)已知:电离平衡常数:Ka(CH3COOH)=1.8×10-5;Kb(NH3·H2O)=1.8×10-5。
则:①CH3COONH4溶液呈
②对于醋酸溶液和醋酸钠溶液的下列说法正确的是
A.升高温度可以促进醋酸电离,也可以促进醋酸钠水解
B.常温下,在pH=3的醋酸与pH=11醋酸钠溶液中,由水电离出的c(H+)都是1×10-11 mol·L-1
C.常温下,等浓度等体积的醋酸和醋酸钠混合后,溶液中2c(Na+)=c(CH3COO-)+c(CH3COOH)
D.25℃时,向0.1 mol·L-1醋酸中滴加NaOH至溶液中c(CH3COO-):c(CH3COOH)=9:5,则溶液pH=9
(2)在25℃时,
 浓度相等的①NH4Cl ②CH3COONH4 ③NH4HSO4 ④(NH4)2CO3四种溶液,其对应溶液中溶质的物质的量浓度由小到大的顺序是
浓度相等的①NH4Cl ②CH3COONH4 ③NH4HSO4 ④(NH4)2CO3四种溶液,其对应溶液中溶质的物质的量浓度由小到大的顺序是(3)利用下列装置可以验证不同化合价铁的氧化还原能力。

①电流表显示电子由铁电极流向石墨电极。则盐桥(含有琼胶的KCl饱和溶液)中的
 进入
进入②电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加,石墨电极上未见Fe析出。则石墨电极溶液中的电极反应式为
(4)金属腐蚀现象遍及国民经济和国防建设各个领域,危害十分严重。金属阳极钝化法是一种金属防腐的处理方法。如图是金属阳极钝化法在Al表面形成致密Al2O3氧化膜,则石墨电极附近产生的气体是

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】硼酸(H3BO3)大量应用于玻璃制造行业,以硼镁矿(含 2MgO·B2O3·H2O、SiO2及少量Fe3O4、CaCO3、Al2O3)为原料生产硼酸的工艺流程如图:
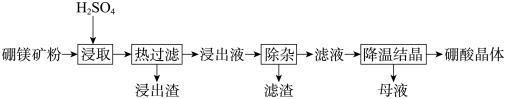
已知:①H3BO3在 20℃、40℃、60℃、100℃时的溶解度依次为 5.0 g、8.7 g、14.8 g、40.2 g。
②Fe3+、Al3+、Fe2+和 Mg2+以氢氧化物形式完全沉淀时,溶液的 pH 分别为 3.2、5.2、9.7 和 12.4。
(1)由于矿粉中含 CaCO3,“浸取”时容易产生大量泡沫使物料从反应器溢出,故应分批加入 H2SO4,该反应的化学方程式为________ 。
(2)“浸出液”显酸性,含 H3BO3和 Mg2+、SO ,还含有 Fe3+、Fe2+、Ca2+、Al3+等杂质。“除杂”时向浸出液中依次加入适量 H2O2和 MgO,除去的杂质离子是
,还含有 Fe3+、Fe2+、Ca2+、Al3+等杂质。“除杂”时向浸出液中依次加入适量 H2O2和 MgO,除去的杂质离子是________ 。H2O2的作用是________ (用离子方程式表示)。
(3)“浸取”后,采用“热过滤”的目的是________ 。
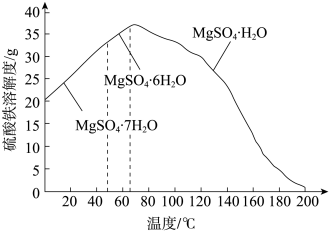
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如图,且溶液的沸点随压强增大而升高。为了从“母液”中充分回收 MgSO4·H2O,应采取的措施是将“母液” 蒸发浓缩,________ 。

已知:①H3BO3在 20℃、40℃、60℃、100℃时的溶解度依次为 5.0 g、8.7 g、14.8 g、40.2 g。
②Fe3+、Al3+、Fe2+和 Mg2+以氢氧化物形式完全沉淀时,溶液的 pH 分别为 3.2、5.2、9.7 和 12.4。
(1)由于矿粉中含 CaCO3,“浸取”时容易产生大量泡沫使物料从反应器溢出,故应分批加入 H2SO4,该反应的化学方程式为
(2)“浸出液”显酸性,含 H3BO3和 Mg2+、SO
 ,还含有 Fe3+、Fe2+、Ca2+、Al3+等杂质。“除杂”时向浸出液中依次加入适量 H2O2和 MgO,除去的杂质离子是
,还含有 Fe3+、Fe2+、Ca2+、Al3+等杂质。“除杂”时向浸出液中依次加入适量 H2O2和 MgO,除去的杂质离子是(3)“浸取”后,采用“热过滤”的目的是
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如图,且溶液的沸点随压强增大而升高。为了从“母液”中充分回收 MgSO4·H2O,应采取的措施是将“母液” 蒸发浓缩,

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】陨铁的主要成分是:四氧化三铁、铁、镍、硅酸钠等,某化学小组用陨铁为原料制备NiOOH、 的工艺流程图如图所示:
的工艺流程图如图所示:

已知:①铁和镍同属于铁系元素,镍性质与铁相似,能与酸反应。② 在酸性环境较稳定,不易被氧化,在碱性环境易被氧化。③
在酸性环境较稳定,不易被氧化,在碱性环境易被氧化。③ 、
、 、
、 开始形成沉淀和沉淀完全的pH分别为:7.6~9.6;2.7~3.7;8.5~9.5
开始形成沉淀和沉淀完全的pH分别为:7.6~9.6;2.7~3.7;8.5~9.5
(1)陨铁酸化过程所用的酸是________ ,固体A的用途:________ (写一种即可)。
(2)检验滤液1中 所用试剂名称为:
所用试剂名称为:________ ;实验现象是________________________ 。
(3)在第④步加NaOH调节溶液pH的范围应为:________________________ 。
(4)第⑤步离子反应方程式为________________________________ ;第⑦步离子反应方程式为________________________________ 。
(5)整个工艺流程中可以循环使用的物质有:________________________ 。
 的工艺流程图如图所示:
的工艺流程图如图所示:
已知:①铁和镍同属于铁系元素,镍性质与铁相似,能与酸反应。②
 在酸性环境较稳定,不易被氧化,在碱性环境易被氧化。③
在酸性环境较稳定,不易被氧化,在碱性环境易被氧化。③ 、
、 、
、 开始形成沉淀和沉淀完全的pH分别为:7.6~9.6;2.7~3.7;8.5~9.5
开始形成沉淀和沉淀完全的pH分别为:7.6~9.6;2.7~3.7;8.5~9.5(1)陨铁酸化过程所用的酸是
(2)检验滤液1中
 所用试剂名称为:
所用试剂名称为:(3)在第④步加NaOH调节溶液pH的范围应为:
(4)第⑤步离子反应方程式为
(5)整个工艺流程中可以循环使用的物质有:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】硼铁混合精矿含有硼镁石[MgBO2(OH)]、磁铁矿(Fe3O4) 、磁黄铁矿(Fe2S)、晶质铀矿(UO2)等,以该矿为原料制备MgSO4•H2O和硼酸(H3BO3)的工艺流程如下:
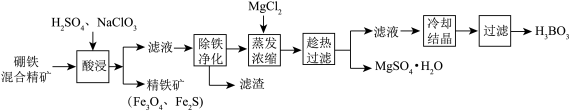
已知:UO22+在pH为4~5的溶液中生成UO2(OH)2沉淀。
回答下列问题:
(1)“酸浸”时,为了提高浸出率可采取的措施有:_______________________ (至少答两个措施),该步骤中NaClO3可将UO2转化为UO22+,则该反应的离子方程式为 ________ 。
(2)“除铁净化”需要加入______ (填化学式)把溶液pH调节至4~5,滤渣的成分是____ 。
(3)“蒸发浓缩”时,加入固体MgCl2的作用是______________________ 。
(4)铁精矿(Fe3O4、Fe2S)经过一系列加工后,可用于制备氢氧化铁固体。已知T℃Ksp[Fe(OH)3]=4.0×10-39、Ksp[Fe(OH)2]=8.0×10-16、Kw=10-a,回答下列问题:
①在T℃,假设Fe3+水解的离子方程式是:Fe3+(aq)+3H2O(l)= Fe(OH)3 (s)+3H+(aq),则该条件下Fe3+水解反应的平衡常数K=___________ (用含a的字母表示)。
②在T℃向饱和的Fe(OH)3、Fe(OH)2混合溶液中,加入少量NaOH固体(忽略溶液体积变化),则溶液中的 会
会________ (填“变大”“变小”或“不变”),请结合相关数据推理说明:____________________________ 。

已知:UO22+在pH为4~5的溶液中生成UO2(OH)2沉淀。
回答下列问题:
(1)“酸浸”时,为了提高浸出率可采取的措施有:
(2)“除铁净化”需要加入
(3)“蒸发浓缩”时,加入固体MgCl2的作用是
(4)铁精矿(Fe3O4、Fe2S)经过一系列加工后,可用于制备氢氧化铁固体。已知T℃Ksp[Fe(OH)3]=4.0×10-39、Ksp[Fe(OH)2]=8.0×10-16、Kw=10-a,回答下列问题:
①在T℃,假设Fe3+水解的离子方程式是:Fe3+(aq)+3H2O(l)= Fe(OH)3 (s)+3H+(aq),则该条件下Fe3+水解反应的平衡常数K=
②在T℃向饱和的Fe(OH)3、Fe(OH)2混合溶液中,加入少量NaOH固体(忽略溶液体积变化),则溶液中的
 会
会
您最近一年使用:0次



