NH3、N2H4在工业生产和国防建设中都有广泛应用。回答下列问题:
(1)①N2H4 (g) N2(g)+2H2(g) △H1
N2(g)+2H2(g) △H1
②N2(g)+3H2(g) 2NH3(g) △H2
2NH3(g) △H2
③7N2H4(g) 8NH3(g)+3N2(g)+2H2(g) △H3
8NH3(g)+3N2(g)+2H2(g) △H3
△H3=___________ (用含△H1和△H2的代数式表示)。
(2)纳米钴的催化作用下,N2H4可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。当反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示。
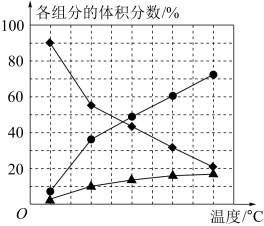
该反应的△H________ (填“>”或“<”)0,N2H4发生分解反应的化学方程式为___________ 。
(3)T℃时,向一体积为5L 的恒容密闭容器中充入总物质的量为2 mol的CO2和NH3,在一定条件下发生反应:2NH3(g)+CO2(g)====CO(NH2)2(s)+H2O(g)。混合气体中氨气的体积分数随反应时间的变化如图所示。
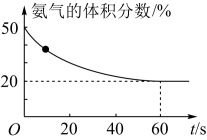
① 0~60s内,反应速率v(CO2)=________ mol/(L·s)
② T℃时,该反应的化学平衡常数K=________ 。
(1)①N2H4 (g)
 N2(g)+2H2(g) △H1
N2(g)+2H2(g) △H1②N2(g)+3H2(g)
 2NH3(g) △H2
2NH3(g) △H2③7N2H4(g)
 8NH3(g)+3N2(g)+2H2(g) △H3
8NH3(g)+3N2(g)+2H2(g) △H3△H3=
(2)纳米钴的催化作用下,N2H4可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。当反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示。

该反应的△H
(3)T℃时,向一体积为5L 的恒容密闭容器中充入总物质的量为2 mol的CO2和NH3,在一定条件下发生反应:2NH3(g)+CO2(g)====CO(NH2)2(s)+H2O(g)。混合气体中氨气的体积分数随反应时间的变化如图所示。

① 0~60s内,反应速率v(CO2)=
② T℃时,该反应的化学平衡常数K=
更新时间:2017-10-12 21:13:38
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】空气中的污染物主要来源为燃煤、机动车尾气等。因此对CO、SO2、NOx等进行研究就具有重要意义。
回答下列问题:
(1)为减少CO、SO2污染的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+ O2(g)=H2O(g)△H=-241.8kJ·mol-1
O2(g)=H2O(g)△H=-241.8kJ·mol-1
C(s)+ O2(g)=CO(g)△H=-110.5kJ·mol-1
O2(g)=CO(g)△H=-110.5kJ·mol-1
焦炭与水蒸气反应的热化学方程式为___ 。
②在含硫燃料中加入石灰石,燃煤生成的SO2即可转化为CaSO4。该化学方程式为___ 。
(2)有人设想,用SO2~碘循环分解水制氢,主要涉及下列反应:
Ⅰ.SO2+2H2O+I2=H2SO4+2HI
Ⅱ.2HI(g) H2(g)+I2(g)
H2(g)+I2(g)
Ⅲ.2H2SO4(l) 2SO2(g)+O2(g)+2H2O(g)
2SO2(g)+O2(g)+2H2O(g)
①一定温度下,若向2L容积不变的密闭容器中加入2mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。0~2min内的平均反应速率v(HI)=___ ;相同温度下,若向该容器中开始加入的HI(g)物质的量是4mol,则___ 是原来的2倍。(填字母编号)

A.平衡时容器内气体的平均相对分子质量
B.平衡时H2的体积分数
C.达到平衡的时间
D.平衡时I2的物质的量
②能说明反应Ⅲ在恒容下达到平衡的标志是___ (填字母编号)
A.2v正(SO2)=v逆(O2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氧气的体积分数不变
③在CuCl2热溶液中通入SO2气体可制备CuCl沉淀,该反应的离子方程式为___ 。
回答下列问题:
(1)为减少CO、SO2污染的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+
 O2(g)=H2O(g)△H=-241.8kJ·mol-1
O2(g)=H2O(g)△H=-241.8kJ·mol-1C(s)+
 O2(g)=CO(g)△H=-110.5kJ·mol-1
O2(g)=CO(g)△H=-110.5kJ·mol-1焦炭与水蒸气反应的热化学方程式为
②在含硫燃料中加入石灰石,燃煤生成的SO2即可转化为CaSO4。该化学方程式为
(2)有人设想,用SO2~碘循环分解水制氢,主要涉及下列反应:
Ⅰ.SO2+2H2O+I2=H2SO4+2HI
Ⅱ.2HI(g)
 H2(g)+I2(g)
H2(g)+I2(g)Ⅲ.2H2SO4(l)
 2SO2(g)+O2(g)+2H2O(g)
2SO2(g)+O2(g)+2H2O(g)①一定温度下,若向2L容积不变的密闭容器中加入2mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。0~2min内的平均反应速率v(HI)=

A.平衡时容器内气体的平均相对分子质量
B.平衡时H2的体积分数
C.达到平衡的时间
D.平衡时I2的物质的量
②能说明反应Ⅲ在恒容下达到平衡的标志是
A.2v正(SO2)=v逆(O2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氧气的体积分数不变
③在CuCl2热溶液中通入SO2气体可制备CuCl沉淀,该反应的离子方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】Ⅰ. 煤的气化是一种重要的制氢途径。在一定温度下,向体积固定的密闭容器中加入足量的C(s)和 ,起始压强为0.2MPa时,发生下列反应生成水煤气:
,起始压强为0.2MPa时,发生下列反应生成水煤气:
反应Ⅰ: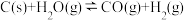

反应Ⅱ: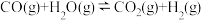

反应平衡时, 的转化率为50%,CO的物质的量为0.1mol。
的转化率为50%,CO的物质的量为0.1mol。
(1)有利于反应Ⅰ自发进行的条件是_______ 。
(2)下列说法正确的是_______ 。
A. 平衡时向容器中充入惰性气体,反应Ⅰ的平衡不移动
B. 混合气体的密度保持不变时,不能说明反应体系已达到平衡
C. 平衡时整个体系吸收31.2kJ能量
D. 反应Ⅱ的化学方程式左右两侧的计量数之和相等,所以反应Ⅱ的
E. 平衡时 的体积分数不可能大于
的体积分数不可能大于
(3)反应Ⅰ的平衡常数
_______ MPa。[ :以气体物质的分压
:以气体物质的分压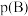 替代浓度计算得到的平衡常数,
替代浓度计算得到的平衡常数,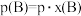 ,p表示平衡时总压,x(B)表示平衡系统中B的物质的量分数]
,p表示平衡时总压,x(B)表示平衡系统中B的物质的量分数]
Ⅱ. 捕获和转化可减少
捕获和转化可减少 排放并实现资源利用,原理如图2所示。反应①完成之后,以
排放并实现资源利用,原理如图2所示。反应①完成之后,以 为载气,将恒定组成的
为载气,将恒定组成的 、
、 混合气匀速通入恒温反应器,流出气体各组分的气体流速随时间变化如图3所示。反应过程中始终未检测到
混合气匀速通入恒温反应器,流出气体各组分的气体流速随时间变化如图3所示。反应过程中始终未检测到 ,在催化剂上有积碳。
,在催化剂上有积碳。

(4)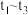 ,
, 比n(CO)多,可能发生副反应的化学方程式为
比n(CO)多,可能发生副反应的化学方程式为_______ 。
(5) 时刻,副反应生成
时刻,副反应生成 的速率
的速率_______ 反应②生成 速率(填“>”、“<”或“=”)。
速率(填“>”、“<”或“=”)。
(6) 后CO、
后CO、 流速变化的可能原因是
流速变化的可能原因是_______ 。
 ,起始压强为0.2MPa时,发生下列反应生成水煤气:
,起始压强为0.2MPa时,发生下列反应生成水煤气:反应Ⅰ:
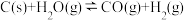

反应Ⅱ:
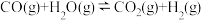

反应平衡时,
 的转化率为50%,CO的物质的量为0.1mol。
的转化率为50%,CO的物质的量为0.1mol。(1)有利于反应Ⅰ自发进行的条件是
(2)下列说法正确的是
A. 平衡时向容器中充入惰性气体,反应Ⅰ的平衡不移动
B. 混合气体的密度保持不变时,不能说明反应体系已达到平衡
C. 平衡时整个体系吸收31.2kJ能量
D. 反应Ⅱ的化学方程式左右两侧的计量数之和相等,所以反应Ⅱ的

E. 平衡时
 的体积分数不可能大于
的体积分数不可能大于
(3)反应Ⅰ的平衡常数

 :以气体物质的分压
:以气体物质的分压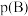 替代浓度计算得到的平衡常数,
替代浓度计算得到的平衡常数,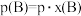 ,p表示平衡时总压,x(B)表示平衡系统中B的物质的量分数]
,p表示平衡时总压,x(B)表示平衡系统中B的物质的量分数] Ⅱ.
 捕获和转化可减少
捕获和转化可减少 排放并实现资源利用,原理如图2所示。反应①完成之后,以
排放并实现资源利用,原理如图2所示。反应①完成之后,以 为载气,将恒定组成的
为载气,将恒定组成的 、
、 混合气匀速通入恒温反应器,流出气体各组分的气体流速随时间变化如图3所示。反应过程中始终未检测到
混合气匀速通入恒温反应器,流出气体各组分的气体流速随时间变化如图3所示。反应过程中始终未检测到 ,在催化剂上有积碳。
,在催化剂上有积碳。
(4)
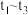 ,
, 比n(CO)多,可能发生副反应的化学方程式为
比n(CO)多,可能发生副反应的化学方程式为(5)
 时刻,副反应生成
时刻,副反应生成 的速率
的速率 速率(填“>”、“<”或“=”)。
速率(填“>”、“<”或“=”)。(6)
 后CO、
后CO、 流速变化的可能原因是
流速变化的可能原因是
您最近一年使用:0次
【推荐3】I.研究氮氧化物的反应机理,对于消除对环境的污染有重要意义。某化学小组查阅资料知2NO(g)+O2(g) 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g) N2O2(g)(快)
N2O2(g)(快) 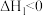 V1正=K1正c2(NO)V1逆=K1逆c(N2O2)
V1正=K1正c2(NO)V1逆=K1逆c(N2O2)
②N2O2(g)+O2(g) 2NO2(g)(慢)
2NO2(g)(慢)  V2正=K2正c(N2O2)V2逆=K2逆c2(NO2)
V2正=K2正c(N2O2)V2逆=K2逆c2(NO2)
请回答下列问题:
(1)写出反应2NO+O2=2NO2的热化学方程式_______________ (焓变用含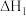 和
和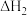 的式子表示
的式子表示 。
。
(2)一定温度下,反应2NO(g)+O2(g) 2NO2(g)达到平衡状态,请写出用K1正、K1逆、K2正、K2逆表示的平衡常数表达式K=
2NO2(g)达到平衡状态,请写出用K1正、K1逆、K2正、K2逆表示的平衡常数表达式K=___________________ 。
(3)工业上可用氨水作为NO2的吸收剂,NO2通入氨水发生的反应:2NO2+2NH3 H2O=NH4NO3+NH4NO2+H2O若反应后的溶液滴入甲基橙呈红色,则反应后溶液中c(NO
H2O=NH4NO3+NH4NO2+H2O若反应后的溶液滴入甲基橙呈红色,则反应后溶液中c(NO )+c(NO
)+c(NO )
)____ c(NH )(填“>”、“<”或“=”)。
)(填“>”、“<”或“=”)。
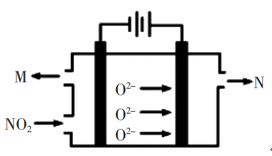
(4)工业上也可用电解法处理氮氧化物的污染。电解池如图所示,阴阳电极间是新型固体氧化物陶瓷,在一定条件下可传导O2-。该电解池阴极的电极反应式是_________ 。
II.在一定温度、压强下,向密闭容器中投入一定量N2和H2,发生反应:N2(g)+3H2(g) 2NH3(g)
2NH3(g) 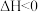
①下列措施中能加快反应速率并提高氢气的转化率的是__________ (填字母)。
a.其他条件不变时,压缩容器体积
b.其他条件不变时,升高反应体系温度
c.使用合适的催化剂
d.保持容器体积不变,充入一定量的氮气
②实际生产中往往需要将温度控制在一个合适的范围,分析温度不宜过高也不宜过低的原因:_______ 。
 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:①2NO(g)
 N2O2(g)(快)
N2O2(g)(快) 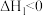 V1正=K1正c2(NO)V1逆=K1逆c(N2O2)
V1正=K1正c2(NO)V1逆=K1逆c(N2O2)②N2O2(g)+O2(g)
 2NO2(g)(慢)
2NO2(g)(慢)  V2正=K2正c(N2O2)V2逆=K2逆c2(NO2)
V2正=K2正c(N2O2)V2逆=K2逆c2(NO2)请回答下列问题:
(1)写出反应2NO+O2=2NO2的热化学方程式
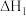 和
和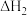 的式子表示
的式子表示 。
。(2)一定温度下,反应2NO(g)+O2(g)
 2NO2(g)达到平衡状态,请写出用K1正、K1逆、K2正、K2逆表示的平衡常数表达式K=
2NO2(g)达到平衡状态,请写出用K1正、K1逆、K2正、K2逆表示的平衡常数表达式K=(3)工业上可用氨水作为NO2的吸收剂,NO2通入氨水发生的反应:2NO2+2NH3
 H2O=NH4NO3+NH4NO2+H2O若反应后的溶液滴入甲基橙呈红色,则反应后溶液中c(NO
H2O=NH4NO3+NH4NO2+H2O若反应后的溶液滴入甲基橙呈红色,则反应后溶液中c(NO )+c(NO
)+c(NO )
) )(填“>”、“<”或“=”)。
)(填“>”、“<”或“=”)。(4)工业上也可用电解法处理氮氧化物的污染。电解池如图所示,阴阳电极间是新型固体氧化物陶瓷,在一定条件下可传导O2-。该电解池阴极的电极反应式是

II.在一定温度、压强下,向密闭容器中投入一定量N2和H2,发生反应:N2(g)+3H2(g)
 2NH3(g)
2NH3(g) 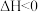
①下列措施中能加快反应速率并提高氢气的转化率的是
a.其他条件不变时,压缩容器体积
b.其他条件不变时,升高反应体系温度
c.使用合适的催化剂
d.保持容器体积不变,充入一定量的氮气
②实际生产中往往需要将温度控制在一个合适的范围,分析温度不宜过高也不宜过低的原因:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】回答下列问题
(1)已知:2Zn(s)+O2(g)=2ZnO(s) ΔH=-701.0 kJ/mol
2Hg(l)+O2(g)= 2HgO(s) ΔH=-181.6 kJ/mol
则Zn和HgO反应生成ZnO和Hg的热化学方程式为_______
(2)某温度时,在一密闭容器中,A、B、C三种物质的物质的量随时间的变化曲线如图所示。
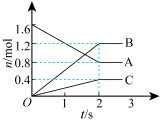
则该反应的化学方程式为_______ (用A、B、C表示)
(3)温度一定时, 于密闭容器中发生可逆反应: mA(g) + nB(g) pC(g), 达到平衡, 若将混合气体的体积压缩到原来的 1/2, 当再次达到平衡时, C的浓度为原平衡时C的浓度的 1.9 倍, 则 m + n
pC(g), 达到平衡, 若将混合气体的体积压缩到原来的 1/2, 当再次达到平衡时, C的浓度为原平衡时C的浓度的 1.9 倍, 则 m + n _______ p(填“>、<、=” )。
(1)已知:2Zn(s)+O2(g)=2ZnO(s) ΔH=-701.0 kJ/mol
2Hg(l)+O2(g)= 2HgO(s) ΔH=-181.6 kJ/mol
则Zn和HgO反应生成ZnO和Hg的热化学方程式为
(2)某温度时,在一密闭容器中,A、B、C三种物质的物质的量随时间的变化曲线如图所示。

则该反应的化学方程式为
(3)温度一定时, 于密闭容器中发生可逆反应: mA(g) + nB(g)
 pC(g), 达到平衡, 若将混合气体的体积压缩到原来的 1/2, 当再次达到平衡时, C的浓度为原平衡时C的浓度的 1.9 倍, 则 m + n
pC(g), 达到平衡, 若将混合气体的体积压缩到原来的 1/2, 当再次达到平衡时, C的浓度为原平衡时C的浓度的 1.9 倍, 则 m + n
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】卤化铵(NH4X)在工业上应用十分广泛。
(1)卤化铵分解过程是质子传递过程,HX越稳定,对应的铵盐热稳定性越差。由此推知,NH4F、NH4Cl、NH4Br、NH4I中分解温度最低的是___________ (填化学式)。
(2)已知:①

②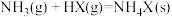

③
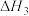
④
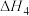
由此推知,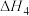 =
=___________ (用含 、
、 和
和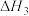 的代数式表示)。
的代数式表示)。
(3)溴化铵溶液显___________ 性,用离子方程式解释原因:___________ 。
(4)常温下,将氨水与氯化铵溶液混合,得到 的混合溶液。溶液中
的混合溶液。溶液中 、
、 与pH的关系如图所示。表示
与pH的关系如图所示。表示 的变化的曲线是
的变化的曲线是___________ (填“A”或“B”)。 常温下,NH3•H2O的电离平衡常数K=___________ 。pH=9.5时,溶液中离子浓度从大到小的顺序为___________ 。

(1)卤化铵分解过程是质子传递过程,HX越稳定,对应的铵盐热稳定性越差。由此推知,NH4F、NH4Cl、NH4Br、NH4I中分解温度最低的是
(2)已知:①


②
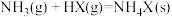

③

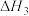
④

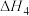
由此推知,
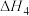 =
= 、
、 和
和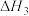 的代数式表示)。
的代数式表示)。(3)溴化铵溶液显
(4)常温下,将氨水与氯化铵溶液混合,得到
 的混合溶液。溶液中
的混合溶液。溶液中 、
、 与pH的关系如图所示。表示
与pH的关系如图所示。表示 的变化的曲线是
的变化的曲线是
您最近一年使用:0次
【推荐3】二甲醚(CH3OCH3)被称为“21世纪的清洁燃料”。以CO2、H2为原料制备二甲醚涉及的主要反应如下:
Ⅰ.2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H1=-122.5kJ·mol-1
CH3OCH3(g)+3H2O(g) △H1=-122.5kJ·mol-1
Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.1kJ·mol-1
CO(g)+H2O(g) △H2=+41.1kJ·mol-1
回答下列问题:
(1)反应2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)的△H=
CH3OCH3(g)+H2O(g)的△H=___________ 。该反应在___________ (填“较高温度”、“较低温度”或“任意温度”)下能自发进行。
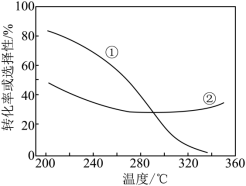
(2)在压强不变、CO2和H2的起始投料一定的条件下,发生反应Ⅰ、Ⅱ,实验测得CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图所示。
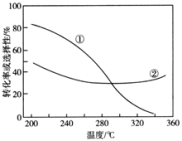
已知:CH3OCH3的选择性=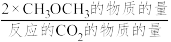
其中表示平衡时CH3OCH3的选择性的是曲线___________ (填“①”或“②”);投料一定时,为同时提高CO2的平衡转化率和平衡时CH3OCH3的选择性,应选择的反应条件为___________ ;
A.高温高压 B.低温高压 C.高温低压 D.低温低压
温度高于300℃时,曲线②随温度升高而升高的原因是___________ 。
(3)对于反应CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.1kJ·mol-1,反应速率=v正-v逆=k正p(CO2)·p(H2)-k逆p(CO)·p(H2O),其中k正、k逆分别为正、逆反应速率常数,p为气体的分压(分压=总压×物质的量分数)。
CO(g)+H2O(g) △H2=+41.1kJ·mol-1,反应速率=v正-v逆=k正p(CO2)·p(H2)-k逆p(CO)·p(H2O),其中k正、k逆分别为正、逆反应速率常数,p为气体的分压(分压=总压×物质的量分数)。
①升高温度,k正-k逆___________ (填“增大”、“减小”或“不变”);
②在TK、101kPa下,按照n(CO2)∶n(H2)=1∶1投料,CO2转化率为50%时, 逆=1.25
逆=1.25 正,计算用气体分压表示的平衡常数KP=
正,计算用气体分压表示的平衡常数KP=___________ 。
(4)下图为绿色“二甲醚燃料电池”的工作原理示意图。
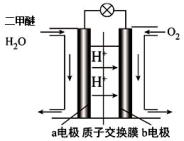
①a电极的电极反应式为___________ 。
②标准状况下,该电池每消耗11.2LO2,有___________ molH+向___________ 极移动(填“a”或“b”)。
Ⅰ.2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g) △H1=-122.5kJ·mol-1
CH3OCH3(g)+3H2O(g) △H1=-122.5kJ·mol-1Ⅱ.CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41.1kJ·mol-1
CO(g)+H2O(g) △H2=+41.1kJ·mol-1回答下列问题:
(1)反应2CO(g)+4H2(g)
 CH3OCH3(g)+H2O(g)的△H=
CH3OCH3(g)+H2O(g)的△H=(2)在压强不变、CO2和H2的起始投料一定的条件下,发生反应Ⅰ、Ⅱ,实验测得CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图所示。

已知:CH3OCH3的选择性=
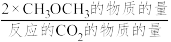
其中表示平衡时CH3OCH3的选择性的是曲线
A.高温高压 B.低温高压 C.高温低压 D.低温低压
温度高于300℃时,曲线②随温度升高而升高的原因是
(3)对于反应CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41.1kJ·mol-1,反应速率=v正-v逆=k正p(CO2)·p(H2)-k逆p(CO)·p(H2O),其中k正、k逆分别为正、逆反应速率常数,p为气体的分压(分压=总压×物质的量分数)。
CO(g)+H2O(g) △H2=+41.1kJ·mol-1,反应速率=v正-v逆=k正p(CO2)·p(H2)-k逆p(CO)·p(H2O),其中k正、k逆分别为正、逆反应速率常数,p为气体的分压(分压=总压×物质的量分数)。①升高温度,k正-k逆
②在TK、101kPa下,按照n(CO2)∶n(H2)=1∶1投料,CO2转化率为50%时,
 逆=1.25
逆=1.25 正,计算用气体分压表示的平衡常数KP=
正,计算用气体分压表示的平衡常数KP=(4)下图为绿色“二甲醚燃料电池”的工作原理示意图。

①a电极的电极反应式为
②标准状况下,该电池每消耗11.2LO2,有
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】消除氮氧化物(主要为NO和NO2)污染是“蓝天计划”的重要内容之一。
(1)甲烷还原方法是在催化剂作用下可消除氮氧化物(主要为NO和NO2)污染, NO、O2和CH4的混合物反应体系主要发生如下反应:
2NO(g) + O2(g) 2NO2(g) ΔH=-113.0 kJ•mol-1 ①
2NO2(g) ΔH=-113.0 kJ•mol-1 ①
CH4(g) + 2O2(g) CO2(g) +2H2O (g) ΔH=-802. 3 kJ•mol-1 ②
CO2(g) +2H2O (g) ΔH=-802. 3 kJ•mol-1 ②
CH4(g) + 4NO(g) 2N2(g) + CO2(g) + 2H2O (g) ΔH=-1160 kJ•mol-1 ③
2N2(g) + CO2(g) + 2H2O (g) ΔH=-1160 kJ•mol-1 ③
① 则反应CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O (g) 的ΔH=
N2(g)+CO2(g)+2H2O (g) 的ΔH= ______ 。
② 反应CH4(g) + 2O2(g) CO2(g) +2H2O (l) ΔH=-a kJ•mol-1,则a
CO2(g) +2H2O (l) ΔH=-a kJ•mol-1,则a ____ 802. 3(填“>”、“<”或“=”)。
③ 在一定温度下,提高反应③中NO 转化率可采取的措施是_____ 。
(2)利用电化学装置可消除氮氧化物污染,变废为宝。

① 图Ⅰ装置实现的能量转化形式是_____ 。石墨Ⅱ电极上发生的电极反应方程式为_____ 。相同条件下,放电过程中消耗的NO2和O2的体积比为_____ 。
② 图Ⅱ为电解NO制备NH4NO3的装置。该装置中阳极的电极反应式为_____ 。“反应室”中发生反应的离子方程式为_____ 。
(1)甲烷还原方法是在催化剂作用下可消除氮氧化物(主要为NO和NO2)污染, NO、O2和CH4的混合物反应体系主要发生如下反应:
2NO(g) + O2(g)
 2NO2(g) ΔH=-113.0 kJ•mol-1 ①
2NO2(g) ΔH=-113.0 kJ•mol-1 ①CH4(g) + 2O2(g)
 CO2(g) +2H2O (g) ΔH=-802. 3 kJ•mol-1 ②
CO2(g) +2H2O (g) ΔH=-802. 3 kJ•mol-1 ②CH4(g) + 4NO(g)
 2N2(g) + CO2(g) + 2H2O (g) ΔH=-1160 kJ•mol-1 ③
2N2(g) + CO2(g) + 2H2O (g) ΔH=-1160 kJ•mol-1 ③① 则反应CH4(g)+2NO2(g)
 N2(g)+CO2(g)+2H2O (g) 的ΔH=
N2(g)+CO2(g)+2H2O (g) 的ΔH= ② 反应CH4(g) + 2O2(g)
 CO2(g) +2H2O (l) ΔH=-a kJ•mol-1,则a
CO2(g) +2H2O (l) ΔH=-a kJ•mol-1,则a ③ 在一定温度下,提高反应③中NO 转化率可采取的措施是
(2)利用电化学装置可消除氮氧化物污染,变废为宝。

① 图Ⅰ装置实现的能量转化形式是
② 图Ⅱ为电解NO制备NH4NO3的装置。该装置中阳极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】二甲醚 是无色气体,可作为一种新型能源,同时也是重要的化工原料,采用
是无色气体,可作为一种新型能源,同时也是重要的化工原料,采用 催化加氢可合成二甲醚,发生的反应如下:
催化加氢可合成二甲醚,发生的反应如下:
Ⅰ.

Ⅱ.
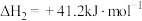
回答下列问题:
(1)在压强、 和
和 的起始投料一定的条件下,发生反应Ⅰ、Ⅱ,实验测得(
的起始投料一定的条件下,发生反应Ⅰ、Ⅱ,实验测得( 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度的变化如图所示。(已知:
的选择性随温度的变化如图所示。(已知: 的选择性
的选择性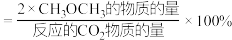 )
)
其中表示平衡时 的选择性的曲线是
的选择性的曲线是___________ (填“①”或“②”);温度高于300℃时,曲线②随温度升高而升高的原因是___________ 。
(2)对于反应Ⅱ的反应速率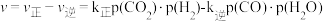 其中
其中 、
、 分别为正、逆反应速率常数,p为气体的分压(分压
分别为正、逆反应速率常数,p为气体的分压(分压 总压
总压 物质的量分数)。
物质的量分数)。
a.达到平衡后,降低温度,
___________ (填“增大”、“减小”或”不变”);
b.在一定温度和压强下的反应Ⅱ,按照n(CO2):n(H2)=6:7投料,当CO2转化率为50%时,用气体分压表示的平衡常数___________ 。
 是无色气体,可作为一种新型能源,同时也是重要的化工原料,采用
是无色气体,可作为一种新型能源,同时也是重要的化工原料,采用 催化加氢可合成二甲醚,发生的反应如下:
催化加氢可合成二甲醚,发生的反应如下:Ⅰ.


Ⅱ.

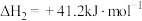
回答下列问题:
(1)在压强、
 和
和 的起始投料一定的条件下,发生反应Ⅰ、Ⅱ,实验测得(
的起始投料一定的条件下,发生反应Ⅰ、Ⅱ,实验测得( 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度的变化如图所示。(已知:
的选择性随温度的变化如图所示。(已知: 的选择性
的选择性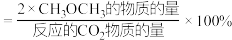 )
)
其中表示平衡时
 的选择性的曲线是
的选择性的曲线是(2)对于反应Ⅱ的反应速率
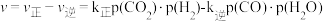 其中
其中 、
、 分别为正、逆反应速率常数,p为气体的分压(分压
分别为正、逆反应速率常数,p为气体的分压(分压 总压
总压 物质的量分数)。
物质的量分数)。a.达到平衡后,降低温度,

b.在一定温度和压强下的反应Ⅱ,按照n(CO2):n(H2)=6:7投料,当CO2转化率为50%时,用气体分压表示的平衡常数
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】某化学兴趣小组对重铬酸铵[(NH4)2Cr2O7]的部分性质及组成进行探究。已知: (橙色)+H2O
(橙色)+H2O 2
2 (黄色)+2H+。
(黄色)+2H+。
(1)在试管中加入少量(NH4)2Cr2O7固体,滴加足量的浓KOH溶液,振荡、微热,观察到的主要现象是固体溶解、___________ 、___________ 。
(2)为探究(NH4)2Cr2O7(摩尔质量252g/mol)的分解产物,按如下图连接好装置,在A中加入5.040g样品进行实验

①仪器B的名称是___________ 。
②加热A至恒重,观察到D中溶液不变色,同时测得A、B中质量变化分别为2.00g、1.44g。写出重铬酸铵热分解的化学方程式___________
③C的作用是___________ 。
 (橙色)+H2O
(橙色)+H2O 2
2 (黄色)+2H+。
(黄色)+2H+。(1)在试管中加入少量(NH4)2Cr2O7固体,滴加足量的浓KOH溶液,振荡、微热,观察到的主要现象是固体溶解、
(2)为探究(NH4)2Cr2O7(摩尔质量252g/mol)的分解产物,按如下图连接好装置,在A中加入5.040g样品进行实验

①仪器B的名称是
②加热A至恒重,观察到D中溶液不变色,同时测得A、B中质量变化分别为2.00g、1.44g。写出重铬酸铵热分解的化学方程式
③C的作用是
您最近一年使用:0次



