Cl2、ClO2、NaClO2均是强氧化剂,根据要求回答下列问题:
(1)Cl2与NaClO2溶液反应可制取ClO2和NaCl。该反应中氧化剂与还原剂物质的量之比为___ 。
(2)Cl2与ClO2均具有杀菌能力。ClO2杀菌效率是Cl2的___ 倍(已知杀菌效率是指单位质量的氧化剂得电子数目的多少,结果保留三位有效数字。)
(3)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,向NaClO2溶液中滴加盐酸,反应剧烈,若将盐酸换成等c(H+)的硫酸,开始反应缓慢,稍后一段时间产生气体迅速加快,产生这种现象可能的原因是___ 。
(4)ClO2易分解,为了运输和贮存常将其制成NaClO2固体。反应原理为2ClO2+2NaOH+H2O2=2NaClO2+2H2O+O2↑,某同学模拟工业制NaClO2,其装置如图所示:
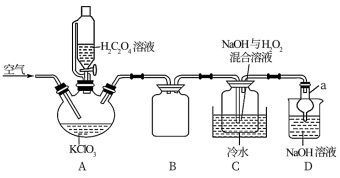
①仪器a的名称是___ ,装置B的作用是___ 。
②装置A中反应生成KHCO3和ClO2,写出该反应的化学方程式:___ 。
③已知饱和NaClO2溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,在温度高于38℃时析出的晶体是NaClO2,设计从NaClO2溶液中制取晶体NaClO2的操作:___ 。
(1)Cl2与NaClO2溶液反应可制取ClO2和NaCl。该反应中氧化剂与还原剂物质的量之比为
(2)Cl2与ClO2均具有杀菌能力。ClO2杀菌效率是Cl2的
(3)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,向NaClO2溶液中滴加盐酸,反应剧烈,若将盐酸换成等c(H+)的硫酸,开始反应缓慢,稍后一段时间产生气体迅速加快,产生这种现象可能的原因是
(4)ClO2易分解,为了运输和贮存常将其制成NaClO2固体。反应原理为2ClO2+2NaOH+H2O2=2NaClO2+2H2O+O2↑,某同学模拟工业制NaClO2,其装置如图所示:

①仪器a的名称是
②装置A中反应生成KHCO3和ClO2,写出该反应的化学方程式:
③已知饱和NaClO2溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,在温度高于38℃时析出的晶体是NaClO2,设计从NaClO2溶液中制取晶体NaClO2的操作:
更新时间:2021-01-31 15:36:53
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂,广泛用于纺织工业。其制备过程如下:
①把甲酸(HCOOH)和足量的NaOH溶液混合;
②用Na2SO3固体和某酸反应制备SO2气体;
③在一定温度下将足量的SO2气体通入①的溶液中即有保险粉生成,同时生成一种气体。
请回答下列问题:
(1)写出NaOH的电子式___________ 。
(2)制备SO2时所选用的酸,你认为下列酸中最适宜选用的是___________ 。
A.浓盐酸 B.质量分数为70%的H2SO4 C.稀硝酸 D.质量分数为10%的稀H2SO4
(3)制备保险粉的化学方程式可表示___________ 。
(4)保险粉在空气中极易因吸收氧气而发生氧化,其可能的化学方程式为
①2Na2S2O4+O2+2H2O=4NaHSO3
②Na2S2O4+O2+2H2O=NaHSO3+NaHSO4
请设计一个简单实验证明氧化时发生的是②的反应:___________ 。
(5)保险粉可以用于出去废水中的重铬酸根离子( 被转化为Cr3+),这是目前除去酸性废水中铬离子的有效方法之一,每消耗0.1 mol保险粉,理论上可以除去的
被转化为Cr3+),这是目前除去酸性废水中铬离子的有效方法之一,每消耗0.1 mol保险粉,理论上可以除去的 的物质的量为
的物质的量为___________ mol。
①把甲酸(HCOOH)和足量的NaOH溶液混合;
②用Na2SO3固体和某酸反应制备SO2气体;
③在一定温度下将足量的SO2气体通入①的溶液中即有保险粉生成,同时生成一种气体。
请回答下列问题:
(1)写出NaOH的电子式
(2)制备SO2时所选用的酸,你认为下列酸中最适宜选用的是
A.浓盐酸 B.质量分数为70%的H2SO4 C.稀硝酸 D.质量分数为10%的稀H2SO4
(3)制备保险粉的化学方程式可表示
(4)保险粉在空气中极易因吸收氧气而发生氧化,其可能的化学方程式为
①2Na2S2O4+O2+2H2O=4NaHSO3
②Na2S2O4+O2+2H2O=NaHSO3+NaHSO4
请设计一个简单实验证明氧化时发生的是②的反应:
(5)保险粉可以用于出去废水中的重铬酸根离子(
 被转化为Cr3+),这是目前除去酸性废水中铬离子的有效方法之一,每消耗0.1 mol保险粉,理论上可以除去的
被转化为Cr3+),这是目前除去酸性废水中铬离子的有效方法之一,每消耗0.1 mol保险粉,理论上可以除去的 的物质的量为
的物质的量为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】(NH4)2Fe(SO4)2·6H2O(莫尔盐,浅绿色,式量392)在定量分析中常用作标定高锰酸钾、重铬酸钾等溶液的标准物质,还用作化学试剂、医药以及用于冶金、电镀等。
回答下列问题:
(1)莫尔盐在空气中比硫酸亚铁稳定,但长期露置于空气中也会变质,检验莫尔盐是否变质的试剂是_______________。
(2)准确称取mg纯净的莫尔盐,在锥形瓶中加入20mL水充分溶解,用某酸性K2Cr2O7溶液滴定至终点。重复进行3次,测得有关数据如下:
①K2Cr2O7溶液应该放在______________式滴定管中。
②写出滴定过程中反应的离子方程式:______________;
③所测K2Cr2O7溶液的物质的量浓度为______________mol/L(用含M的代数式表示)。
(3)某课题组通过实验检验莫尔盐晶体加热时的分解产物。
①甲同学提出猜想:分解产物可能是N2、Fe2O3,SO3、H2O四种物质。你是否同意并说明理由:______________。
②乙同学设计了如图装置,其中A装置中的固体变为红棕色,则固体产物中含有______________;C装置中红色褪去,说明气体产物中含有______________;
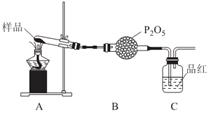
C装置后应连接尾气吸收装置D,D中盛有的试剂可以是______________(写一种即可)。
③丙同学想利用上述装置证明分解产物中含有氨气.只需更换B,C中的试剂即可,则更换后的试剂为B______________、C______________。
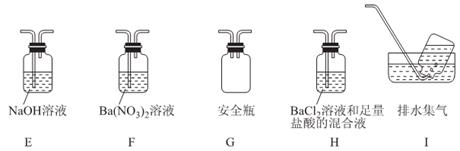
④丁同学认为莫尔盐分解可能会生成N2,SO3,拟从下列装置中选择必要的装置加以证明。则正确的连接顺序从左到右依次是A、______________。
回答下列问题:
(1)莫尔盐在空气中比硫酸亚铁稳定,但长期露置于空气中也会变质,检验莫尔盐是否变质的试剂是_______________。
(2)准确称取mg纯净的莫尔盐,在锥形瓶中加入20mL水充分溶解,用某酸性K2Cr2O7溶液滴定至终点。重复进行3次,测得有关数据如下:
| 实验序号 | 起始读数/mL | 终点读数/mL |
| I | 2.50 | 22.58 |
| Ⅱ | 1.00 | 23.12 |
| Ⅲ | 0.00 | 19.92 |
①K2Cr2O7溶液应该放在______________式滴定管中。
②写出滴定过程中反应的离子方程式:______________;
③所测K2Cr2O7溶液的物质的量浓度为______________mol/L(用含M的代数式表示)。
(3)某课题组通过实验检验莫尔盐晶体加热时的分解产物。
①甲同学提出猜想:分解产物可能是N2、Fe2O3,SO3、H2O四种物质。你是否同意并说明理由:______________。
②乙同学设计了如图装置,其中A装置中的固体变为红棕色,则固体产物中含有______________;C装置中红色褪去,说明气体产物中含有______________;

C装置后应连接尾气吸收装置D,D中盛有的试剂可以是______________(写一种即可)。
③丙同学想利用上述装置证明分解产物中含有氨气.只需更换B,C中的试剂即可,则更换后的试剂为B______________、C______________。
④丁同学认为莫尔盐分解可能会生成N2,SO3,拟从下列装置中选择必要的装置加以证明。则正确的连接顺序从左到右依次是A、______________。

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】氮元素的“价态-类别”二维图如下:

(1)上述转化过程属于固氮的是_______ (填编号)。
(2)发射卫星的运载火箭推进剂引燃后产生大量气体,含有CO2、H2O、N2、NO等,这些气体无色,但在卫星发射现场可看到火箭尾部喷出大量红色气体,写出产生红色气体的化学方程式:_______ 。
(3)已知土壤胶体粒子带负电荷,土壤中施用含氮总量相等的下列化肥,从化学式分析其中肥效最低的是_______(肥效高低取决于相关元素是否不易或易流失)。
(4)水合肼(N2H4∙H2O)溶液显弱碱性,其电离与NH3∙H2O相似,写出水合肼的电离方程式_______ 。
(5)在燃油汽车尾气排放装置里,气体在催化剂表面吸附与解吸作用的过程如下图所示:

根据图示,写出催化转化的总化学方程式,并标注电子转移的方向和数目:_______ 。
(6)NOx代表由NO2和NO组成的混合气体,现有等体积的NOx和NH3恰好完全反应生成无害气体,该无害气体是_______ ,根据上述条件推算出NOx中的x=_______ 。
取25.6克铜与100毫升63%的浓硝酸(ρ=1.45g/mL)反应,当铜完全溶解后,产生的NO和NO2混合气体折算到标准状况下的体积为11.2升。
(7)工业生产中为了盛装大量浓硝酸,常选择_______作为罐体材料。
(8)该浓硝酸的物质的量浓度是_______  。
。
(9)用上述浓硝酸配制100mL1.00mol/L稀硝酸,以下操作可能会导致所配溶液浓度偏低的是_______ 。
A.配制过程中烧杯和玻璃棒未洗涤
B.配制前容量瓶未干燥
C.摇匀后液面低于刻度线
D.定容时俯视液面
E.量取浓硝酸时操作很慢
F.稀释后未冷到室温就转移和定容
(10)上述反应过程中,当硝酸的浓度降到_______ mol/L时,开始生成NO气体。(假设反应过程中溶液体积保持100mL且不考虑溶质挥发)(要求写出求解过程,只有结果不得分)

(1)上述转化过程属于固氮的是
(2)发射卫星的运载火箭推进剂引燃后产生大量气体,含有CO2、H2O、N2、NO等,这些气体无色,但在卫星发射现场可看到火箭尾部喷出大量红色气体,写出产生红色气体的化学方程式:
(3)已知土壤胶体粒子带负电荷,土壤中施用含氮总量相等的下列化肥,从化学式分析其中肥效最低的是_______(肥效高低取决于相关元素是否不易或易流失)。
| A.(NH4)2SO4 | B.NH4Cl | C.NaNO3 | D.NH4NO3 |
(5)在燃油汽车尾气排放装置里,气体在催化剂表面吸附与解吸作用的过程如下图所示:

根据图示,写出催化转化的总化学方程式,并标注电子转移的方向和数目:
(6)NOx代表由NO2和NO组成的混合气体,现有等体积的NOx和NH3恰好完全反应生成无害气体,该无害气体是
取25.6克铜与100毫升63%的浓硝酸(ρ=1.45g/mL)反应,当铜完全溶解后,产生的NO和NO2混合气体折算到标准状况下的体积为11.2升。
(7)工业生产中为了盛装大量浓硝酸,常选择_______作为罐体材料。
| A.铜 | B.铂 | C.铝 | D.镁 |
 。
。(9)用上述浓硝酸配制100mL1.00mol/L稀硝酸,以下操作可能会导致所配溶液浓度偏低的是
A.配制过程中烧杯和玻璃棒未洗涤
B.配制前容量瓶未干燥
C.摇匀后液面低于刻度线
D.定容时俯视液面
E.量取浓硝酸时操作很慢
F.稀释后未冷到室温就转移和定容
(10)上述反应过程中,当硝酸的浓度降到
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】Pb位于元素周期表第六周期第IVA族,其化合物广泛运用于电池工业、机械制造、特殊玻璃等。某化工厂原以生产PbCO3、PbS为主。现利用废弃铅料,主要成分为PbO2和PbO(PbO溶于稀硝酸),含少量Fe2O3,联合生产三盐基硫酸铅(3PbO·PbSO4·H2O,其相对分子质量为990)和PbO2,设计路线如下:

回答下列问题:
(1)加稀硝酸溶液之前,将废弃铅料在球磨机中磨成粉末,目的是___________
(2)加CS2的目的是溶解固体中的___________ (填化学式),加PbS发生的化学反应方程式为___________
(3)滤液加PbCO3的作用是___________ ,有人提出达到预期的pH后,应小火煮沸一段时间,再过滤,这样做的目的是___________
(4)制备三盐基硫酸铅时,将n(PbSO4):n(NaOH)=4:6配比制成浆糊状,在室温下搅拌60min制得,其产品纯度的影响因素很多,其中反应终点pH对产品中PbO和SO3含量的影响如下图(将PbSO4看作是PbO和SO3,经测定三盐基硫酸铅中PbO理论含量90.10%、SO3理论含量8.08%):

则反应终点控制pH的范围是___________(填序号)。
(5)PbO转化为PbO2发生的离子反应方程式为___________
(6)若akg废料最终制备得到bkg三盐基硫酸铅和ckgPbO2,假设加入的PbCO3刚好抵消流程中损耗的铅元素,则原废料中铅元素的含量为___________ (用含a、b、c的代数式表示)。

回答下列问题:
(1)加稀硝酸溶液之前,将废弃铅料在球磨机中磨成粉末,目的是
(2)加CS2的目的是溶解固体中的
(3)滤液加PbCO3的作用是
(4)制备三盐基硫酸铅时,将n(PbSO4):n(NaOH)=4:6配比制成浆糊状,在室温下搅拌60min制得,其产品纯度的影响因素很多,其中反应终点pH对产品中PbO和SO3含量的影响如下图(将PbSO4看作是PbO和SO3,经测定三盐基硫酸铅中PbO理论含量90.10%、SO3理论含量8.08%):

则反应终点控制pH的范围是___________(填序号)。
| A.<8.4 | B.8.4~8.8 | C.8.8~9.2 | D.>9.2 |
(6)若akg废料最终制备得到bkg三盐基硫酸铅和ckgPbO2,假设加入的PbCO3刚好抵消流程中损耗的铅元素,则原废料中铅元素的含量为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和 ,制备装置如下图所示:
,制备装置如下图所示:

为制备纯净干燥的气体,下表中缺少的药品是:
(2)乙组同学利用甲组制得的NO和 制备NOCl,装置如图所示:
制备NOCl,装置如图所示:

①装置连接顺序为a→_______ (按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、 外,另一个作用是
外,另一个作用是_______ 。
③装置Ⅶ的作用是_______ 。
④装置Ⅷ的作用是_______ 。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为_______ 。
(1)甲组的同学拟制备原料气NO和
 ,制备装置如下图所示:
,制备装置如下图所示:
为制备纯净干燥的气体,下表中缺少的药品是:
| 装置Ⅰ | 装置Ⅱ | ||
| 烧瓶中 | 分液漏斗中 | ||
制备纯净 |  | ||
| 制备纯净NO | Cu | ||
 制备NOCl,装置如图所示:
制备NOCl,装置如图所示:
①装置连接顺序为a→
②装置Ⅳ、Ⅴ除可进一步干燥NO、
 外,另一个作用是
外,另一个作用是③装置Ⅶ的作用是
④装置Ⅷ的作用是
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】碱式碳酸铜可用作有机催化剂。工业上以辉铜矿(主要成分为 ,含
,含 及少量
及少量 )为原料制备碱式碳酸铜,工业流程如图:
)为原料制备碱式碳酸铜,工业流程如图:

回答下列问题:
(1)滤渣可能含S、_______ (填化学式)。
(2)①“浸取”时能提高辉铜矿 浸取率的措施有
浸取率的措施有_______ (任填一条)。
②某小组测得 浸取率随
浸取率随 浓度及温度影响的变化曲线如图:
浓度及温度影响的变化曲线如图:

由图1可知 适宜的浓度范围为
适宜的浓度范围为_______ ;浸取时 也起到了氧化辉铜矿的作用,证据可由图1中的点
也起到了氧化辉铜矿的作用,证据可由图1中的点_______ (填字母序号)分析,该反应的离子方程式为_______ ;图2中高于 时
时 浸取率下降的原因是
浸取率下降的原因是_______ 。
(3)“除铁”步骤调pH最好加入的试剂_______ (填选项字母);
a.氨水 b. c.
c. d.
d.
常温下,“过滤”后的滤液中 ,则“除铁”步骤调pH应小于
,则“除铁”步骤调pH应小于_______ [常温下 ]。
]。
 ,含
,含 及少量
及少量 )为原料制备碱式碳酸铜,工业流程如图:
)为原料制备碱式碳酸铜,工业流程如图:
回答下列问题:
(1)滤渣可能含S、
(2)①“浸取”时能提高辉铜矿
 浸取率的措施有
浸取率的措施有②某小组测得
 浸取率随
浸取率随 浓度及温度影响的变化曲线如图:
浓度及温度影响的变化曲线如图:
由图1可知
 适宜的浓度范围为
适宜的浓度范围为 也起到了氧化辉铜矿的作用,证据可由图1中的点
也起到了氧化辉铜矿的作用,证据可由图1中的点 时
时 浸取率下降的原因是
浸取率下降的原因是(3)“除铁”步骤调pH最好加入的试剂
a.氨水 b.
 c.
c. d.
d.
常温下,“过滤”后的滤液中
 ,则“除铁”步骤调pH应小于
,则“除铁”步骤调pH应小于 ]。
]。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】Ⅰ.利用纯净干燥的氯气和铜粉反应制备氯化铜。装置如图1所示,将分液漏斗中浓盐酸滴加到盛有固体二氧化锰的烧瓶A中,微热后产生的气体依次通过装置B和装置C,然后再通过加热的石英玻璃D(玻璃管中预先放置铜粉)和球形干燥管E,试回答:
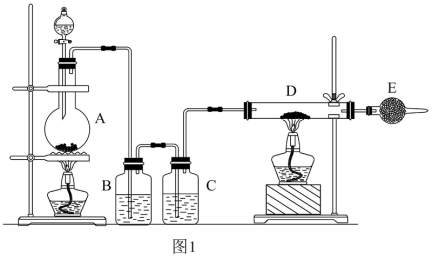
(1)烧瓶A中发生的化学反应方程式(若是离子反应写出离子反应方程式):___ 。
(2)装置B中盛装的溶液为__ ;其作用是__ 。装置C中盛装的溶液为__ ;其作用是__ 。
(3)玻璃管D中发生反应的化学方程式是__ 。
(4)干燥管E中盛装的药品为__ ;其作用是__ 。
Ⅱ.甲、乙两位同学为探究Cl2是否有漂白性。在C装置后连接如图2装置。

(5)通入Cl2一段时间后,观察到F中布条___ 填“褪色”或“不褪色”),G中布条___ (填“褪色”或“不褪色”)。说明干燥的Cl2___ (填“有”或“无”)漂白性。
(6)甲同学查阅教材,得出结论:___ 有漂白性;乙同学认为甲的说法不严密。请你分析乙同学认为不严密的原因___ 。为了使该实验更加严密,请设计出你的实验方案___ 。

(1)烧瓶A中发生的化学反应方程式(若是离子反应写出离子反应方程式):
(2)装置B中盛装的溶液为
(3)玻璃管D中发生反应的化学方程式是
(4)干燥管E中盛装的药品为
Ⅱ.甲、乙两位同学为探究Cl2是否有漂白性。在C装置后连接如图2装置。

(5)通入Cl2一段时间后,观察到F中布条
(6)甲同学查阅教材,得出结论:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】某校化学兴趣小组为研究 的性质,设计如图所示装置进行实验。装置D中夹持装置已略去,其中a为干燥的红色布条,b为湿润的红色布条。回答下列问题:
的性质,设计如图所示装置进行实验。装置D中夹持装置已略去,其中a为干燥的红色布条,b为湿润的红色布条。回答下列问题:
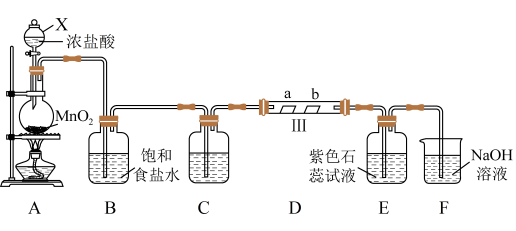
(1)写出装置A中发生反应的化学方程式:_______ 。
(2)装置C的作用是_______ ,可选用的试剂是_______ (填字母)。
a. 溶液 b.NaOH溶液 c.碱石灰 d.浓硫酸
溶液 b.NaOH溶液 c.碱石灰 d.浓硫酸
(3)装置D中的实验现象为_______ 。
(4)若产生 足量,实验过程中装置E中的实验现象是
足量,实验过程中装置E中的实验现象是_______ 。
(5)有一种“地康法”制取氯气的反应原理如图所示:

①反应I_______ (填“是”或“不是”)氧化还原反应。
②在450℃条件下,反应II的化学方程式为_______ ,每转移2 mol ,产生标准状况下
,产生标准状况下_______ L  。
。
 的性质,设计如图所示装置进行实验。装置D中夹持装置已略去,其中a为干燥的红色布条,b为湿润的红色布条。回答下列问题:
的性质,设计如图所示装置进行实验。装置D中夹持装置已略去,其中a为干燥的红色布条,b为湿润的红色布条。回答下列问题:
(1)写出装置A中发生反应的化学方程式:
(2)装置C的作用是
a.
 溶液 b.NaOH溶液 c.碱石灰 d.浓硫酸
溶液 b.NaOH溶液 c.碱石灰 d.浓硫酸(3)装置D中的实验现象为
(4)若产生
 足量,实验过程中装置E中的实验现象是
足量,实验过程中装置E中的实验现象是(5)有一种“地康法”制取氯气的反应原理如图所示:

①反应I
②在450℃条件下,反应II的化学方程式为
 ,产生标准状况下
,产生标准状况下 。
。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】课外活动小组欲制取次氯酸钠和氯化钠的混合溶液,为提高次氯酸钠的含量,用如图所示装置。图中瓶乙盛饱和食盐水,瓶丙盛放浓硫酸,分液漏斗A中盛浓盐酸。(据资料显示:Cl2与NaOH在不同温度下,产物不同。在较高温度下易生成NaClO3)

试回答:
(1)烧瓶B中盛___ 固体,试管C中盛___ 溶液。
(2)有同学认为可以省去某些装置,你认为怎样:
①能否省去乙装置___ (填“能”或“不能”),理由是___ 。
②装置丙是否有必要___ (填“有”或“没有”),理由是___ 。
(3)有同学认为还必须加入某些装置,你认为怎样?___ (填“需要”或“不需要”),如果你认为需要,请指出该装置的作用____ 。
(4)丁装置中冰水的作用是___ 。

试回答:
(1)烧瓶B中盛
(2)有同学认为可以省去某些装置,你认为怎样:
①能否省去乙装置
②装置丙是否有必要
(3)有同学认为还必须加入某些装置,你认为怎样?
(4)丁装置中冰水的作用是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】ClO2和NaClO2都是良好的漂白杀菌剂,ClO2不易运输和储存,而NaClO2则比较稳定。实验室模拟制备NaClO2分为两步,第一步是在酸性介质中还原氯酸钠,产生ClO2气体;第二步是在还原剂作用下,用烧碱溶液吸收ClO2气体制得NaClO2,实验装置如图所示:

(1)NaClO2中Cl的化合价为___________ 。
(2)A装置为ClO2的发生装置,该反应产物之一为NaHSO4,写出A装置中发生反应的化学方程式___________ 。
(3)B装置的作用是检验ClO2气体中是否含有SO2,不能盛放品红溶液的理由是___________ ,B中试剂为___________ (填字母序号)。
A.氢硫酸溶液 B.BaCl2溶液 C.Ba(NO3)2溶液 D.滴有酚酞的NaOH溶液
(4)C装置三颈烧瓶中盛放的试剂为30%的H2O2溶液和210 g/L的NaOH溶液,C装置中的离子方程式为___________ ,C装置反应温度控制在35℃以下,请分析温度不能过高的原因___________ 。
(5)从C装置中通过蒸发浓缩、冷却结晶、过滤干燥得到NaClO2•3H2O a kg,理论上需要通入含SO2 5%的空气的体积(折算成标准状况下)为___________ L(写出表达式)。

(1)NaClO2中Cl的化合价为
(2)A装置为ClO2的发生装置,该反应产物之一为NaHSO4,写出A装置中发生反应的化学方程式
(3)B装置的作用是检验ClO2气体中是否含有SO2,不能盛放品红溶液的理由是
A.氢硫酸溶液 B.BaCl2溶液 C.Ba(NO3)2溶液 D.滴有酚酞的NaOH溶液
(4)C装置三颈烧瓶中盛放的试剂为30%的H2O2溶液和210 g/L的NaOH溶液,C装置中的离子方程式为
(5)从C装置中通过蒸发浓缩、冷却结晶、过滤干燥得到NaClO2•3H2O a kg,理论上需要通入含SO2 5%的空气的体积(折算成标准状况下)为
您最近一年使用:0次
【推荐2】电子工业常用FeCl3溶液腐蚀印刷电路板上不需要的铜箔,最后得到含FeCl3、FeCl2杂质的CuCl2溶液。某化学兴趣小组设计下列方案,从该废液中 除去FeCl3、FeCl2杂质,制取纯净的CuCl2。
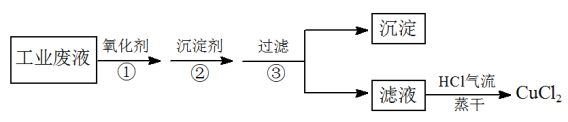
请回答下列问题:
(1)在①步操作中使用了氧化剂,下列氧化剂中一定不能使用的是_______ 。
A.Cl2 B.NaClO C.H2O2 D.KMnO4 E.O3
(2)②步操作中的“沉淀剂”可以是下列中的_______ 。
A.NaOH B.NH3·H2O C.CuO D.Cu2(OH)2CO3 E.Fe2O3
用一种你选择的沉淀剂,分步写出除去杂质的离子方程式:_______ 。
(3)最后将滤液在HCl气流中蒸干,其目的是_______ ,如果将滤液直接加热蒸干,最后得到的固体可能是_______ 。
(4)设常温下各沉淀的溶度积近似为:Ksp[Cu(OH)2]=10-20、Ksp[Fe(OH)3]=10-38、Ksp[Fe(OH)2]=10-16;通常,人们把浓度小于10-5mol/L的离子视为“不存在”。根据所给条件,完成下列问题:
①如果该废液中CuCl2的浓度为1 mol/L,在加沉淀剂时应调节溶液的pH值范围为:_______ 。
②如果对废液不先用氧化剂,而是直接加入沉淀剂,带来的后果是:_______ 。

请回答下列问题:
(1)在①步操作中使用了氧化剂,下列氧化剂中一定不能使用的是
A.Cl2 B.NaClO C.H2O2 D.KMnO4 E.O3
(2)②步操作中的“沉淀剂”可以是下列中的
A.NaOH B.NH3·H2O C.CuO D.Cu2(OH)2CO3 E.Fe2O3
用一种你选择的沉淀剂,分步写出除去杂质的离子方程式:
(3)最后将滤液在HCl气流中蒸干,其目的是
(4)设常温下各沉淀的溶度积近似为:Ksp[Cu(OH)2]=10-20、Ksp[Fe(OH)3]=10-38、Ksp[Fe(OH)2]=10-16;通常,人们把浓度小于10-5mol/L的离子视为“不存在”。根据所给条件,完成下列问题:
①如果该废液中CuCl2的浓度为1 mol/L,在加沉淀剂时应调节溶液的pH值范围为:
②如果对废液不先用氧化剂,而是直接加入沉淀剂,带来的后果是:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】焦亚硫酸钠(Na2S2O5)是的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3 + SO2 = Na2S2O5。

⑴ 装置Ⅰ中产生气体的化学方程式为________________________________ ;
⑵ 上图中盛装浓硫酸的玻璃仪器的名称是:__________________________ ;
⑶ 装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为_________ (填序号)。

实验二 焦亚硫酸钠的性质(Na2S2O5溶于水即生成NaHSO3)
⑷ 证明NaHSO3溶液中HSO 的电离程度大于水解程度,可采用的实验方法是
的电离程度大于水解程度,可采用的实验方法是___________ (填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
实验三 葡萄酒中抗氧化剂残留量的测定
⑸ 葡萄酒常用Na2S2O5作抗氧化剂。测定葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:(滴定时反应为SO2 + I2 + 2H2O = H2SO4 + 2HI)

①上述滴定过程中的终点现象为______________________________________ ;
②按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为____________ g·L-1。
实验一 焦亚硫酸钠的制取
采用如图装置(实验前除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3 + SO2 = Na2S2O5。

⑴ 装置Ⅰ中产生气体的化学方程式为
⑵ 上图中盛装浓硫酸的玻璃仪器的名称是:
⑶ 装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为

实验二 焦亚硫酸钠的性质(Na2S2O5溶于水即生成NaHSO3)
⑷ 证明NaHSO3溶液中HSO
 的电离程度大于水解程度,可采用的实验方法是
的电离程度大于水解程度,可采用的实验方法是a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
实验三 葡萄酒中抗氧化剂残留量的测定
⑸ 葡萄酒常用Na2S2O5作抗氧化剂。测定葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:(滴定时反应为SO2 + I2 + 2H2O = H2SO4 + 2HI)

①上述滴定过程中的终点现象为
②按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为
您最近一年使用:0次



