已知常温下:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12,下列叙述正确的是
| A.AgCl在饱和NaCl溶液中的Ksp比在纯水中的小 |
| B.向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl)<Ksp(AgBr) |
| C.向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动 |
| D.将0.001 mol·L-1AgNO3溶液分别滴入0.001 mol·L-1的KCl和0.001 mol·L-1的K2CrO4溶液中先产生Ag2CrO4沉淀 |
20-21高二下·广西钦州·阶段练习 查看更多[2]
广西钦州市第四中学2020-2021学年高二下学期4月月试化学试题(已下线)第21讲 难溶电解质的沉淀溶解平衡(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)
更新时间:2021-05-03 14:54:48
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】下列说法中不正确的是
| A.等浓度的小苏打溶液与烧碱溶液等体积混合:c(Na+)+c(H+)=2c(CO32-)+c(OH-) +c(HCO3-) |
| B.pH相同的盐酸和醋酸,分别用蒸馏水稀释至原体积的m倍和n倍稀释后两溶液pH 相等,则m>n |
| C.常温下,0.1mol/L某一元酸HA在水中有0.1%发生电离,则该温度下HA的电离常数为10-7 |
D.某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图。由图可知:Ksp[Fe(OH)3]2] |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】已知:向难溶电解质饱和溶液中加入与该电解质没有相同离子的强电解质时,使难溶物溶解度增大的效应称为盐效应。常温下,在含大量BaSO4固体的浊液中加入0.01mol下列物质(忽略体积变化),溶液中c(Ba2+)由大到小的排序正确的是
①BaSO4 ②Na2SO4 ③KNO3
①BaSO4 ②Na2SO4 ③KNO3
| A.②①③ | B.③②① | C.③①② | D.①③② |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】 分别表示酸的电离常数、水的离子积常数、溶度积常数,下列判断正确的是
分别表示酸的电离常数、水的离子积常数、溶度积常数,下列判断正确的是
 分别表示酸的电离常数、水的离子积常数、溶度积常数,下列判断正确的是
分别表示酸的电离常数、水的离子积常数、溶度积常数,下列判断正确的是A.室温下向 的醋酸溶液中加入水稀释后,溶液中 的醋酸溶液中加入水稀释后,溶液中 不变 不变 |
B.室温下 ,说明 ,说明 的电离度一定比 的电离度一定比 的大 的大 |
C. 时, 时, 均为4的盐酸和 均为4的盐酸和 溶液中 溶液中 不相等 不相等 |
D.两种难溶电解质做比较时, 越小的电解质,其溶解度一定越小 越小的电解质,其溶解度一定越小 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】已知锌及其化合物的性质与铝及其化合物的性质相似。常温下溶液pH与 或
或 的物质的量浓度的对数的关系如图所示,下列说法正确的是
的物质的量浓度的对数的关系如图所示,下列说法正确的是
已知:常温下,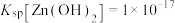 。
。

 或
或 的物质的量浓度的对数的关系如图所示,下列说法正确的是
的物质的量浓度的对数的关系如图所示,下列说法正确的是已知:常温下,
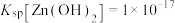 。
。
A.常温下, |
B.a点溶液中,存在反应 |
C.往b点溶液中通入过量的 ,发生反应的离子方程式为 ,发生反应的离子方程式为 |
D. 固体不导电,故其为非电解质 固体不导电,故其为非电解质 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐3】室温下,已知Ksp(CuS)=8.8×10-36,饱和Cu(OH)2溶液中x=—lg 与pH的关系如下图所示。向0.1 mol·L-1的Na2S溶液(pH=12.4)中加入一定量的CuSO4晶体。下列说法正确的是
与pH的关系如下图所示。向0.1 mol·L-1的Na2S溶液(pH=12.4)中加入一定量的CuSO4晶体。下列说法正确的是

 与pH的关系如下图所示。向0.1 mol·L-1的Na2S溶液(pH=12.4)中加入一定量的CuSO4晶体。下列说法正确的是
与pH的关系如下图所示。向0.1 mol·L-1的Na2S溶液(pH=12.4)中加入一定量的CuSO4晶体。下列说法正确的是
| A.室温下Ksp[Cu(OH)2]=2.2 × 10-18 |
| B.加入CuSO4晶体时,先生成Cu(OH)2沉淀 |
| C.室温下,CuS在等浓度的Na2S和H2S溶液中的Ksp相等 |
D.反应后的溶液中存在离子浓度关系: c(Na+)+ c (H+)+ c (Cu2+ )= c (S2—)+c(HS—)+ c (OH— )+ c (SO ) ) |
您最近一年使用:0次
【推荐1】粉煤灰的主要成分为SiO2、Al2O3、FeO、Fe2O3、MgO、TiO2等,研究小组对其进行综合处理的流程如图:

已知:
①“酸浸”后钛主要以TiOSO4形式存在,在溶液中完全电离出SO 和一种可水解的阳离子。
和一种可水解的阳离子。
②当离子浓度小于等于1.0×10-5 mol·L-1时,可认为其已沉淀完全。
③Ksp[Al(OH)3]=1.0×10-34、Ksp[Fe(OH)3]=4.0×10-38。
下列说法错误的是

已知:
①“酸浸”后钛主要以TiOSO4形式存在,在溶液中完全电离出SO
 和一种可水解的阳离子。
和一种可水解的阳离子。②当离子浓度小于等于1.0×10-5 mol·L-1时,可认为其已沉淀完全。
③Ksp[Al(OH)3]=1.0×10-34、Ksp[Fe(OH)3]=4.0×10-38。
下列说法错误的是
| A.“酸浸”时TiO2发生反应的离子方程式为TiO2+2H+=TiO2++H2O |
| B.“结晶”时应控制适宜温度,温度过高TiO2·xH2O产率降低 |
| C.“调pH”时温度越高,氧化速率越快 |
| D.为使“滤液2”中杂质离子沉淀完全,pH的理论最小值为4.3 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】难溶盐MgF2可溶于盐酸,常温下,用HCl气体调节MgF2浊液的pH,测得体系中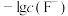 或
或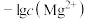 随
随 的变化如图所示。下列说法不正确的是
的变化如图所示。下列说法不正确的是

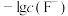 或
或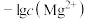 随
随 的变化如图所示。下列说法不正确的是
的变化如图所示。下列说法不正确的是
A.曲线M代表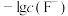 随 随 的变化趋势 的变化趋势 |
B.Y点溶液中存在 |
C.氢氟酸的 |
D.难溶盐 的 的 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】室温下,通过下列实验探究NaHSO3溶液和Na2SO3溶液的性质
下列有关说法正确的是。
| 实验 | 实验操作和现象 |
| 1 | 用pH试纸测定0.1  NaHSO3溶液的pH,测得约为5 NaHSO3溶液的pH,测得约为5 |
| 2 | 浓度均为0.01  NaHSO3和Ba(OH)2等体积混合,产生白色沉淀 NaHSO3和Ba(OH)2等体积混合,产生白色沉淀 |
| 3 | 向0.1  Na2SO3溶液中滴加几滴酸性KMnO4溶液,振荡,溶液仍为无色 Na2SO3溶液中滴加几滴酸性KMnO4溶液,振荡,溶液仍为无色 |
| 4 | 向0.1  Na2SO3溶液中加入几滴0.1 Na2SO3溶液中加入几滴0.1  氯水,溶液仍为无色 氯水,溶液仍为无色 |
A.0.1 NaHSO3溶液中存在 NaHSO3溶液中存在 |
B.依据实验2,不能得出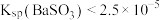 的结论 的结论 |
C.实验3中反应的离子方程式为 |
| D.实验4说明Na2SO3溶液具有漂白性 |
您最近一年使用:0次



