工业上制取硝酸铵的流程图如图,请回答下列问题:_______ 。
(2)在合成硝酸的吸收塔中通入空气的目的是:_______ 。
(3)在合成氨的设备(合成塔)中,设置热交换器的目的是:_______ 。
(4)生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理:
碱液吸收法:NO+NO2+2NaOH=2NaNO2+H2O
NH3还原法:NH3+NO2=N2+H2O
①配平NH3还原法的化学方程式_______ 。
②以上两种方法中,符合绿色化学的是_______ 。
③某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗NH3质量(不考虑其它损耗)的百分比含量:_______ 。

(2)在合成硝酸的吸收塔中通入空气的目的是:
(3)在合成氨的设备(合成塔)中,设置热交换器的目的是:
(4)生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理:
碱液吸收法:NO+NO2+2NaOH=2NaNO2+H2O
NH3还原法:NH3+NO2=N2+H2O
①配平NH3还原法的化学方程式
②以上两种方法中,符合绿色化学的是
③某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗NH3质量(不考虑其它损耗)的百分比含量:
更新时间:2021-05-10 18:38:01
|
相似题推荐
【推荐1】锂和铍是重要的稀有金属,被国内外视为战略性资源。一种从尾矿(主要含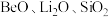 及
及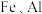 元素)中回收锂、铍、铝的工艺流程如图:
元素)中回收锂、铍、铝的工艺流程如图:
(1)“浸渣”中主要成分的晶体类型为_____ 。
(2)“沉铁”中生成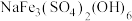 沉淀,其中
沉淀,其中 元素的化合价为
元素的化合价为_____ ,该反应的离子方程式为_____ 。
(3)“萃取”时,以 为萃取剂、
为萃取剂、 为协萃剂,溶液中的
为协萃剂,溶液中的 可与
可与 结合成
结合成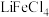 而被
而被 萃取。“反萃取”时,加入浓盐酸,发生
萃取。“反萃取”时,加入浓盐酸,发生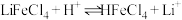 。
。
①“萃取”时还需要加入 ,其作用是
,其作用是_____ 。
②取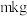 尾矿(其中
尾矿(其中 的质量分数为
的质量分数为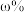 ),“反萃取”后所得
),“反萃取”后所得 水相中
水相中 ,则该过程
,则该过程 的回收率为
的回收率为_____ (用含相关物理量字母的代数式表示)。
(4)实验室提纯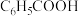 的方法是
的方法是_____ 。
(5)为了得到较高的空间利用率,离子晶体中的阴离子(通常半径较大)会尽可能紧密堆积,阳离子(通常半径较小)填入阴离子形成的空隙中,这种模型称为离子晶体的“堆积-填隙模型”。
已知常见的 型离子晶体的离子半径比和配位数的关系如下表:
型离子晶体的离子半径比和配位数的关系如下表:
表中离子半径比的临界值是由“堆积—填隙模型”中阴阳离子的几何关系确定的,例如配位数为8时,阳离子进入阴离子形成的正方体空隙,正方体8个顶点处的阴离了相切,空隙处(正方体体心)的阳离子与8个阴离子也相切,此时可由相关几何关系求得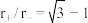 。
。
①
_____ 。
② 晶胞为立方
晶胞为立方 型,而
型,而 等的晶胞为
等的晶胞为 型。请结合上表,解释出现此结果的原因:
型。请结合上表,解释出现此结果的原因:_____ 。
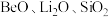 及
及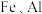 元素)中回收锂、铍、铝的工艺流程如图:
元素)中回收锂、铍、铝的工艺流程如图: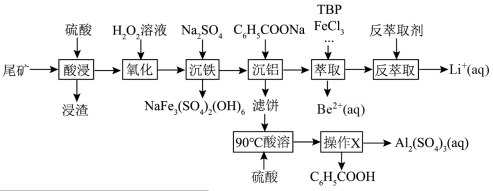
(1)“浸渣”中主要成分的晶体类型为
(2)“沉铁”中生成
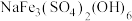 沉淀,其中
沉淀,其中 元素的化合价为
元素的化合价为(3)“萃取”时,以
 为萃取剂、
为萃取剂、 为协萃剂,溶液中的
为协萃剂,溶液中的 可与
可与 结合成
结合成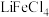 而被
而被 萃取。“反萃取”时,加入浓盐酸,发生
萃取。“反萃取”时,加入浓盐酸,发生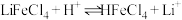 。
。①“萃取”时还需要加入
 ,其作用是
,其作用是②取
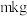 尾矿(其中
尾矿(其中 的质量分数为
的质量分数为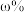 ),“反萃取”后所得
),“反萃取”后所得 水相中
水相中 ,则该过程
,则该过程 的回收率为
的回收率为(4)实验室提纯
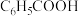 的方法是
的方法是(5)为了得到较高的空间利用率,离子晶体中的阴离子(通常半径较大)会尽可能紧密堆积,阳离子(通常半径较小)填入阴离子形成的空隙中,这种模型称为离子晶体的“堆积-填隙模型”。
已知常见的
 型离子晶体的离子半径比和配位数的关系如下表:
型离子晶体的离子半径比和配位数的关系如下表: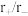 | 配位数 | 晶胞类型 |
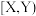 | 4 | 立方 |
 | 6 |  |
 | 8 |  |
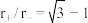 。
。①

②
 晶胞为立方
晶胞为立方 型,而
型,而 等的晶胞为
等的晶胞为 型。请结合上表,解释出现此结果的原因:
型。请结合上表,解释出现此结果的原因:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】硫化锂(Li2S)广泛地应用于电池行业中。实验室可用多种方法制备Li2S。回答下列问题:
(1)以碳酸锂粉末与H2S在600~700℃条件下制备Li2S,实验装置如图所示(夹持仪器已省略):
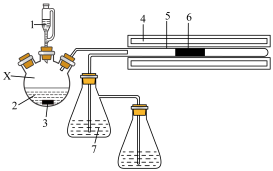
1.H3PO4溶液 2.Na2S溶液 3.磁子 4.加热炉 5.反应管 6.石墨舟 7.NaOH溶液
①仪器X的名称为_______ ,写出X中发生反应的离子方程式:_______ [已知Ka1(H3PO4)>Ka1(H2S)>Ka2(H3PO4)]。
②能否用稀硝酸代替H3PO4溶液?_______ (填“能”或“不能”),简述理由:_______ (语言叙述)。
③石墨舟中反应生成Li2S的化学方程式为_______ 。
(2)研究表明,高温下,Li2SO4与焦炭反应也可以制备Li2S。有同学认为气体产物中可能含有CO2、CO及SO2,为验证气体成分,选用下图所示的部分装置(可以重复选用)进行实验。
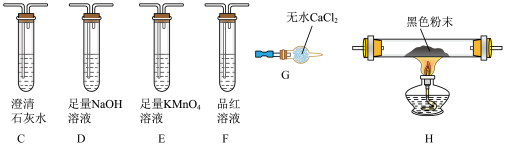
①实验装置连接的合理顺序为气体产物→_______ →G→H→C。
②若F中品红未褪色,H中黑色粉末变为红色,G前的C中澄清石灰水不变浑浊,H后的C中澄清石灰水变浑浊,则Li2SO4与焦炭反应的化学方程式为_______ 。
(1)以碳酸锂粉末与H2S在600~700℃条件下制备Li2S,实验装置如图所示(夹持仪器已省略):

1.H3PO4溶液 2.Na2S溶液 3.磁子 4.加热炉 5.反应管 6.石墨舟 7.NaOH溶液
①仪器X的名称为
②能否用稀硝酸代替H3PO4溶液?
③石墨舟中反应生成Li2S的化学方程式为
(2)研究表明,高温下,Li2SO4与焦炭反应也可以制备Li2S。有同学认为气体产物中可能含有CO2、CO及SO2,为验证气体成分,选用下图所示的部分装置(可以重复选用)进行实验。

①实验装置连接的合理顺序为气体产物→
②若F中品红未褪色,H中黑色粉末变为红色,G前的C中澄清石灰水不变浑浊,H后的C中澄清石灰水变浑浊,则Li2SO4与焦炭反应的化学方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐3】原子序数依次增大的短周期主族元素X、Y、Z、W、R,其中X、Y两种元素的核电荷数之差等于它们的原子最外层电子数之和;Y、Z位于相邻主族;Z是地壳中含量最高的元素。X、W是同主族元素。上述五种元素两两间能形成四种常见的化合物甲、乙、丙、丁,这四种化合物中原子个数比如下表:
(1)写出下列元素符号:Y:___ ;W:___ ;R:___ 。
(2)写出下列化合物的电子式:乙:___ ;丙:___ 。
(3)向甲的水溶液中加入丁,有淡黄色沉淀生成,请写出反应的化学方程式为:___ 。
(4)甲和乙反应能放出大量的热,同时生成两种无污染的物质, 请写出该反应的化学方程式::___ 。
| 甲 | 乙 | 丙 | 丁 | |
| 化合物中元素原子个数比 | X∶Z=1∶1 | Y∶X=1∶2 | W∶Z=1∶1 | W∶R=2∶1 |
(1)写出下列元素符号:Y:
(2)写出下列化合物的电子式:乙:
(3)向甲的水溶液中加入丁,有淡黄色沉淀生成,请写出反应的化学方程式为:
(4)甲和乙反应能放出大量的热,同时生成两种无污染的物质, 请写出该反应的化学方程式::
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】某校课外活动小组为了探究铜与稀硝酸反应产生的是NO气体,设计了如下实验。实验装置如图所示:

(1)装置A中生成CO2的作用是___________ ,证明该实验目的达到的现象是___________ 。
(2)观察到(1)中的现象后,关闭K,将装置B中铜丝插入稀硝酸,并微热之,观察到装置B中的现象是___________ ;B中反应的离子方程式是___________ 。
(3)装置E和F的作用是___________ ;为实现此目的,需推动注射器,将F中空气通入E中,可观察到的现象是___________ 。
(4)D装置的作用是___________ (答两点)。
(5)用氨可将氮氧化物转化为无毒气体。如4NH3+6NO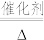 5N2+6H2O,写出氨气转化NO2的化学方程式:
5N2+6H2O,写出氨气转化NO2的化学方程式:__________________ ,该反应中氧化产物与还原产物的质量之比为_________________ 。

(1)装置A中生成CO2的作用是
(2)观察到(1)中的现象后,关闭K,将装置B中铜丝插入稀硝酸,并微热之,观察到装置B中的现象是
(3)装置E和F的作用是
(4)D装置的作用是
(5)用氨可将氮氧化物转化为无毒气体。如4NH3+6NO
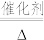 5N2+6H2O,写出氨气转化NO2的化学方程式:
5N2+6H2O,写出氨气转化NO2的化学方程式:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】研究含氮元素物质的反应对生产、生活、科研等方面都具有重要的意义。
(1)发射“神舟十三”号的火箭推进剂为液态四氧化二氮和液态偏二甲肼(C2H8N2)。
已知:① (1)
(1) 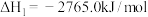
②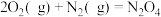 (1)
(1) 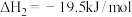
③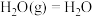 (1)
(1) 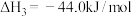
则反应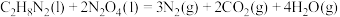 的
的 为
为________________ 。
(2)一种工业制硝酸的方法经历下列几个步骤:

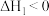
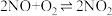
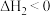

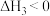
已知:NO在1000℃以上会发生分解反应。
①工业生产中未直接在一个设备中将NH3催化氧化至NO2,而设计了两步氧化,中间经过热交换器降温,这样做的目的除了给原料气预热节约能源之外,还有________________ ;
②实验发现,单位时间内NH3的氧化率 会随着温度的升高先增大后减小(如下图所示),分析出现这种变化的可能原因
会随着温度的升高先增大后减小(如下图所示),分析出现这种变化的可能原因________________________________________________ 。 ,利用现代手持技术传感器可以探究压强对该平衡的影响。
,利用现代手持技术传感器可以探究压强对该平衡的影响。
①有关该过程说法正确的是________________ 。
a.E、H两点对应的NO2的体积分数较大的为E点
b.B点操作是向里快速推注射器活塞,E点操作是向外快速拉注射器活塞
c.B、C、D三点正反应速率最大的是B点
d.C点时体系的颜色比D点深
②求D点
________________ 。
③图像中C、E两点气体平均摩尔质量最大的点为________________ (填代号)。
(1)发射“神舟十三”号的火箭推进剂为液态四氧化二氮和液态偏二甲肼(C2H8N2)。
已知:①
 (1)
(1) 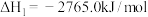
②
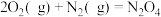 (1)
(1) 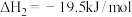
③
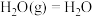 (1)
(1) 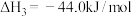
则反应
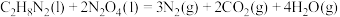 的
的 为
为(2)一种工业制硝酸的方法经历下列几个步骤:

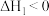
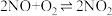
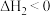

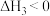
已知:NO在1000℃以上会发生分解反应。
①工业生产中未直接在一个设备中将NH3催化氧化至NO2,而设计了两步氧化,中间经过热交换器降温,这样做的目的除了给原料气预热节约能源之外,还有
②实验发现,单位时间内NH3的氧化率
 会随着温度的升高先增大后减小(如下图所示),分析出现这种变化的可能原因
会随着温度的升高先增大后减小(如下图所示),分析出现这种变化的可能原因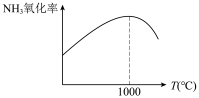
 ,利用现代手持技术传感器可以探究压强对该平衡的影响。
,利用现代手持技术传感器可以探究压强对该平衡的影响。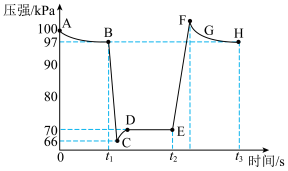
①有关该过程说法正确的是
a.E、H两点对应的NO2的体积分数较大的为E点
b.B点操作是向里快速推注射器活塞,E点操作是向外快速拉注射器活塞
c.B、C、D三点正反应速率最大的是B点
d.C点时体系的颜色比D点深
②求D点

③图像中C、E两点气体平均摩尔质量最大的点为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】含氮的化合物在化学反应中变化复杂。
Ⅰ.现用下图所示仪器(夹持装置已省略及药品,探究亚硝酸钠与硫酸反应及气体产物的成分。
已知:①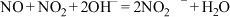 ;
;
②气体液化的温度: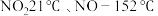 。
。___________ 。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是:___________ 。
(3)在关闭弹簧夹,滴入70%硫酸后,A中产生红棕色气体。
①盛装70%硫酸的仪器名称是___________ ;
②实验确认有NO的现象是___________ 。
(4)通过上述实验探究过程,可得出装置A中反应的化学方程式是___________ 。
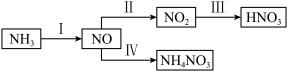
Ⅱ.NH3经一系列反应可以得到HNO3和NH4NO3,如图所示。
a.NH4NO3是一种白色晶体,易溶于水,微溶于乙醇。
b.在230℃以上时,同时有弱光: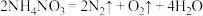
c.在400℃以上时,剧烈分解发生爆炸:
(5)如图将水滴入盛有硝酸铵的试管中,观察到的A处液面上升,B处液面下降,产生该现象的原因___________ 。___________ ,___________ (填“能”或“不能”)用硝酸铵代替氯化铵。
(7)完成离子反应Ⅳ:________ 。
 。
。
Ⅰ.现用下图所示仪器(夹持装置已省略及药品,探究亚硝酸钠与硫酸反应及气体产物的成分。
已知:①
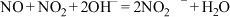 ;
;②气体液化的温度:
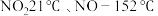 。
。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是:
(3)在关闭弹簧夹,滴入70%硫酸后,A中产生红棕色气体。
①盛装70%硫酸的仪器名称是
②实验确认有NO的现象是
(4)通过上述实验探究过程,可得出装置A中反应的化学方程式是
Ⅱ.NH3经一系列反应可以得到HNO3和NH4NO3,如图所示。
a.NH4NO3是一种白色晶体,易溶于水,微溶于乙醇。
b.在230℃以上时,同时有弱光:
c.在400℃以上时,剧烈分解发生爆炸:

(5)如图将水滴入盛有硝酸铵的试管中,观察到的A处液面上升,B处液面下降,产生该现象的原因
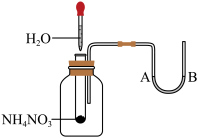
(7)完成离子反应Ⅳ:
 。
。
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题:
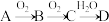
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①D的化学式是___________ ,检验D的稀溶液中主要阴离子的试剂是___________ 。
②在工业生产中,B气体的大量排放被雨水吸收后会形成___________ 而污染环境。
(2)若A在常温下为气体,C是红棕色的气体。
①A、C的化学式分别为___________ 、___________ 。
②写出 转化的化学方程式
转化的化学方程式___________ 。
③D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式___________ ,该反应中D体现的性质有___________ 。
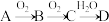
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①D的化学式是
②在工业生产中,B气体的大量排放被雨水吸收后会形成
(2)若A在常温下为气体,C是红棕色的气体。
①A、C的化学式分别为
②写出
 转化的化学方程式
转化的化学方程式③D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】A、B、C、D 、E、F是常见的气体,其中A、B、C、D为单质,有关的转化关系如下图所示(反应条件均已略去)。
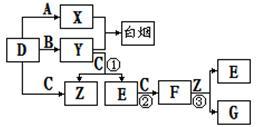
请回答下列问题:
(1)D的电子式为________________ 。
(2)反应③的离子方程式为_____________________ 。
(3)Y和E在一定条件下可反应生成B和Z,可消除E对环境的污染,该反应的化学方程式为______________________ 。
(4)常温下0.1mol/L的Y溶液中c(H+)/c(OH-)=1×10-8,下列叙述正确的是___________ 。
A.该溶液的pH=11
B.该溶液中的溶质电离出的阳离子浓度0.1mol/L
C.该溶液中水电离出的c(H+)与c(OH-)乘积为1×10-22
D. pH=3的盐酸溶液V1 L与该0.1mol/L的Y溶液V2 L混合,若混合溶液pH=7,则:V1>V2
E.将pH=11的Y溶液加水稀释100倍后,pH值为9;
(5)常温下pH=a的X溶液和pH=b的Y溶液等体积混合,若a+b=14,则混合后的溶液呈________ 性,混合溶液中各离子浓度大小关系为_____________________ 。

请回答下列问题:
(1)D的电子式为
(2)反应③的离子方程式为
(3)Y和E在一定条件下可反应生成B和Z,可消除E对环境的污染,该反应的化学方程式为
(4)常温下0.1mol/L的Y溶液中c(H+)/c(OH-)=1×10-8,下列叙述正确的是
A.该溶液的pH=11
B.该溶液中的溶质电离出的阳离子浓度0.1mol/L
C.该溶液中水电离出的c(H+)与c(OH-)乘积为1×10-22
D. pH=3的盐酸溶液V1 L与该0.1mol/L的Y溶液V2 L混合,若混合溶液pH=7,则:V1>V2
E.将pH=11的Y溶液加水稀释100倍后,pH值为9;
(5)常温下pH=a的X溶液和pH=b的Y溶液等体积混合,若a+b=14,则混合后的溶液呈
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】A、B、C、D、E、X是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。
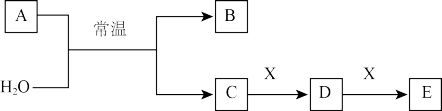
(1)若A为常见的金属单质,焰色反应呈黄色,X能使品红溶液褪色,写出C和E反应的离子方程式:________ 。
(2)若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强,则X可能为______ (填代号)。
a.NaHCO3 b.Na2CO3 c.Fe(OH)3 d.NaAlO2
(3)若A为淡黄色粉末,则A的电子式为______ 。若X为一种最常见的造成温室效应的气体。则鉴别等浓度的D、E两种溶液,可选择的试剂为_____ (填代号)。
a.盐酸 b.BaCl2溶液 c.NaOH溶液 d.Ca(OH)2溶液
写出A与X反应的化学方程式_____
(4)若A为氧化物,X是Fe,溶液D中加入KSCN溶液变红。则A与H2O反应的化学反应方程式为_____ ,E是_____ (填化学式)。

(1)若A为常见的金属单质,焰色反应呈黄色,X能使品红溶液褪色,写出C和E反应的离子方程式:
(2)若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强,则X可能为
a.NaHCO3 b.Na2CO3 c.Fe(OH)3 d.NaAlO2
(3)若A为淡黄色粉末,则A的电子式为
a.盐酸 b.BaCl2溶液 c.NaOH溶液 d.Ca(OH)2溶液
写出A与X反应的化学方程式
(4)若A为氧化物,X是Fe,溶液D中加入KSCN溶液变红。则A与H2O反应的化学反应方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】硝酸是重要的化工原料。工业制硝酸的原理示意图可简略表示如下(反应条件和部分生成物已略去):___________ 。
(2)物质A是___________ 。向吸收塔中通入A的作用是___________ 。
(3)硝酸能溶解铜,请写出铜和稀硝酸反应的离子方程式:___________ ,在该反应中硝酸体现了___________ 性。
(4)用绿色氧化剂(10%H2O2和20%稀硝酸的混合液)溶解铜,基本无氮氧化物排放,写出Cu与绿色氧化剂反应的离子反应方程式___________ 。
(5)硝酸工业尾气中的 会造成光化学烟雾和酸雨,污染环境,可用碱性溶液吸收。已知
会造成光化学烟雾和酸雨,污染环境,可用碱性溶液吸收。已知 用碳酸钠溶液吸收时会生成CO2、
用碳酸钠溶液吸收时会生成CO2、 和另一种化合物,写出反应的离子方程式
和另一种化合物,写出反应的离子方程式___________ 。
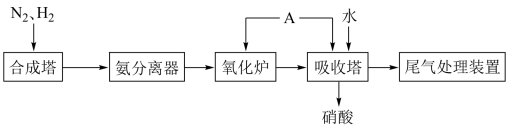
(2)物质A是
(3)硝酸能溶解铜,请写出铜和稀硝酸反应的离子方程式:
(4)用绿色氧化剂(10%H2O2和20%稀硝酸的混合液)溶解铜,基本无氮氧化物排放,写出Cu与绿色氧化剂反应的离子反应方程式
(5)硝酸工业尾气中的
 会造成光化学烟雾和酸雨,污染环境,可用碱性溶液吸收。已知
会造成光化学烟雾和酸雨,污染环境,可用碱性溶液吸收。已知 用碳酸钠溶液吸收时会生成CO2、
用碳酸钠溶液吸收时会生成CO2、 和另一种化合物,写出反应的离子方程式
和另一种化合物,写出反应的离子方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】氨气是世界上产量最多的无机化合物之一,具有广泛的用途。如图所示为合成氨以及氨催化氧化制硝酸的流程示意图。
(1) 常用作保护气(如填充灯泡、焊接保护等),原因是
常用作保护气(如填充灯泡、焊接保护等),原因是___________ 。
(2)合成塔中发生反应的化学方程式为___________ ,其中氮元素的化合价___________ (填“升高”或“降低”)。
(3)氧化炉中发生反应的化学方程式为___________ ;常温常压下,氧化剂和还原剂的体积之比为___________ 。
(4)吸收塔中通入空气是为了提供(填电子式)___________ 。
(5) 催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术,其反应原理如图所示。当
催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术,其反应原理如图所示。当 与NO的物质的量之比为1:1时,二者与足量氨气在一定条件下发生脱氮反应,该反应的化学方程式为
与NO的物质的量之比为1:1时,二者与足量氨气在一定条件下发生脱氮反应,该反应的化学方程式为___________ 。

(1)
 常用作保护气(如填充灯泡、焊接保护等),原因是
常用作保护气(如填充灯泡、焊接保护等),原因是(2)合成塔中发生反应的化学方程式为
(3)氧化炉中发生反应的化学方程式为
(4)吸收塔中通入空气是为了提供(填电子式)
(5)
 催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术,其反应原理如图所示。当
催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术,其反应原理如图所示。当 与NO的物质的量之比为1:1时,二者与足量氨气在一定条件下发生脱氮反应,该反应的化学方程式为
与NO的物质的量之比为1:1时,二者与足量氨气在一定条件下发生脱氮反应,该反应的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】氨对人类生产、生活有重要影响。回答下列问题:
(1)合成氨是工业上人工固氮的重要方法,写出该反应的化学方程式:__________ 。
(2)氨气的制备
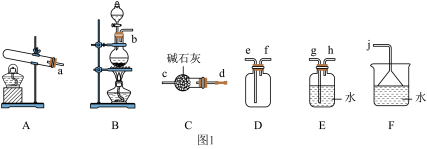
①氨气的发生装置可以选择图1中的__________ (填字母),反应的化学方程式为__________ 。
②欲收集一瓶干燥的氨气,选择图1中的装置,其连接顺序为:发生装置→__________ (按气流方向,用小写字母表示)。
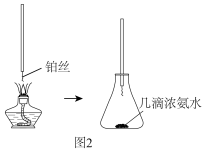
(3)氨的催化氧化:已知NH3在Pt催化和加热条件下与氧气反应,如图2是探究氨的催化氧化简易装置,观察到锥形瓶中铂丝保持红热,有红棕色气体或白烟产生。红棕色气体成分是___________ (填化学式,下同),白烟的成分是____________ 。
(1)合成氨是工业上人工固氮的重要方法,写出该反应的化学方程式:
(2)氨气的制备


①氨气的发生装置可以选择图1中的
②欲收集一瓶干燥的氨气,选择图1中的装置,其连接顺序为:发生装置→
(3)氨的催化氧化:已知NH3在Pt催化和加热条件下与氧气反应,如图2是探究氨的催化氧化简易装置,观察到锥形瓶中铂丝保持红热,有红棕色气体或白烟产生。红棕色气体成分是
您最近一年使用:0次



