Ⅰ.氨是工业生产硝酸的重要原料,请根据以下工业制硝酸的原理示意图回答含氮化合物相关的问题:

(1)工业用甲烷制取氢气作为合成氨的原料,已知以下的热化学反应方程式:
①2CO(g)+O2(g)=2CO2(g)∆H=-566kJ/mol
②2H2(g)+O2(g)=2H2O(g)∆H=-484kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(g)∆H=-890kJ/mol
则:CH4(g)+CO2(g)=2CO(g)+2H2(g)∆H=__ kJ/mol。
(2)一定温度下,将N2与H2以体积比1:2置于2L的密闭容器中发生反应:N2(g)+3H2(g) 2NH3(g),下列能说明反应达到平衡状态的是
2NH3(g),下列能说明反应达到平衡状态的是___ 。
A.体系压强保持不变
B.混合气体颜色保持不变
C.N2与H2的物质的量之比保持不变
D.每消耗2molNH3的同时消耗1molN2
(3)“吸收塔”尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的破坏作用,通常用氨转化法处理:已知7mol氨恰好能将含NO和NO2共6mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为__ 。
Ⅱ.氮肥厂的废水直接排放会造成污染,目前氨氮废水处理方法主要有吹脱法、化学沉淀法、生物硝化反硝化法等。某氮肥厂的氨氮废水中氮元素多以NH 和NH3•H2O的形式存在。该厂技术团队设计该废水处理方案流程如图:
和NH3•H2O的形式存在。该厂技术团队设计该废水处理方案流程如图:
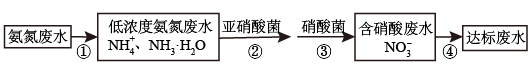
(4)检验某溶液中是否含有NH 的方法
的方法___ (写出所需试剂、操作及现象)。
(5)过程②、③:在微生物亚硝酸菌和硝酸菌作用下实现NH →NO
→NO →NO
→NO 的转化,称为硝化反应。1molNH
的转化,称为硝化反应。1molNH 可被
可被___ L(标准状况)O2最终氧化成NO 。
。
(6)过程④:在一定条件下向废水中加入甲醇(CH3OH)实现HNO2→N2转化,称为反硝化反应。此过程中甲醇(C元素-2价)转化为CO2,写出此过程的化学方程式___ 。

(1)工业用甲烷制取氢气作为合成氨的原料,已知以下的热化学反应方程式:
①2CO(g)+O2(g)=2CO2(g)∆H=-566kJ/mol
②2H2(g)+O2(g)=2H2O(g)∆H=-484kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(g)∆H=-890kJ/mol
则:CH4(g)+CO2(g)=2CO(g)+2H2(g)∆H=
(2)一定温度下,将N2与H2以体积比1:2置于2L的密闭容器中发生反应:N2(g)+3H2(g)
 2NH3(g),下列能说明反应达到平衡状态的是
2NH3(g),下列能说明反应达到平衡状态的是A.体系压强保持不变
B.混合气体颜色保持不变
C.N2与H2的物质的量之比保持不变
D.每消耗2molNH3的同时消耗1molN2
(3)“吸收塔”尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的破坏作用,通常用氨转化法处理:已知7mol氨恰好能将含NO和NO2共6mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为
Ⅱ.氮肥厂的废水直接排放会造成污染,目前氨氮废水处理方法主要有吹脱法、化学沉淀法、生物硝化反硝化法等。某氮肥厂的氨氮废水中氮元素多以NH
 和NH3•H2O的形式存在。该厂技术团队设计该废水处理方案流程如图:
和NH3•H2O的形式存在。该厂技术团队设计该废水处理方案流程如图:
(4)检验某溶液中是否含有NH
 的方法
的方法(5)过程②、③:在微生物亚硝酸菌和硝酸菌作用下实现NH
 →NO
→NO →NO
→NO 的转化,称为硝化反应。1molNH
的转化,称为硝化反应。1molNH 可被
可被 。
。(6)过程④:在一定条件下向废水中加入甲醇(CH3OH)实现HNO2→N2转化,称为反硝化反应。此过程中甲醇(C元素-2价)转化为CO2,写出此过程的化学方程式
更新时间:2021-05-26 19:09:50
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】I.FeSO4可用于制备一种新型、高效、多功能绿色水处理剂高铁酸钾(K2FeO4),氧化性比Cl2、O2、ClO2、KMnO4更强,主要反应:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑。
(1)该反应中的还原剂是___ ,当生成标况下3.36L气体时,转移的电子数为___ 。
(2)人体正常的血红蛋白含有Fe2+,若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是___ (填字母)。
II.二氧化氯(ClO2)气体也是一种常用的自来水消毒剂。
(3)草酸(H2C2O4)是一种弱酸,利用硫酸酸化的草酸还原氯酸钠(NaClO3),可较安全地生成ClO2,反应的离子方程式为___ 。
(4)自来水用ClO2处理后,有少量ClO2残留在水中,可用碘量法作如下检测(已知ClO2存在于pH为4~6的溶液中,ClO 存在于中性溶液中):
存在于中性溶液中):
①取0.50L水样,加入一定量的碘化钾,用氢氧化钠溶液调至中性,再加入淀粉溶液,溶液变蓝。写出ClO2与碘化钾反应的化学方程式:___ 。
②已知:2Na2S2O3+I2=Na2S4O6+2NaI,向①所得溶液中滴加5.00×10-4mol·L-1的Na2S2O3溶液至恰好反应,消耗Na2S2O3溶液20.00mL,该水样中ClO2的浓度是____ mg·L-1。
(1)该反应中的还原剂是
(2)人体正常的血红蛋白含有Fe2+,若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述不正确的是
| A.亚硝酸盐被氧化 |
| B.维生素C是还原剂 |
| C.维生素C将Fe3+还原为Fe2+ |
| D.亚硝酸盐是还原剂 |
II.二氧化氯(ClO2)气体也是一种常用的自来水消毒剂。
(3)草酸(H2C2O4)是一种弱酸,利用硫酸酸化的草酸还原氯酸钠(NaClO3),可较安全地生成ClO2,反应的离子方程式为
(4)自来水用ClO2处理后,有少量ClO2残留在水中,可用碘量法作如下检测(已知ClO2存在于pH为4~6的溶液中,ClO
 存在于中性溶液中):
存在于中性溶液中):①取0.50L水样,加入一定量的碘化钾,用氢氧化钠溶液调至中性,再加入淀粉溶液,溶液变蓝。写出ClO2与碘化钾反应的化学方程式:
②已知:2Na2S2O3+I2=Na2S4O6+2NaI,向①所得溶液中滴加5.00×10-4mol·L-1的Na2S2O3溶液至恰好反应,消耗Na2S2O3溶液20.00mL,该水样中ClO2的浓度是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐2】设计实验探究NO的氧化性。
实验Ⅰ:用排水法收集一瓶NO,将其倒扣在盛有碱性 溶液的水槽中,振荡,观察到集气瓶中液面上升。
溶液的水槽中,振荡,观察到集气瓶中液面上升。
资料:ⅰ.NO与碱性 溶液会发生氧化还原反应,
溶液会发生氧化还原反应, 被还原为
被还原为 。
。
ⅱ. 与
与 反应生成黄色沉淀。
反应生成黄色沉淀。
某同学认为,需通过进一步实验验证NO的氧化性,补充以下实验:
实验Ⅱ:取饱和 溶液,加入少量冰醋酸,再滴加5滴
溶液,加入少量冰醋酸,再滴加5滴 的
的 溶液,无明显变化。
溶液,无明显变化。
实验Ⅲ:
(1)取少量实验Ⅰ反应后集气瓶中的溶液,加入少量冰醋酸,再滴加5滴 的
的 溶液,
溶液,___________ (填实验现象)。
上述实验证明NO有氧化性。
(2)实验Ⅱ的目的是___________
(3)写出NO与碱性 溶液反应的离子方程式
溶液反应的离子方程式___________
(4)一个氧化还原反应可以看成“氧化”和“还原”两个半反应,试用此角度分析NO与碱性 溶液的反应。若还原反应为:
溶液的反应。若还原反应为: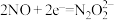 ,则氧化反应为:
,则氧化反应为:___________ 。
(5)某同学结合所学知识设计处理工业废气中 和NO的实验方案,达到消除污染,保护环境的目的。
和NO的实验方案,达到消除污染,保护环境的目的。
①先用饱和纯碱溶液吸收废气中的 ,生成
,生成 ,写出该反应的离子方程式
,写出该反应的离子方程式___________
②再向生成的溶液中加入一定量___________ ,以此溶液来吸收NO气体。
实验Ⅰ:用排水法收集一瓶NO,将其倒扣在盛有碱性
 溶液的水槽中,振荡,观察到集气瓶中液面上升。
溶液的水槽中,振荡,观察到集气瓶中液面上升。资料:ⅰ.NO与碱性
 溶液会发生氧化还原反应,
溶液会发生氧化还原反应, 被还原为
被还原为 。
。ⅱ.
 与
与 反应生成黄色沉淀。
反应生成黄色沉淀。某同学认为,需通过进一步实验验证NO的氧化性,补充以下实验:
实验Ⅱ:取饱和
 溶液,加入少量冰醋酸,再滴加5滴
溶液,加入少量冰醋酸,再滴加5滴 的
的 溶液,无明显变化。
溶液,无明显变化。实验Ⅲ:
(1)取少量实验Ⅰ反应后集气瓶中的溶液,加入少量冰醋酸,再滴加5滴
 的
的 溶液,
溶液,上述实验证明NO有氧化性。
(2)实验Ⅱ的目的是
(3)写出NO与碱性
 溶液反应的离子方程式
溶液反应的离子方程式(4)一个氧化还原反应可以看成“氧化”和“还原”两个半反应,试用此角度分析NO与碱性
 溶液的反应。若还原反应为:
溶液的反应。若还原反应为: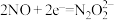 ,则氧化反应为:
,则氧化反应为:(5)某同学结合所学知识设计处理工业废气中
 和NO的实验方案,达到消除污染,保护环境的目的。
和NO的实验方案,达到消除污染,保护环境的目的。①先用饱和纯碱溶液吸收废气中的
 ,生成
,生成 ,写出该反应的离子方程式
,写出该反应的离子方程式②再向生成的溶液中加入一定量
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】废旧三元锂离子电池正极材料主要成分为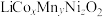 (含有铝箔、炭黑、有机物等杂质),回收钴、锰、镍、锂等金属的工艺流程如图所示:
(含有铝箔、炭黑、有机物等杂质),回收钴、锰、镍、锂等金属的工艺流程如图所示: 、CoO、MnO、
、CoO、MnO、 、NiO,回答下列问题:
、NiO,回答下列问题:
(1)粉碎后“灼烧”的目的是_______ 。
(2)“酸浸”时加入 的目的是
的目的是_______ ,该反应的离子方程式_______ 。
(3)“沉锰”后要测定过滤后溶液中 的浓度,某同学进行了如下操作:取溶液10.00mL,稀释至100mL,取25.00mL稀释后的溶液于锥形瓶中,用浓度为0.1000mol/L的
的浓度,某同学进行了如下操作:取溶液10.00mL,稀释至100mL,取25.00mL稀释后的溶液于锥形瓶中,用浓度为0.1000mol/L的 溶液进行滴定,滴定终点时,用去的
溶液进行滴定,滴定终点时,用去的 溶液体积平均值为12.50mL。
溶液体积平均值为12.50mL。
①发生反应的离子方程式为_______ ;
②达到滴定终点时的现象是_______ ;
③经计算,过滤后溶液中 的浓度为
的浓度为_______ ;
(4)沉锂后“热水洗涤”滤渣时,判断滤渣是否洗净的方法是_______ 。
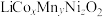 (含有铝箔、炭黑、有机物等杂质),回收钴、锰、镍、锂等金属的工艺流程如图所示:
(含有铝箔、炭黑、有机物等杂质),回收钴、锰、镍、锂等金属的工艺流程如图所示: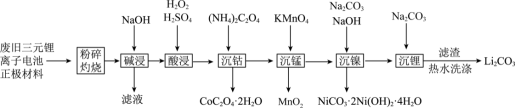
 、CoO、MnO、
、CoO、MnO、 、NiO,回答下列问题:
、NiO,回答下列问题:(1)粉碎后“灼烧”的目的是
(2)“酸浸”时加入
 的目的是
的目的是(3)“沉锰”后要测定过滤后溶液中
 的浓度,某同学进行了如下操作:取溶液10.00mL,稀释至100mL,取25.00mL稀释后的溶液于锥形瓶中,用浓度为0.1000mol/L的
的浓度,某同学进行了如下操作:取溶液10.00mL,稀释至100mL,取25.00mL稀释后的溶液于锥形瓶中,用浓度为0.1000mol/L的 溶液进行滴定,滴定终点时,用去的
溶液进行滴定,滴定终点时,用去的 溶液体积平均值为12.50mL。
溶液体积平均值为12.50mL。①发生反应的离子方程式为
②达到滴定终点时的现象是
③经计算,过滤后溶液中
 的浓度为
的浓度为(4)沉锂后“热水洗涤”滤渣时,判断滤渣是否洗净的方法是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
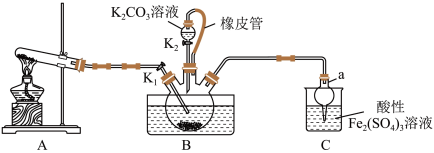
【推荐1】硫氰化钾(KSCN)是一种用途广泛的化工原料,常用于染料、药物的生产。实验小组设计如图实验装置模拟工业制备 KSCN 并进行相关探究实验。___________ 。
(2)装置A用于实验室制备氨气,反应的化学方程式为___________ 。
(3)装置B中,三颈烧瓶内盛放有 CS₂、水和固体催化剂,通入氨气的导管口需要浸没在 CS₂液体中,其目的是___________ (写两点)。
(4)KSCN 溶液的制备:实验开始时打开K₁,加热装置A、D,待三颈烧瓶内液体不分层后,熄灭装置A处的酒精灯,关闭K₁,移开水浴。将装置B继续加热至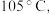 待 NH₄HS 完全分解后(
待 NH₄HS 完全分解后(  打开 K₂,缓缓滴入适量的)
打开 K₂,缓缓滴入适量的)  溶液,继续加热有气泡产生,制得KSCN 溶液,该反应的化学方程式是
溶液,继续加热有气泡产生,制得KSCN 溶液,该反应的化学方程式是___________ 。
(5)尾气处理:装置C 中仪器a的名称是___________ ,酸性Fe₂(SO₄)₃溶液用于除去尾气中两种污染性气体,其中一种气体M能使酚酞溶液变红,另一种气体N能使溶液产生淡黄色沉淀,写出除去气体N的离子方程式___________ 。
(6)过滤装置C中吸收尾气后的悬浊液,得到滤液x。取少量滤液x进行如图实验[已知 (白色)]:
(白色)]:___________ [可供选择的试剂: 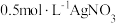 溶液、
溶液、 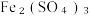 溶液、
溶液、 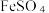 溶液、
溶液、  溶液]。
溶液]。

(2)装置A用于实验室制备氨气,反应的化学方程式为
(3)装置B中,三颈烧瓶内盛放有 CS₂、水和固体催化剂,通入氨气的导管口需要浸没在 CS₂液体中,其目的是
(4)KSCN 溶液的制备:实验开始时打开K₁,加热装置A、D,待三颈烧瓶内液体不分层后,熄灭装置A处的酒精灯,关闭K₁,移开水浴。将装置B继续加热至
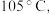 待 NH₄HS 完全分解后(
待 NH₄HS 完全分解后(  打开 K₂,缓缓滴入适量的)
打开 K₂,缓缓滴入适量的)  溶液,继续加热有气泡产生,制得KSCN 溶液,该反应的化学方程式是
溶液,继续加热有气泡产生,制得KSCN 溶液,该反应的化学方程式是(5)尾气处理:装置C 中仪器a的名称是
(6)过滤装置C中吸收尾气后的悬浊液,得到滤液x。取少量滤液x进行如图实验[已知
 (白色)]:
(白色)]: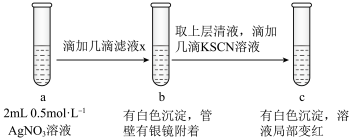
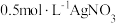 溶液、
溶液、 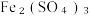 溶液、
溶液、 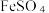 溶液、
溶液、  溶液]。
溶液]。
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。请回答下列问题:
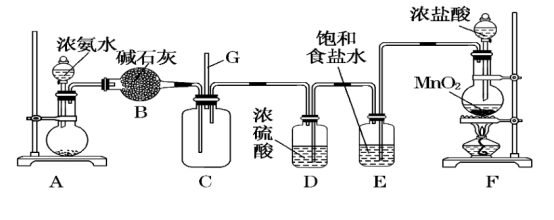
(1)装置A中的烧瓶内固体不可以选用___________(填序号)。
(2)装置E的作用是___________ 。
(3)装置F中发生反应的化学方程式是___________ 。
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:___________ 。
(5)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理?___________ 。

(1)装置A中的烧瓶内固体不可以选用___________(填序号)。
| A.生石灰 | B.碱石灰 | C.五氧化二磷 | D.烧碱 |
(3)装置F中发生反应的化学方程式是
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:
(5)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理?
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
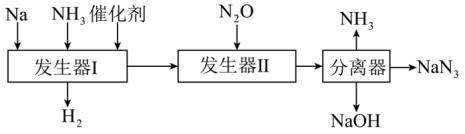
【推荐3】某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
Ⅰ.NaN3是气体发生剂,一种生产叠氮化钠的工艺流程如下:
(2)上述流程中可以循环利用的物质是___________。
(3)发生器I中的反应与“钠和水”反应相似,该反应的化学方程式为___________ 。
(4)发生器Ⅱ中的反应如下:2NaNH2+N2O=NaN3+NaOH+NH3。写出实验室检验NH3气体的方法___________ 。
Ⅱ.上述工艺流程生产的NaN3中可能会含有少量的Na2CO3杂质,某兴趣小组设计了如下图实验装置(部分夹持装置省略),测定产品NaN3中Na2CO3的含量。
a.取下装置D,称量。
b.称量样品质量 ,检查装置气密性。
,检查装置气密性。
c.打开弹簧夹,鼓入空气,一段时间后关闭。
d.打开分液漏斗的活塞和玻璃塞,注入足量稀硫酸充分反应,关闭活塞和玻璃塞。
(5)请写出正确的操作顺序:__________ ;
b→___________→___________→___________→___________→a(用步骤序号回答,可重复)。
(6)仪器E的名称为___________ 。该装置中的碱石灰的作用是___________ 。
Ⅲ.KClO4是助氧化剂,以NaCl等为原料制备KClO4得到的产品中会含有少量的KCl杂质,某兴趣小组为测定产品纯度进行了如下实验:准确称取11.378g样品溶于水中,配成500mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使ClO4-全部转化为Cl-,(反应为3KClO4+C6H12O6=6H2O+6CO2↑+3KCl)。加入少量K2CrO4溶液作指示剂,用0.40mol·L-1AgNO3溶液进行滴定至终点,消耗AgNO3溶液体积10.50mL(滴定达到终点时,产生砖红色Ag2CrO4沉淀)。
(7)已知: ,若
,若 ,则此时
,则此时
_________ mol/L,可认为沉淀反应已达完全。
(8)计算样品中KClO4的质量分数(写出计算过程)_______ 。
Ⅰ.NaN3是气体发生剂,一种生产叠氮化钠的工艺流程如下:
| A.NaN3中只含离子键 |
B.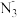 含有22个电子 含有22个电子 |
| C.常温下,0.01mol·L-1HN3溶液的pH>2 |
D.0.01mol·L-1NaN3溶液中:c(H+)+c(Na+)=c(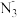 )+c(HN3) )+c(HN3) |
| A.N2O | B.NaOH | C.Na | D.NH3 |
(4)发生器Ⅱ中的反应如下:2NaNH2+N2O=NaN3+NaOH+NH3。写出实验室检验NH3气体的方法
Ⅱ.上述工艺流程生产的NaN3中可能会含有少量的Na2CO3杂质,某兴趣小组设计了如下图实验装置(部分夹持装置省略),测定产品NaN3中Na2CO3的含量。
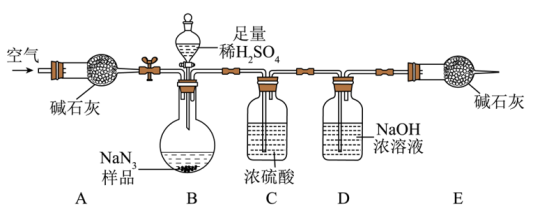
a.取下装置D,称量。
b.称量样品质量
 ,检查装置气密性。
,检查装置气密性。c.打开弹簧夹,鼓入空气,一段时间后关闭。
d.打开分液漏斗的活塞和玻璃塞,注入足量稀硫酸充分反应,关闭活塞和玻璃塞。
(5)请写出正确的操作顺序:
b→___________→___________→___________→___________→a(用步骤序号回答,可重复)。
(6)仪器E的名称为
Ⅲ.KClO4是助氧化剂,以NaCl等为原料制备KClO4得到的产品中会含有少量的KCl杂质,某兴趣小组为测定产品纯度进行了如下实验:准确称取11.378g样品溶于水中,配成500mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使ClO4-全部转化为Cl-,(反应为3KClO4+C6H12O6=6H2O+6CO2↑+3KCl)。加入少量K2CrO4溶液作指示剂,用0.40mol·L-1AgNO3溶液进行滴定至终点,消耗AgNO3溶液体积10.50mL(滴定达到终点时,产生砖红色Ag2CrO4沉淀)。
(7)已知:
 ,若
,若 ,则此时
,则此时
(8)计算样品中KClO4的质量分数(写出计算过程)
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】氮的氧化物是造成大气污染的主要物质。研究它们的反应机理,对于消除环境污染有重要意义。
(1)已知:4NH3(g)+5O2(g)=4NO(g) +6H2O(g) △H1=-907.0 kJ/mol
4NH3(g) +3O2(g)=2N2(g)+6H2O(g)△H2=-1269.0 kJ/mol
若4NH3(g) +6NO(g) 5N2(g) +6H2O(g)的正反应活化能为E正kJ/mol,则其逆反应活化能为
5N2(g) +6H2O(g)的正反应活化能为E正kJ/mol,则其逆反应活化能为___________ kJ/mol(用含E正的代数式表示)。
(2)在一定条件下,向某2 L密闭容器中分别投入一定量的NH3、NO发生反应:4NH3(g) +6NO(g) 5N2(g) +6H2O(g),其他条件相同时,在甲、乙两种催化剂的作用下,NO的转化率与温度的关系如图所示。
5N2(g) +6H2O(g),其他条件相同时,在甲、乙两种催化剂的作用下,NO的转化率与温度的关系如图所示。
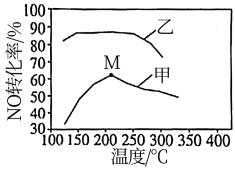
①工业上应选择催化剂___________ (填“甲”或“乙”)。
②M点是否为对应温度下NO的平衡转化率,判断理由是___________ 。温度高于210℃时,NO转化率降低的可能原因是___________ 。
(3)已知:NO2(g) +SO2(g) NO(g)+SO3(g)△H<0.向密闭容器中充入等体积的NO2和SO2,测得平衡状态时压强对数1gp(NO2)和lgp(SO3)的关系如下图所示。
NO(g)+SO3(g)△H<0.向密闭容器中充入等体积的NO2和SO2,测得平衡状态时压强对数1gp(NO2)和lgp(SO3)的关系如下图所示。
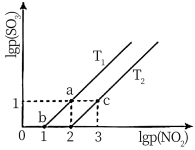
①ab两点体系总压强pa与pb的比值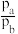 =
=___________ ;同一温度下图象呈线性变化的理由是___________ 。
②温度为T2时化学平衡常数Kp=___________ ,T1___________ T2(填“>”、“<”或“=”)。
(1)已知:4NH3(g)+5O2(g)=4NO(g) +6H2O(g) △H1=-907.0 kJ/mol
4NH3(g) +3O2(g)=2N2(g)+6H2O(g)△H2=-1269.0 kJ/mol
若4NH3(g) +6NO(g)
 5N2(g) +6H2O(g)的正反应活化能为E正kJ/mol,则其逆反应活化能为
5N2(g) +6H2O(g)的正反应活化能为E正kJ/mol,则其逆反应活化能为(2)在一定条件下,向某2 L密闭容器中分别投入一定量的NH3、NO发生反应:4NH3(g) +6NO(g)
 5N2(g) +6H2O(g),其他条件相同时,在甲、乙两种催化剂的作用下,NO的转化率与温度的关系如图所示。
5N2(g) +6H2O(g),其他条件相同时,在甲、乙两种催化剂的作用下,NO的转化率与温度的关系如图所示。
①工业上应选择催化剂
②M点是否为对应温度下NO的平衡转化率,判断理由是
(3)已知:NO2(g) +SO2(g)
 NO(g)+SO3(g)△H<0.向密闭容器中充入等体积的NO2和SO2,测得平衡状态时压强对数1gp(NO2)和lgp(SO3)的关系如下图所示。
NO(g)+SO3(g)△H<0.向密闭容器中充入等体积的NO2和SO2,测得平衡状态时压强对数1gp(NO2)和lgp(SO3)的关系如下图所示。
①ab两点体系总压强pa与pb的比值
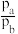 =
=②温度为T2时化学平衡常数Kp=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】工业废水和废渣中会产生含硫(-2价)污染物,需经处理后排放。
Ⅰ.含硫废水(硫元素的主要存在形式为 ),需要回收处理并加以利用。
),需要回收处理并加以利用。
(1)用 、
、 处理含硫废水有关反应如下:
处理含硫废水有关反应如下:






则 热分解反应
热分解反应 的△H=
的△H=_______ (用含 、
、 、
、 的式子表示)。
的式子表示)。
(2)用 处理含硫废水,硫元素易被氧化为S或
处理含硫废水,硫元素易被氧化为S或 。已知:
。已知: 溶液中含硫微粒的物质的量分数随pH变化情况如图所示。
溶液中含硫微粒的物质的量分数随pH变化情况如图所示。 调节溶液的pH为6,废水中
调节溶液的pH为6,废水中
_______ 。
②向含硫废水中加入 溶液,其他条件一定,测得硫(-2价)的去除率、硫(单质)的生成率与加入
溶液,其他条件一定,测得硫(-2价)的去除率、硫(单质)的生成率与加入 溶液体积的关系如图所示。当加入
溶液体积的关系如图所示。当加入 溶液体积大于9mL时,硫的生成率随
溶液体积大于9mL时,硫的生成率随 溶液加入而降低,可能的原因是
溶液加入而降低,可能的原因是_______ 。 可用作空气氧化含硫(-2价)废水的催化剂。碱性条件下,催化氧化废水的机理如图所示。
可用作空气氧化含硫(-2价)废水的催化剂。碱性条件下,催化氧化废水的机理如图所示。_______ 。
②催化剂使用一段时间后催化效率会下降,处理的方法是用氯仿(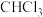 )浸取催化剂,再将催化剂干燥即可,催化剂使用一段时间后催化效率降低的原因是
)浸取催化剂,再将催化剂干燥即可,催化剂使用一段时间后催化效率降低的原因是_______ 。
Ⅱ.含硫废渣(硫元素的主要存在形式为 ),可以回收处理并加以利用。
),可以回收处理并加以利用。
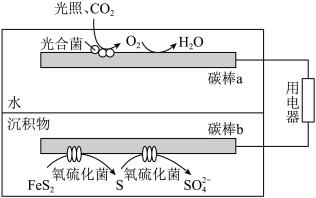
(4)沉积物-微生物燃料电池可以将沉积物中的化学能直接转化为电能,同时加速沉积物中污染物的去除,燃料电池处理含硫废水的工作原理如图所示。 的电极反应式为
的电极反应式为_______ 。
②工作一段时间后,电池效率降低的可能原因为_______ 。
Ⅰ.含硫废水(硫元素的主要存在形式为
 ),需要回收处理并加以利用。
),需要回收处理并加以利用。(1)用
 、
、 处理含硫废水有关反应如下:
处理含硫废水有关反应如下:





则
 热分解反应
热分解反应 的△H=
的△H= 、
、 、
、 的式子表示)。
的式子表示)。(2)用
 处理含硫废水,硫元素易被氧化为S或
处理含硫废水,硫元素易被氧化为S或 。已知:
。已知: 溶液中含硫微粒的物质的量分数随pH变化情况如图所示。
溶液中含硫微粒的物质的量分数随pH变化情况如图所示。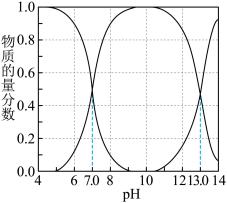
 调节溶液的pH为6,废水中
调节溶液的pH为6,废水中
②向含硫废水中加入
 溶液,其他条件一定,测得硫(-2价)的去除率、硫(单质)的生成率与加入
溶液,其他条件一定,测得硫(-2价)的去除率、硫(单质)的生成率与加入 溶液体积的关系如图所示。当加入
溶液体积的关系如图所示。当加入 溶液体积大于9mL时,硫的生成率随
溶液体积大于9mL时,硫的生成率随 溶液加入而降低,可能的原因是
溶液加入而降低,可能的原因是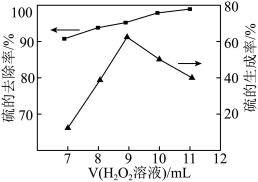
 可用作空气氧化含硫(-2价)废水的催化剂。碱性条件下,催化氧化废水的机理如图所示。
可用作空气氧化含硫(-2价)废水的催化剂。碱性条件下,催化氧化废水的机理如图所示。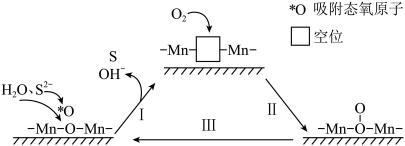
②催化剂使用一段时间后催化效率会下降,处理的方法是用氯仿(
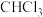 )浸取催化剂,再将催化剂干燥即可,催化剂使用一段时间后催化效率降低的原因是
)浸取催化剂,再将催化剂干燥即可,催化剂使用一段时间后催化效率降低的原因是Ⅱ.含硫废渣(硫元素的主要存在形式为
 ),可以回收处理并加以利用。
),可以回收处理并加以利用。(4)沉积物-微生物燃料电池可以将沉积物中的化学能直接转化为电能,同时加速沉积物中污染物的去除,燃料电池处理含硫废水的工作原理如图所示。
 的电极反应式为
的电极反应式为②工作一段时间后,电池效率降低的可能原因为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)三氯化氮(NCl3)是一种黄色、油状、具有刺激性气味的挥发性有毒液体,各原子均满足8电子稳定结构。其电子式是________ 。氯碱工业生产时,由于食盐水中通常含有少量NH4Cl,而在阳极区与生成的氯气反应产生少量NCl3,该反应的化学方程式为__________ 。
(2)一定条件下,不同物质的量的CO2与不同体积的1.0 mol/L NaOH溶液充分反应放出的热量如下表所示:
该条件CO2与NaOH溶液反应生成NaHCO3的热化学反应方程式为________________ 。
(3)利用CO可以将NO转化为无害的N2,其反应为: 2NO(g)+2CO(g) N2(g)+2CO2(g),向容积均为1 L的甲、乙两个恒温(温度分别为300℃、T℃)容器中分别加入2.00 mol NO和2.00 mol CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
N2(g)+2CO2(g),向容积均为1 L的甲、乙两个恒温(温度分别为300℃、T℃)容器中分别加入2.00 mol NO和2.00 mol CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
①甲容器中,0~40min 内用NO的浓度变化表示的反应速率v(NO)=_____________ 。
②该反应的△H____ 0(填“>”或“<”)。
③甲容器反应达到平衡后,若容器内各物质的量均增加1倍,则平衡_________ (填“正向”、“逆向”或“不”)移动。
(1)三氯化氮(NCl3)是一种黄色、油状、具有刺激性气味的挥发性有毒液体,各原子均满足8电子稳定结构。其电子式是
(2)一定条件下,不同物质的量的CO2与不同体积的1.0 mol/L NaOH溶液充分反应放出的热量如下表所示:
| 反应序号 | n(CO2)/mol | V (NaOH) /L | 放出的热量/kJ |
| 1 | 0.5 | 0.75 | a |
| 2 | 1.0 | 2.00 | b |
该条件CO2与NaOH溶液反应生成NaHCO3的热化学反应方程式为
(3)利用CO可以将NO转化为无害的N2,其反应为: 2NO(g)+2CO(g)
 N2(g)+2CO2(g),向容积均为1 L的甲、乙两个恒温(温度分别为300℃、T℃)容器中分别加入2.00 mol NO和2.00 mol CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
N2(g)+2CO2(g),向容积均为1 L的甲、乙两个恒温(温度分别为300℃、T℃)容器中分别加入2.00 mol NO和2.00 mol CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:| t/min | 0 | 40 | 80 | 120 | 160 |
| n甲(CO)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n乙(CO)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①甲容器中,0~40min 内用NO的浓度变化表示的反应速率v(NO)=
②该反应的△H
③甲容器反应达到平衡后,若容器内各物质的量均增加1倍,则平衡
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。T℃时反应
2SO2(g)+O2(g) 2SO3(g)过程中的能量变化如图所示,回答下列问题。
2SO3(g)过程中的能量变化如图所示,回答下列问题。
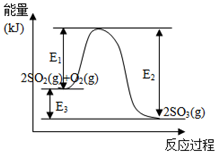
(1)T℃时将3molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生反应。2min时反应达到平衡,此时测得反应物O2还剩余0.1mol,则达到平衡时SO2的转化率为_______ ,反应放出_____________ 热量。(用E1、E2或E3表示)
(2)下列叙述能证明该反应已达化学平衡状态的是__________________ (填序号)
①SO2的体积分数不再发生变化
②容器内压强不再发生变化
③容器内气体原子总数不再发生变化
④相同时间内消耗2n molSO2的同时生成n molO2
⑤相同时间内消耗2n molSO2的同时生成2n molSO3
(3)在反应体系中加入催化剂,反应速率增大, E3的变化是: E3____________ (填“增大”“减小”或“不变”)
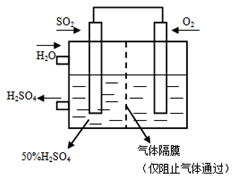
(4)若以下图所示装置,用电化学原理生产硫酸,将SO2、O2以一定压强喷到活性电极上反应。写出通SO2电极的电极反应式:______________ 。
(5) SOCl2是一种无色液体,可与碳共同构成锂电池的正极材料,且其放电时也有SO2气体产生。写出SOCl2在电池中放电时的电极反应式_________________ 。
2SO2(g)+O2(g)
 2SO3(g)过程中的能量变化如图所示,回答下列问题。
2SO3(g)过程中的能量变化如图所示,回答下列问题。
(1)T℃时将3molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生反应。2min时反应达到平衡,此时测得反应物O2还剩余0.1mol,则达到平衡时SO2的转化率为
(2)下列叙述能证明该反应已达化学平衡状态的是
①SO2的体积分数不再发生变化
②容器内压强不再发生变化
③容器内气体原子总数不再发生变化
④相同时间内消耗2n molSO2的同时生成n molO2
⑤相同时间内消耗2n molSO2的同时生成2n molSO3
(3)在反应体系中加入催化剂,反应速率增大, E3的变化是: E3
(4)若以下图所示装置,用电化学原理生产硫酸,将SO2、O2以一定压强喷到活性电极上反应。写出通SO2电极的电极反应式:

(5) SOCl2是一种无色液体,可与碳共同构成锂电池的正极材料,且其放电时也有SO2气体产生。写出SOCl2在电池中放电时的电极反应式
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】砷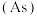 是第四周期ⅤA族元素,可以形成
是第四周期ⅤA族元素,可以形成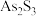 、
、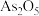 、
、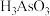 、
、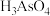 等 化合物,有着广泛的用途
等 化合物,有着广泛的用途 回答下列问题:
回答下列问题:
(1)写出砷的原子序数______________
(2)工业上常将含砷废渣 主要成分为
主要成分为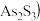 制成浆状,通入
制成浆状,通入 氧化,生成
氧化,生成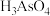 和单质硫
和单质硫 写出发生反应的化学方程式
写出发生反应的化学方程式 _____________________________________________  该反应需要在加压下进行,原因是
该反应需要在加压下进行,原因是 _______________________________________
(3)已知: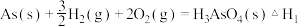
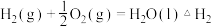
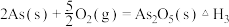
则反应 的
的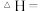
________________________
(4)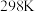 时,将
时,将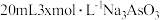 、
、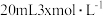
 和20mL NaOH溶液混合,发生反应:
和20mL NaOH溶液混合,发生反应: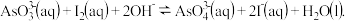 溶液中
溶液中 与反应时间
与反应时间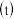 的关系如图所示.
的关系如图所示.
①下列可判断反应达到平衡的是______  填标号
填标号 .
.
 溶液的pH不再变化
溶液的pH不再变化 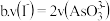
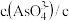
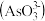 不再变化
不再变化 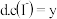
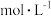
②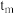 时,
时,
______  填“大于”“小于”或“等于”
填“大于”“小于”或“等于”
③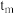 时,
时,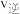
______  时
时 填“大于”“小于”或“等于”
填“大于”“小于”或“等于” ,理由是
,理由是 ____________________
④若平衡时溶液的 ,则该反应的平衡常数K为
,则该反应的平衡常数K为 ______________
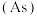 是第四周期ⅤA族元素,可以形成
是第四周期ⅤA族元素,可以形成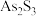 、
、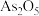 、
、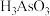 、
、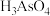 等 化合物,有着广泛的用途
等 化合物,有着广泛的用途 回答下列问题:
回答下列问题:(1)写出砷的原子序数
(2)工业上常将含砷废渣
 主要成分为
主要成分为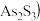 制成浆状,通入
制成浆状,通入 氧化,生成
氧化,生成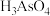 和单质硫
和单质硫 写出发生反应的化学方程式
写出发生反应的化学方程式  该反应需要在加压下进行,原因是
该反应需要在加压下进行,原因是 (3)已知:
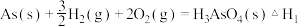
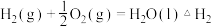
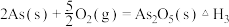
则反应
 的
的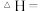
(4)
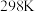 时,将
时,将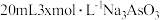 、
、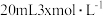
 和20mL NaOH溶液混合,发生反应:
和20mL NaOH溶液混合,发生反应: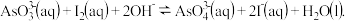 溶液中
溶液中 与反应时间
与反应时间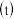 的关系如图所示.
的关系如图所示.
①下列可判断反应达到平衡的是
 填标号
填标号 .
. 溶液的pH不再变化
溶液的pH不再变化 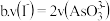
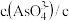
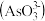 不再变化
不再变化 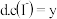
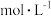
②
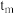 时,
时,
 填“大于”“小于”或“等于”
填“大于”“小于”或“等于”
③
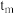 时,
时,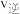
 时
时 填“大于”“小于”或“等于”
填“大于”“小于”或“等于” ,理由是
,理由是 ④若平衡时溶液的
 ,则该反应的平衡常数K为
,则该反应的平衡常数K为
您最近一年使用:0次
【推荐3】I.中国科学家首次实现了二氧化碳到淀粉的全合成,相关成果由国际知名学术期刊《科学》在线发表。CO2的捕集、利用与封存是科学家研究的重要课题,利用CH4与CO2制备“合成气”CO、H2,合成气可直接制备甲醇,反应原理为:CO(g)+2H2(g) CH3OH(g) ΔH=-99 kJ·mol-1。
CH3OH(g) ΔH=-99 kJ·mol-1。
(1)若要该反应自发进行,___________ (填“高温”、“低温”或“任何温度”)更有利。
(2)在恒温、恒容的密闭容器中,对于合成气合成甲醇的反应,下列说法中能说明该反应达到化学平衡状态的是___________。
(3)把CO2 转化为HCOOH 是降碳并生产化工原料的常用方法,有关反应如下:
①CO(g)+H2O(g) HCOOH(g) ΔH1=-72.6 kJ·mol-1
HCOOH(g) ΔH1=-72.6 kJ·mol-1
②2CO(g)+O2(g) 2CO2(g) ΔH2=-566 kJ·mol-1
2CO2(g) ΔH2=-566 kJ·mol-1
③O2(g)+2H2(g) 2H2O(g) ΔH3=-483.6 kJ·mol-1
2H2O(g) ΔH3=-483.6 kJ·mol-1
则CO2(g)与 H2(g)合成 HCOOH(g)反应的热化学方程式:___________ 。
(4)还可利用电化学方法可以将CO2有效地转化为HCOO-,后续经酸化转化为HCOOH,原理示意图如图所示,下列说法错误的是___________。
Ⅱ.我国学者结合实验与计算机模拟结果,研究了NO-CO的反应历程。在催化剂作用下, 此反应为2CO(g)+2NO(g) 2CO2(g)+N2(g) ΔH<0可有效降低汽车尾气污染物排放。
2CO2(g)+N2(g) ΔH<0可有效降低汽车尾气污染物排放。
(5)探究温度、压强(2MPa,5MPa)对反应的影响,如图所示,表示2MPa 的是___________。
(6)一定温度下,向容积1L的恒容密闭容器按体积比3:2的比例充入CO和NO,当反应达到平衡时NO的体积分数为 ,此温度下该反应的平衡常数K=
,此温度下该反应的平衡常数K=___________ =___________ 。(第一空写表达式,第二空保留三位有效数字)
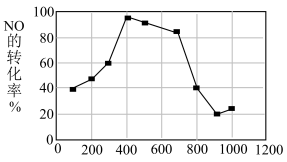
(7)使用相同催化剂,测得相同时间内 NO 的转化率随温度的变化曲线如图,解释 NO 的转化率在 100~900℃范围内随温度升高先上升后下降,且下降由缓到急的主要原因是___________ ;___________ 。
 CH3OH(g) ΔH=-99 kJ·mol-1。
CH3OH(g) ΔH=-99 kJ·mol-1。(1)若要该反应自发进行,
(2)在恒温、恒容的密闭容器中,对于合成气合成甲醇的反应,下列说法中能说明该反应达到化学平衡状态的是___________。
| A.混合气体中碳元素的质量分数不再改变 | B.混合气体的密度不再变化 |
| C.CO的百分含量不再变化 | D.2v(H2)正=v(CO)逆 |
(3)把CO2 转化为HCOOH 是降碳并生产化工原料的常用方法,有关反应如下:
①CO(g)+H2O(g)
 HCOOH(g) ΔH1=-72.6 kJ·mol-1
HCOOH(g) ΔH1=-72.6 kJ·mol-1②2CO(g)+O2(g)
 2CO2(g) ΔH2=-566 kJ·mol-1
2CO2(g) ΔH2=-566 kJ·mol-1③O2(g)+2H2(g)
 2H2O(g) ΔH3=-483.6 kJ·mol-1
2H2O(g) ΔH3=-483.6 kJ·mol-1则CO2(g)与 H2(g)合成 HCOOH(g)反应的热化学方程式:
(4)还可利用电化学方法可以将CO2有效地转化为HCOO-,后续经酸化转化为HCOOH,原理示意图如图所示,下列说法错误的是___________。

A.电解池的阴极电极反应式为2CO2+2e-+H2O=HCOO-+HCO |
| B.b为电源正极 |
| C.电解一段时间后,阳极区的KHCO3 溶液浓度降低 |
| D.若以氢氧碱性燃料电池作直流电源,那么负极的电极反应式为H2-2e-+2OH-=2H2O |
Ⅱ.我国学者结合实验与计算机模拟结果,研究了NO-CO的反应历程。在催化剂作用下, 此反应为2CO(g)+2NO(g)
 2CO2(g)+N2(g) ΔH<0可有效降低汽车尾气污染物排放。
2CO2(g)+N2(g) ΔH<0可有效降低汽车尾气污染物排放。(5)探究温度、压强(2MPa,5MPa)对反应的影响,如图所示,表示2MPa 的是___________。

| A.a | B.b | C.c | D.d |
(6)一定温度下,向容积1L的恒容密闭容器按体积比3:2的比例充入CO和NO,当反应达到平衡时NO的体积分数为
 ,此温度下该反应的平衡常数K=
,此温度下该反应的平衡常数K=(7)使用相同催化剂,测得相同时间内 NO 的转化率随温度的变化曲线如图,解释 NO 的转化率在 100~900℃范围内随温度升高先上升后下降,且下降由缓到急的主要原因是
您最近一年使用:0次



