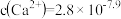常温下几种阳离子浓度与溶液pH的关系如图所示。据图判断下列说法正确的是

| A.Ksp[Fe(OH)2]=1.0×10-21 |
| B.Mg(OH)2饱和溶液中c(Mg2+)=1.0×10-4mol/L |
| C.a点可表示Fe(OH)3的不饱和溶液,Cu(OH)2的饱和溶液 |
| D.Fe3+浓度为0.01mol/L溶液中,调节pH=3.2,可认为Fe3+沉淀完全 |
20-21高二下·黑龙江大庆·期末 查看更多[3]
黑龙江省大庆实验中学2020-2021学年高二下学期期末化学试题(已下线)必考点08 沉淀溶解平衡-【对点变式题】2021-2022学年高二化学上学期期中期末必考题精准练(人教版选择性必修1)(已下线)3.4.2 沉淀溶解平衡的应用-2021-2022学年高二化学课后培优练(人教版选修4)
更新时间:2021-07-31 20:37:59
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】在含有Ag+的酸性溶液中,以铁铵矾NH4Fe(SO4)2作指示剂,用KSCN的标准溶液滴定Ag+。已知:AgSCN (白色,s) ⇌Ag+ + SCN-,Ksp=1.0×10-12 ;Fe3+ + SCN- ⇌FeSCN2+ (红色), K=138。下列说法正确的是( )
| A.边滴定,边摇动溶液,首先溶液变红色 |
| B.当Ag+定量沉淀后,少许过量的SCN-与Fe3+生成红色配合物,即为终点 |
| C.上述实验可用KCl标准溶液代替KSCN的标准溶液滴定Ag+ |
| D.滴定时,溶液pH变化不会影响终点的观察 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
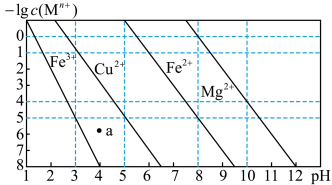
【推荐2】下列坐标图均涉及平衡原理,其中相关表述正确的是

| A.图①表示室温下,用0.1mol·L-1氨水吸收HCl气体时,溶液的粒子浓度随吸收HCl的变化,实线表示c(NH3·H2O),虚线表示c(NH4+),处于M点时溶液呈中性 |
B.图②表示2SO2(g)+O2(g)  2SO3(g) △H<0正逆反应的平衡常数K随温度的变化 2SO3(g) △H<0正逆反应的平衡常数K随温度的变化 |
C.图③表示反应2NH3(g)  3H2(g)+N2(g)在恒温恒压装置中达平衡时,N2的物质的量与通入NH3的物质的量的变化关系 3H2(g)+N2(g)在恒温恒压装置中达平衡时,N2的物质的量与通入NH3的物质的量的变化关系 |
D.图④表示AgCl(s)  Ag+(aq)+Cl-(aq)的离子的浓度关系,当处于b点时,蒸发部分的水后,可以到达平衡线的a点处 Ag+(aq)+Cl-(aq)的离子的浓度关系,当处于b点时,蒸发部分的水后,可以到达平衡线的a点处 |
您最近一年使用:0次
单选题
|
适中
(0.65)
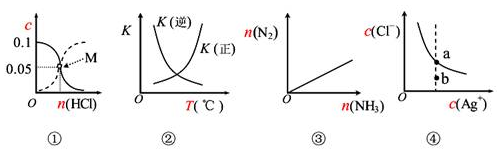
【推荐3】25 ℃时,用Na2S沉淀Cu2+、Zn2+两种金属阳离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示。下列说法不正确的是( )


| A.向Cu2+浓度为1×10-5 mol·L-1的工业废水中加入ZnS粉末,会有CuS沉淀析出 |
| B.25 ℃时,Ksp(CuS)约为1×10-35 |
| C.向100 mL Zn2+、Cu2+浓度均为1×10-5 mol·L-1的混合溶液中逐滴加入1×10-4 mol·L-1的Na2S溶液,Cu2+先沉淀 |
| D.Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】下列图示与对应的叙述相符的是


| A.据图①可判断可逆反应A2(g)+3B2(g)⇌2AB3(g)的ΔH>0 |
| B.图②表示压强对可逆反应2A(g)+B(g)⇌3C(g)+D(s)的影响,乙的压强大 |
| C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 |
| D.据图④,若除去0.1mol·L-1CuSO4溶液中混有的Fe3+,可向溶液中加入适量NaOH至pH约为7 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】下列实验操作及现象能够达成相应实验目的的是
| 实验目的 | 实验操作及现象 | |
| A | 除去铜中的氧化铜 | 加入稀硝酸,溶解过滤、洗涤干燥 |
| B | 证明Ksp(AgCl)>Ksp(AgI) | 向含等浓度的NaCl、NaI混合溶液中滴加硝酸银溶液,首先生成黄色沉淀 |
| C | 证明碳的非金属性强于硅 | 将浓盐酸滴入碳酸钠固体中,生成的气体通入盛有水玻璃的试管中,出现浑浊 |
| D | 证明SO2具有漂白性 | 将SO2 通入酸性KMnO4 溶液中,溶液紫色褪去 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐3】下列实验中对应的现象和结论均正确的是
| 实验 | 现象 | 结论 | |
| A | 向淀粉在稀硫酸催化下水解后的溶液中加入少量新制的银氨溶液,水浴加热 | 无银镜生成 | 淀粉未发生水解 |
| B | 将Fe(NO3)2晶体溶于稀H2SO4后,滴加KSCN溶液 | 溶液变红 | Fe(NO3)2晶体已氧化变质 |
| C | 向10mL0.1mol/L NaOH溶液中加入1mL0.1mol/L MgCl2溶液,再向混合液中滴加0.1mol/L CuCl2溶液 | 有蓝色沉淀生成 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
| D | 向溴苯和液溴的混合液中加氢氧化钠溶液,振荡、静置,分液 | 分液前溶液分层,均为无色 | 溴苯中的液溴被除去 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
【推荐1】T℃时,分别向10 mL浓度均为0.1 mol·L-1的CuCl2和ZnCl2溶液中滴加0.1 mol·L-1的Na2S溶液,滴加过程中-lgc(Cu2+)和-lgc(Zn2+)与Na2S溶液体积(V)的关系如图所示[已知:Ksp(ZnS)>Ksp(CuS),lg3≈0.5]。下列有关说法错误的是( )。
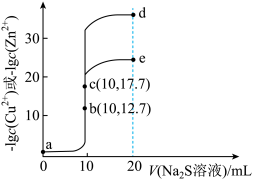

| A.a~b~d为滴定ZnCl2溶液的曲线 |
| B.对应溶液pH:a<b<e |
| C.a点对应的CuCl2溶液中:c(Cl-)<2[c(Cu2+)+c(H+)] |
| D.d点纵坐标约为33.9 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
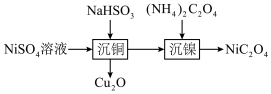
【推荐2】室温下,用含少量Cu2+的NiSO4溶液制备NiC2O4的过程如图所示。已知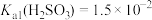 ,
,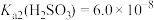 。下列说法正确的是
。下列说法正确的是
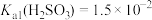 ,
,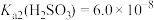 。下列说法正确的是
。下列说法正确的是
A.pH=5的NaHSO3溶液中存在: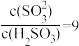 |
| B.“沉铜”后的溶液pH值增大 |
C. 溶液中: 溶液中: |
D.“沉镍”得到的上层清液中: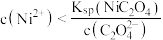 |
您最近一年使用:0次

 与空气中的
与空气中的 保持平衡。已知某温度下,
保持平衡。已知某温度下,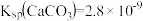 。某溶洞水体中
。某溶洞水体中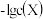 (X为
(X为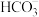 、
、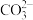 或
或 )与pH的关系如图所示。下列说法错误的是
)与pH的关系如图所示。下列说法错误的是
 数量级为
数量级为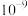
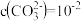
 时,溶液的
时,溶液的
 时,水体中
时,水体中