某化学学习小组为探究NO2和SO2的反应,进行如下实验(如图所示)。

(1)图甲两集气瓶中___________ (填“上”或“下”)瓶颜色深。
(2)图乙中反应的现象是___________ 。
(3)图丙中“有红棕色气体产生”说明SO2和NO2反应的产物中有___________ ,说明NO2在该反应中表现___________ 性。
(4)由图乙和图丙中的现象写出NO2和SO2反应的化学方程式:___________ 。

(1)图甲两集气瓶中
(2)图乙中反应的现象是
(3)图丙中“有红棕色气体产生”说明SO2和NO2反应的产物中有
(4)由图乙和图丙中的现象写出NO2和SO2反应的化学方程式:
18-19高一·全国·假期作业 查看更多[8]
第1课时 自然界中的氮循环、氮气和氮的氧化物(已下线)3.2.1 固氮和氨气-【帮课堂】2022-2023学年高一化学同步精品讲义(沪科版2020必修第一册)(已下线)5.2.1 氮及氮的固定 氮的氧化物-2021-2022学年高一化学课后培优练(人教版2019必修第二册)(已下线)4.2.1 含硫物质间的转化-2021-2022学年高一化学课后培优练(苏教版2019必修第一册)湖南省邵东县第三中学2020-2021学年高一下学期第一次月考化学试题(已下线)5.2.1 氮气与氮的氧化物(练好题)(能力提升)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)鲁科版(2019)高一必修第一册第三章第3节 氮的循环 课时1 氮气一氧化氮和二氧化氮步步为赢 高一化学寒假作业:作业十四 硫和氮的氧化物
更新时间:2021-09-08 18:42:26
|
相似题推荐
解答题-无机推断题
|
较易
(0.85)
【推荐1】利用下图,可以从不同角度研究含硫物质的性质及其转化关系,图中物质甲~己中均含有硫元素.回答下列问题:
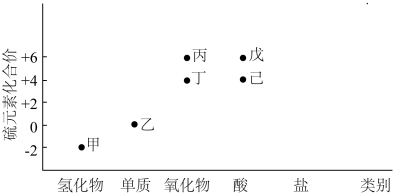
(1)写出甲的电子式:_______ ,该物质中的硫元素可表现出___________ (填“氧化性”或“还原性”);利用高温热分解甲可以获得乙,该方法的优点是______________ ,缺点是_____________ .
(2)黄铁矿(主要成分为 )在沸腾炉中与氧气反应,主要生成的含硫元素的物质是
)在沸腾炉中与氧气反应,主要生成的含硫元素的物质是__________ (填“丙”或“丁”),该物质与水化合生成___________ (填化学名称).
(3)① 溶液与戊溶液反应的离子方程式为
溶液与戊溶液反应的离子方程式为_______________________________ .
②同位素示踪实验可证实 中两个S原子的化学环境不同,实验过程为
中两个S原子的化学环境不同,实验过程为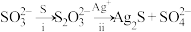 .过程ii中,
.过程ii中, 断裂的只有硫硫键,若过程i所用试剂为
断裂的只有硫硫键,若过程i所用试剂为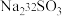 和
和 ,过程ii含硫产物是
,过程ii含硫产物是_____________ (标记出同位素原子).

(1)写出甲的电子式:
(2)黄铁矿(主要成分为
 )在沸腾炉中与氧气反应,主要生成的含硫元素的物质是
)在沸腾炉中与氧气反应,主要生成的含硫元素的物质是(3)①
 溶液与戊溶液反应的离子方程式为
溶液与戊溶液反应的离子方程式为②同位素示踪实验可证实
 中两个S原子的化学环境不同,实验过程为
中两个S原子的化学环境不同,实验过程为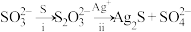 .过程ii中,
.过程ii中, 断裂的只有硫硫键,若过程i所用试剂为
断裂的只有硫硫键,若过程i所用试剂为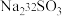 和
和 ,过程ii含硫产物是
,过程ii含硫产物是
您最近一年使用:0次
【推荐2】某化工厂以软锰矿、闪锌矿(除主要成分为MnO2、ZnS外还含有少量的FeS、CuS、Al2O3等物质)为原料制取Zn和MnO2.
(1)在一定条件下,将这两种矿粉在硫酸溶液中相互作用,配平如下的化学方程式:MnO2+FeS+H2SO4=MnSO4+Fe2(SO4)3+S+H2O_____
(2)将所得含有Mn2+、Fe3+、Cu2+、Al3+、Zn2+的酸性溶液按如图甲的工业流程进行操作处理得溶液(Ⅳ),电解溶液(Ⅳ)即得MnO2和Zn.
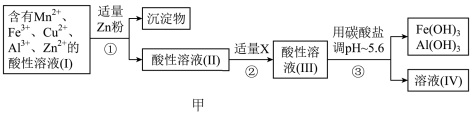
a、操作①中加Zn粉后发生反应的离子方程式为______ .
b、操作②中加入适量X的作用是什么______ ;X的首选物的化学式是: ______ .
c、操作③中所加碳酸盐的化学式是______ .
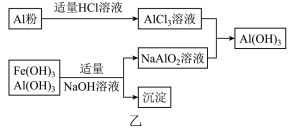
(3)为了从上述流程中产生的Fe(OH)3、Al(OH)3沉淀混合物中回收Al(OH)3,工厂设计了如图乙的有关流程图.
a、AlCl3溶液和NaAlO2溶液反应生成Al(OH)3的离子方程式为______ .若总共得到nmol Al(OH)3,则消耗的NaOH和HCl的理论量(mol)分别为 ______ 、 ______ .
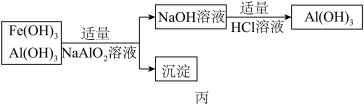
b、若使用如图丙流程回收处理,请比较两个流程消耗酸碱的用量?______ .
(1)在一定条件下,将这两种矿粉在硫酸溶液中相互作用,配平如下的化学方程式:MnO2+FeS+H2SO4=MnSO4+Fe2(SO4)3+S+H2O
(2)将所得含有Mn2+、Fe3+、Cu2+、Al3+、Zn2+的酸性溶液按如图甲的工业流程进行操作处理得溶液(Ⅳ),电解溶液(Ⅳ)即得MnO2和Zn.



a、操作①中加Zn粉后发生反应的离子方程式为
b、操作②中加入适量X的作用是什么
c、操作③中所加碳酸盐的化学式是
(3)为了从上述流程中产生的Fe(OH)3、Al(OH)3沉淀混合物中回收Al(OH)3,工厂设计了如图乙的有关流程图.
a、AlCl3溶液和NaAlO2溶液反应生成Al(OH)3的离子方程式为
b、若使用如图丙流程回收处理,请比较两个流程消耗酸碱的用量?
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐3】二氧化氯消毒剂是国际公认的高效消毒灭菌剂。二氧化氯漂白液中常含有ClO2和Cl2两种主要成分。化学兴趣小组同学为测定某二氧化氯漂白液中ClO2的浓度,进行如下实验:
[实验I]配制250mL0.1mol/L的Na2S2O3溶液,步骤如下:
①用天平准确称取一定质量的Na2S2O3·5H2O固体,放入烧杯,用适量蒸馏水溶解;
②待溶液恢复至室温后,将烧杯中的溶液转移至250mL容量瓶中;
③用蒸馏水洗涤烧杯内壁和玻璃棒2~3次,并将每次洗涤的溶液转入容量瓶中,振荡;
④继续向容量瓶中加水至距刻度线1~2cm处,改用胶头滴管加水至刻度线;
⑤将容量瓶塞盖好,充分摇匀。
回答下列问题:
(1)容量瓶在使用前必须进行的操作是_______ 。
(2)配制溶液过程中需称量Na2S2O3·5H2O固体的质量为_______ g。
(3)配制溶液过程中,若未进行步骤③操作,则配制的溶液浓度_______ 。 填“偏高”、“偏低”或“无影响”
填“偏高”、“偏低”或“无影响”
[实验II]测定二氧化氯漂白液中ClO2浓度,步骤如下:
①量取5mL二氧化氯漂白液于锥形瓶中,加蒸馏水稀释到25mL,再向其中加入过量KI溶液,二氧化氯漂白液中的两种成分分别发生反应:2ClO2+2KI=2KClO2+I2、Cl2+2KI=2KCl+I2
②加入淀粉作指示剂,向其中逐滴加入0.1mol/L的Na2S2O3溶液至反应恰好完全进行,过程中发生的反应为:2Na2S2O3+I2=Na2S4O6+2NaI
③加入稀硫酸调节溶液pH=3,发生反应:KClO2+4KI+2H2SO4=KCl+2K2SO4+2I2+2H2O
④再逐滴加入0.1mol/L的Na2S2O3溶液,反应恰好完全进行时,该步消耗Na2S2O3溶液20mL。
回答下列问题:
(4)用单线桥标出反应中电子转移的方向和数目:2ClO2+2KI=2KClO2+I2。_______
(5)该二氧化氯漂白液中ClO2的浓度为_______ g/L(写出计算过程)。
[实验I]配制250mL0.1mol/L的Na2S2O3溶液,步骤如下:
①用天平准确称取一定质量的Na2S2O3·5H2O固体,放入烧杯,用适量蒸馏水溶解;
②待溶液恢复至室温后,将烧杯中的溶液转移至250mL容量瓶中;
③用蒸馏水洗涤烧杯内壁和玻璃棒2~3次,并将每次洗涤的溶液转入容量瓶中,振荡;
④继续向容量瓶中加水至距刻度线1~2cm处,改用胶头滴管加水至刻度线;
⑤将容量瓶塞盖好,充分摇匀。
回答下列问题:
(1)容量瓶在使用前必须进行的操作是
(2)配制溶液过程中需称量Na2S2O3·5H2O固体的质量为
(3)配制溶液过程中,若未进行步骤③操作,则配制的溶液浓度
 填“偏高”、“偏低”或“无影响”
填“偏高”、“偏低”或“无影响”
[实验II]测定二氧化氯漂白液中ClO2浓度,步骤如下:
①量取5mL二氧化氯漂白液于锥形瓶中,加蒸馏水稀释到25mL,再向其中加入过量KI溶液,二氧化氯漂白液中的两种成分分别发生反应:2ClO2+2KI=2KClO2+I2、Cl2+2KI=2KCl+I2
②加入淀粉作指示剂,向其中逐滴加入0.1mol/L的Na2S2O3溶液至反应恰好完全进行,过程中发生的反应为:2Na2S2O3+I2=Na2S4O6+2NaI
③加入稀硫酸调节溶液pH=3,发生反应:KClO2+4KI+2H2SO4=KCl+2K2SO4+2I2+2H2O
④再逐滴加入0.1mol/L的Na2S2O3溶液,反应恰好完全进行时,该步消耗Na2S2O3溶液20mL。
回答下列问题:
(4)用单线桥标出反应中电子转移的方向和数目:2ClO2+2KI=2KClO2+I2。
(5)该二氧化氯漂白液中ClO2的浓度为
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐1】某校课外活动小组为了探究铜与稀硝酸反应产生的气体是NO,设计了如图实验,实验过程中同时用石灰水吸收产生的氮氧化物获得应用广泛的Ca(NO3)2,实验装置如图所示:

(1)实验之前通入N2的目的是___________ 。
(2)在(1)进作后将装置A中铜丝插入稀硝酸,溶液显蓝色,有无色气体生成,其中发生反应的离子方程式是___________ ;该反应体现了硝酸的___________ 性。
(3)装置B中用注射器压入空气之后现象是___________ ;反应的化学方程式是___________ 。
(4)实际工业生产中,制备Ca(NO2)2需控制NO和NO2物质的量之比接近1:1,若n(NO):n(NO2)<1则会导致___________ 。
(5)D装置的作用是___________ 。

(1)实验之前通入N2的目的是
(2)在(1)进作后将装置A中铜丝插入稀硝酸,溶液显蓝色,有无色气体生成,其中发生反应的离子方程式是
(3)装置B中用注射器压入空气之后现象是
(4)实际工业生产中,制备Ca(NO2)2需控制NO和NO2物质的量之比接近1:1,若n(NO):n(NO2)<1则会导致
(5)D装置的作用是
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
解题方法
【推荐2】实验室用单质A模拟工业上制备含氧酸D的过程如图所示,已知D为强酸,请回答下列问题。
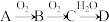
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①D的化学式是________ ;
②在工业生产中,B气体的大量排放被雨水吸收后形成了____________ 而污染了环境。
(2)若A在常温下为气体,C是红棕色的气体。
①A的化学式是____________ ;C的化学式是____________ 。
②D的浓溶液在常温下可与铜反应并生成C气体,反应的化学方程式是_________________________ 。
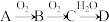
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体。
①D的化学式是
②在工业生产中,B气体的大量排放被雨水吸收后形成了
(2)若A在常温下为气体,C是红棕色的气体。
①A的化学式是
②D的浓溶液在常温下可与铜反应并生成C气体,反应的化学方程式是
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐3】含氮化合物在工农业有着重要的用途。
(1)氨气的制备:
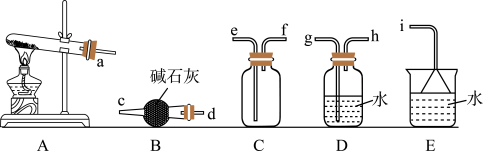
①氨气的发生装置可以选择图中的A,反应的化学方程式为___________ 。
②请写出氨气的检验方法:___________ 。
③E中倒置漏斗的作用是:___________ 。
(2) 经一系列反应可以得到
经一系列反应可以得到 :
:
①Ⅰ中, 和
和 在催化剂作用下反应,其化学方程式是
在催化剂作用下反应,其化学方程式是___________ 。
②在Ⅱ中发生的化学反应方程式:___________ 。
③在Ⅲ中,将总体积为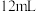 的
的 和
和 的混合气体通入水中,充分反应后还剩余
的混合气体通入水中,充分反应后还剩余 无色气体,则原混合气体中,
无色气体,则原混合气体中, 的体积为
的体积为___________ mL或___________ mL。
(1)氨气的制备:

①氨气的发生装置可以选择图中的A,反应的化学方程式为
②请写出氨气的检验方法:
③E中倒置漏斗的作用是:
(2)
 经一系列反应可以得到
经一系列反应可以得到 :
:
①Ⅰ中,
 和
和 在催化剂作用下反应,其化学方程式是
在催化剂作用下反应,其化学方程式是②在Ⅱ中发生的化学反应方程式:
③在Ⅲ中,将总体积为
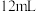 的
的 和
和 的混合气体通入水中,充分反应后还剩余
的混合气体通入水中,充分反应后还剩余 无色气体,则原混合气体中,
无色气体,则原混合气体中, 的体积为
的体积为
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
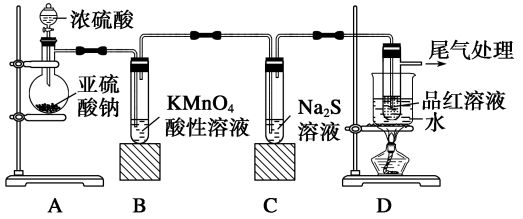
【推荐1】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。
(1)装置A中盛放亚硫酸钠(Na2SO3)的仪器名称是_______ ,若将亚硫酸钠改为铜片,与浓硫酸反应制取SO2,还缺少的仪器有_______ ,写出用铜片制取SO2的化学方程式_______ 。
(2)实验过程中,装置B中紫红色变为无色,说明SO2具有_______ (填“氧化性”或“还原性”),C中无色溶液中出现黄色浑浊,说明SO2具有_______ (填“氧化性”或“还原性”)。
(3)装置D的目的是探究SO2与品红溶液作用的可逆性,请写出实验操作及现象_______ 。
(1)装置A中盛放亚硫酸钠(Na2SO3)的仪器名称是
(2)实验过程中,装置B中紫红色变为无色,说明SO2具有
(3)装置D的目的是探究SO2与品红溶液作用的可逆性,请写出实验操作及现象
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐2】1,2-二溴乙烷用途广泛,可用作汽油抗震液中铅的消除剂和脂肪、树脂等的溶剂等。实验室用液溴和乙醇制备1,2-二溴乙烷的装置如图所示(加热装置和尾气处理装置省略):
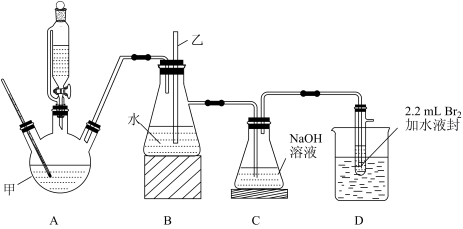
已知:1,2-二溴乙烷的沸点为131.4℃,熔点为9.3℃。液溴的沸点为58.8℃,熔点为-7.2℃。
(1)仪器甲的名称为____ ,装置A中制备乙烯的化学方程式为____ 。
(2)在此制备实验中,要把装置A的温度快速地提高到反应温度,最主要目的是____ (填标号)。
a.引发反应 b.加快反应速率 c.防止乙醇挥发 d.减少副产物乙醚生成
(3)仪器乙是玻璃管,装置B的作用为____ 。
(4)如果没有装置C,则装置D中还可能发生反应的化学方程式为____ 。
(5)装置D中烧杯内盛装的是冷水,反应过程中冷水的温度不能过高也不能太低(如冰水混合物的温度)的主要原因是___ 。
(6)若产物中有少量未反应的Br2,最好用____ (填标号)洗涤除去。
a.水 b.Na2SO3溶液 c.碘化钠溶液 d.乙醇
(7)待装置D中颜色褪去,将粗产物依次用质量分数为10%的氢氧化钠溶液和水洗涤分液后,再向有机层中加入适量无水氯化钙,过滤,把滤液转移至蒸馏烧瓶中蒸馏,收集130~132℃的馏分,得列产品3.52g。已知反应前装置D的试管中加入的液溴为2.2mL(约为0.04mol),则该实验所得产品的产率为____ (保留三位有效数字)。

已知:1,2-二溴乙烷的沸点为131.4℃,熔点为9.3℃。液溴的沸点为58.8℃,熔点为-7.2℃。
(1)仪器甲的名称为
(2)在此制备实验中,要把装置A的温度快速地提高到反应温度,最主要目的是
a.引发反应 b.加快反应速率 c.防止乙醇挥发 d.减少副产物乙醚生成
(3)仪器乙是玻璃管,装置B的作用为
(4)如果没有装置C,则装置D中还可能发生反应的化学方程式为
(5)装置D中烧杯内盛装的是冷水,反应过程中冷水的温度不能过高也不能太低(如冰水混合物的温度)的主要原因是
(6)若产物中有少量未反应的Br2,最好用
a.水 b.Na2SO3溶液 c.碘化钠溶液 d.乙醇
(7)待装置D中颜色褪去,将粗产物依次用质量分数为10%的氢氧化钠溶液和水洗涤分液后,再向有机层中加入适量无水氯化钙,过滤,把滤液转移至蒸馏烧瓶中蒸馏,收集130~132℃的馏分,得列产品3.52g。已知反应前装置D的试管中加入的液溴为2.2mL(约为0.04mol),则该实验所得产品的产率为
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐3】某学习小组设计了如图装置用于制取 并验证其性质。
并验证其性质。
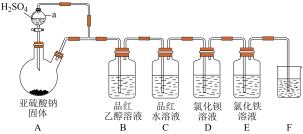
(1)写出实验室制备 的化学方程式
的化学方程式___________ 。
(2)若装置B中溶液无明显现象,装置C中溶液红色褪去,则使品红的水溶液褪色的含硫微粒一定不是___________ (填化学式)。该实验的一个明显缺陷为:___________ 。
(3)该实验小组的甲、乙两位同学为了进一步探究 的漂白性,按如图装置继续进行实验并记录相关实验现象。
的漂白性,按如图装置继续进行实验并记录相关实验现象。

根据表中实验现象做出合理解释。
(4)该实验小组的学生丙预测装置D中没有白色沉淀产生,但随着反应的进行,发现装置D中产生了少量白色沉淀。为进一步探究产生沉淀的原因,分别用煮沸和未煮沸过的蒸馏水配制的 和
和 溶液,进行如图实验:
溶液,进行如图实验:
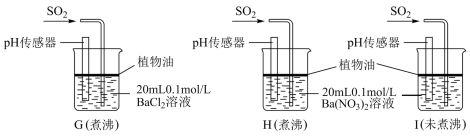
实验中G、H、I烧杯中观察到的现象如表:
①据G中现象推测D中产生的白色沉淀的化学式是___________ 。
②据I中出现白色沉淀的速率比H中快很多 的现象,推测其根本原因可能是___________ 。
③如果想使装置G中出现白色沉淀现象,还可以向D中滴加___________ (填序号)
A.稀硝酸 B.氢氧化钠溶液 C.氯水 D.盐酸
 并验证其性质。
并验证其性质。
(1)写出实验室制备
 的化学方程式
的化学方程式(2)若装置B中溶液无明显现象,装置C中溶液红色褪去,则使品红的水溶液褪色的含硫微粒一定不是
(3)该实验小组的甲、乙两位同学为了进一步探究
 的漂白性,按如图装置继续进行实验并记录相关实验现象。
的漂白性,按如图装置继续进行实验并记录相关实验现象。
根据表中实验现象做出合理解释。
| 组别 | 实验现象 | 合理解释 |
| 甲 | 品红溶液几乎不褪色 | 反应方程式为 |
| 乙 | 品红溶液随时间的推移变得越来越浅 | 原因可能是 |
 和
和 溶液,进行如图实验:
溶液,进行如图实验:
实验中G、H、I烧杯中观察到的现象如表:
| 烧杯 | 实验现象 |
| G | 无白色沉淀产生,pH传感器测的溶液pH=5.3 |
| H | 有白色沉淀产生 |
| I | 有白色沉淀产生,I中出现白色沉淀比H中快很多 |
②据I中出现白色沉淀的速率比H中
③如果想使装置G中出现白色沉淀现象,还可以向D中滴加
A.稀硝酸 B.氢氧化钠溶液 C.氯水 D.盐酸
您最近一年使用:0次



